Сравнительный анализ количественных данных компьютерной томографии и морфологического исследования у пациентов с гигантоклеточной опухолью кости при лечении деносумабом
Автор: Табакаев Станислав Алексеевич, Фролова Ирина Георгиевна, Анисеня Илья Иванович, Васильев Николай Вольтович, Богоутдинова Анна Владимировна, Ситников П.К.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.20, 2021 года.
Бесплатный доступ
Введение. Гигантоклеточная опухоль кости (ГКО) выявляется в 4-9,5 % всех первичных костных опухолей и является наиболее частой доброкачественной первичной костной опухолью. До настоящего времени методом выбора в лечении ГКО считалось оперативное вмешательство. Однако в последние годы для лечения данной опухоли используют генноинженерный препарат - деносумаб, являющийся по механизму действия остеомоделирующим агентом. Наиболее объективным методом оценки эффективности проведенного лечения является морфологическое исследование операционного материала. Однако в определенных ситуациях необходимо иметь сведения об эффективности консервативной терапии на этапах ее реализации. Цель исследования - сопоставить выявленные при КТ-денситометрии изменения с данными морфологического исследования у пациентов с гигантоклеточной опухолью кости при применении деносумаба. Материал и методы. В исследование включены 30 пациентов, в возрасте 28-59 лет, с морфологически верифицированным диагнозом гигантоклеточной опухоли, получивших комбинированное лечение таргетным препаратом деносумаб с последующей операцией в объеме различного вида резекций. Оценивались структура опухоли на этапах проведения терапии деносумабом, а также морфологические препараты после резекций. Результаты. Выявлена зависимость между результатами КТ-денситометрии и данными морфологического исследования операционного материала. Выводы. С помощью КТ-денситометрии возможно предсказать выраженность терапевтического патоморфоза.
Гигантоклеточная опухоль кости, деносумаб, кт-денситометрия, морфология
Короткий адрес: https://sciup.org/140254425
IDR: 140254425 | УДК: 616.71-006.6-073.756.8-078-08:615.2 | DOI: 10.21294/1814-4861-2021-20-2-22-28
Текст научной статьи Сравнительный анализ количественных данных компьютерной томографии и морфологического исследования у пациентов с гигантоклеточной опухолью кости при лечении деносумабом
Гигантоклеточная опухоль (ГКО) кости является первичным костным новообразованием, которое в основном поражает молодых людей в возрасте 20–40 лет, это доброкачественные, но местно агрессивные опухоли, в некоторых случаях они имеют тенденцию к метастазированию. Гигантоклеточные опухоли составляют примерно 5 % всех новообразований костей и 20 % доброкачественных опухолей скелета [1–3].
Клиническая картина при ГКО неспецифична. Чаще всего заболевание манифестирует дискомфортом в области опухолевого поражения, с течением времени присоединяется болевой синдром, связанный с нагрузкой. В отсутствие адекватного лечения клиническая симптоматика прогрессирует, присоединяются боли в покое и ночные боли. Также появление болевого синдрома связано с патологическим переломом. Контрактуры сустава при расположении опухоли возле суставного конца кости, как правило, не возникает, ограничение подвижности связано с болевым синдромом. Биологические особенности опухоли обусловлены тем, что ткань новообразования хорошо васкуляризирована. Кроме обычного сосудистого кровотока имеется эмбриональная перфузия, поэтому отдельные клетки легко попадают в кровоток. Этим, вероятно, обусловлены частое рецидивирование и воз- можность метастазирования. Также наблюдается малигнизация гигантоклеточной опухоли кости типичного строения на фоне местных рецидивов и в том числе после проведения лучевой терапии. Рецидивы встречаются практически у трети пациентов [4].
Гистологически при ГКО выявляется пролиферация от круглых до овальных, многоугольных или удлиненных мононуклеарных клеток, выявляемых одновременно с многочисленными крупными остеокластоподобными гигантскими клетками, которые имеют от 50 до 100 ядер. Гигантские клетки имеют центрально расположенные ядра и широкий тонкий периферический ободок ацидофильной цитоплазмы. Считается, что они возникают из стромальных клеток мононуклеарного ряда. Митозы могут присутствовать, однако атипичные митозы могут говорить о трансформации в злокачественную, богатую гигантскими клетками саркому [5].
Основной метод лечения – хирургический в виде различных вариантов резекций с замещением дефекта пластическими материалами и эндопротезами. Выбор между различными видами сохранных резекций и расширенными сегментарными резекциями является постоянной проблемой ортопедической онкологии [6–9]. В последнее время для лечения ГКО появился новый генноинженерный препарат – деносумаб, который обла- дает способностью замедлить прогрессирование опухолевого процесса. Деносумаб представляет собой человеческое моноклональное антитело (IgG2k), обладающее высокой специфичностью к лиганду рецептора активатора ядерного фактора кВ (RANKL) и тем самым препятствующее активации ядерного фактора кВ (RANK), расположенного на поверхности остеокластов и их предшественников. В результате деносумаб ингибирует созревание, активацию и продолжительность существования остеокластов, тем самым уменьшая костную резорбцию и увеличивая массу и прочность кортикального и трабекулярного слоев кости [10, 11].
Оптимальная продолжительность лечения остеомоделирующими агентами, которым является деносумаб, пока окончательно не определена. Считается, что оно должно продолжаться до появления клинически значимых осложнений терапии или существенного ухудшения состояния вследствие прогрессирования болезни. Вместе с тем не рекомендуется использовать биохимические маркеры костного метаболизма в повседневной клинической практике для мониторинга эффективности лечения [12].
Цель исследования – сопоставить изменения, выявленные при КТ-денситометрии, с данными морфологического исследования у пациентов с гигантоклеточной опухолью кости при применении деносумаба.
Материал и методы
В исследование включены 30 пациентов с гигантоклеточной опухоли, в возрасте 28–59 лет (42,2 ± 2,7 года), из них мужчин – 12 (40 %), женщин – 18 (60 %). Во всех случаях получена морфологическая верификация диагноза. Больные получали комбинированное лечение деносумабом с последующим хирургическим вмешательством в объеме различного вида резекций.
В процессе терапии деносумабом структура опухоли оценивалась при компьютерной томографии на следующих этапах лечения: до начала курса, через 3 и через 6 введений препарата. Спиральная компьютерная томография выполнялась на компьютерном томографе «Somatom Emotion 6» по программе спирального сканирования с тол- щиной реконструируемого среза 2,5 мм. Каждый сканируемый участок исследовался в костном и мягкотканом окне. Анализ полученных результатов осуществлялся 2 способами: визуальным и денситометрическим. Визуально анализировалась локализация опухолевого очага в кости, размеры, контуры. Денситометрический анализ для количественной оценки эффекта лечения проводился по данным КТ с оценкой показателей плотностных характеристик опухоли и окружающей костной ткани, оценивали средние значения абсолютной плотности (M) в единицах Хаунсфилда с учетом изменения среднего отклонения плотности (SD). В качестве референсных показателей использованы данные исследования аналогичной зоны и аналогичных точек здоровой конечности путем измерения плотности всей кости в аксиальной проекции без кортикального слоя. Зоной исследования был средний отдел опухоли. Путем построения закрытых многоугольников ROI была исследована плотность и ее среднее отклонение внутри многоугольника на указанном уровне опухоли, а также денситометрические показатели здорового сегмента кости, соответствующего зоне поражения (рис. 1).
На основании полученных данных определялся «индекс относительной плотности опухоли» в виде отношения денситометрической плотности опухоли к плотности здоровой кости:
k=A/B, где k – «индекс относительной плотности опухоли», А – среднее значение абсолютной плотности в единицах Хаунсфилда опухоли, В – среднее значение абсолютной плотности в единицах Хаунсфилда здоровой кости без включения кортикального слоя. За единицу в данном случае брали значение плотности здоровой кости на аналогичном уровне исследования.
Для оценки динамики изменения структуры опухоли на этапах лечения были рассчитаны темпы прироста средних значений плотности (Т сз^Х /Х^) и среднего отклонения (Tncoo=Y n / /Yn-1-1), где Т – темп прироста, Xn и Yn – данные плотности (Х) и среднего отклонения плотности (Y)
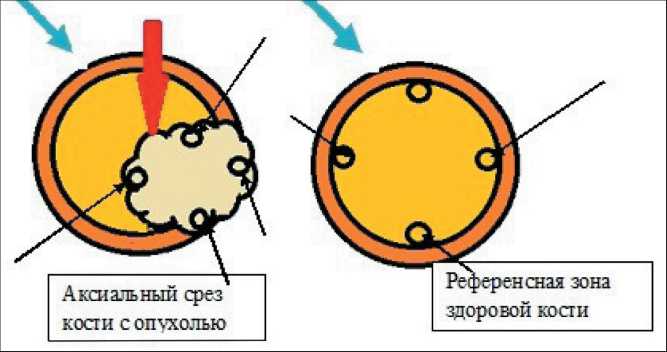
Рис. 1. Черными стрелками отмечены опорные точки для построения закрытых многоугольников. Красной стрелкой обозначена зона склероза, синей стрелкой – кортикальный слой кости
Fig. 1. The black arrows mark the anchor points for the construction of closed polygons. The red arrow indicates the area of sclerosis, blue arrow indicates cortical bone
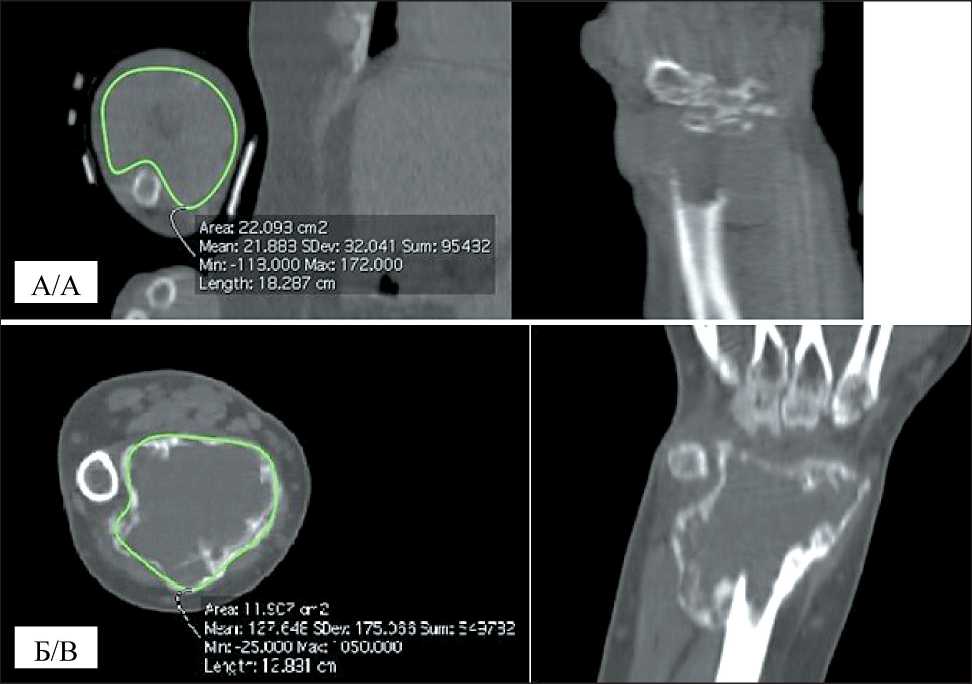
Рис. 2. СКТ. ГКО дистального эпиметафиза лучевой кости до лечения (а) и после шести введений деносумаба (б) Fig. 2. CT-scan. GCT of the distal radial epimetaphysis before treatment (a) and after six injections of denosumab (b)
исследуемого курса применения препарата, Хn-1 и Yn-1 – данные плотности и среднего отклонения плотности предыдущего курса.
Для оценки морфологических изменений использовались данные биопсийного материала до применения препарата, а также операционного материала с оценкой удельного соотношения выявленных элементов в препарате. В операционном материале брали один срез толщиной 1–1,5 см в плоскости максимального размера, соответствующий изучаемому при компьютерной томографии. В каждом сегменте определяли соотношение резидуальных «живых» клеток опухоли, костной ткани, рыхлой соединительной ткани, воспалительного компонента, некроза.
Статистическая обработка данных проводилась с помощью компьютерной программы «Statistica 10.0». Так как не определялось согласия с нормальным законом распределения, в выборках использовались непараметрические критерии (критерий знаков, критерий Вилкоксона и критерий Фридмана для анализа зависимых переменных, а также коэффициент ранговой корреляции Спирмена). Качественная характеристика тесноты связи коэффициента ранговой корреляции (r) оценивалась по шкале Чеддока. При этом значение коэффициента менее 0,25 расценивалось как наличие слабой связи, от 0,25 до 0,75 определяло умеренную связь, более 0,75 – сильную. Данные значения шкалы определялись по модулю. Если r>0, то связь расценивалась как прямая, если r<0, то как обратная. Различие считалось статистически значимым при p<0,05.
Результаты и обсуждение
Проанализарованы данные компьютерной томографии 30 пациентов с гигантоклеточной опухолью кости, получавших комбинированное лечение, включавшее таргетный препарат де-носумаб. Распределение опухоли относительно локализации в скелете выглядело следующим образом: дистальные отделы лучевой кости – 12 (40 %), область коленного сустава (дистальные отделы бедренной кости, проксимальные отделы большеберцовой кости) – 15 (50 %), дистальные отделы большеберцовой кости, таранная кость, 2-я пястная кость – по 1 (вместе 10 %). Патологический перелом наблюдался у 5 (16,7 %) пациентов.
При визуальной оценке опухоли участок поражения кости во всех случаях был представлен литической опухолью ячеисто-трабекулярного характера с неровными контурами, с наличием внекостного мягкотканого компонента разной степени выраженности. Целостность кортикального слоя была нарушена во всех случаях в различной степени выраженности. Размеры участка поражения в аксиальной проекции колебались от 35 мм до 68 мм по наибольшей из осей опухоли.
На этапах применения деносумаба отмечено нарастание неоднородности участка поражения кости за счет появления оссификатов различных размеров у 10 (33,3 %) пациентов, а также усиление проявления ячеистости внутренней структуры, выявленной изначально у 20 (66,7 %) больных. Во всех случаях определялась деформация пораженного сегмента кости, появление склеротического контура, ограничивающего опухоль от окружающих мягких тканей (рис. 2).
Морфологическая оценка проводилась по схеме Хувоса (1977) для определения степени патоморфоза остеосаркомы. В данной схеме предусматривается четыре степени патоморфоза, где Grade 1 – нет эффекта, Grade 2 – наличие 6–49 % резидуальных опухолевых клеток, Grade 3 – на-
Таблица/Table
Результаты денситометрического анализа и морфологического исследования пациентов с ГКО Results of densitometric analysis and histological examination of patients with GCS
|
Пациент/ Patient |
Пол/ Gender |
Возраст/ Age |
6M |
k6М |
Стадия/ Grade |
Соотношение элементов в морфологическом препарате/ The ratio of elements in the surgical specimen |
|||
|
Опухолевые клетки/ Tumor cells |
Кость/ Bone |
Соединительная ткань/ Connective tissue |
Некроз/ Necrosis |
||||||
|
1 |
m |
56 |
86,4 |
0,69 |
3 |
1 |
0,33 |
0,41 |
0,26 |
|
2 |
f |
44 |
374,3 |
2,28 |
4 |
0 |
0,5 |
0,4 |
0,1 |
|
3 |
f |
31 |
186,2 |
1,14 |
4 |
0 |
0,47 |
0,37 |
0,16 |
|
4 |
f |
36 |
186,3 |
1,33 |
4 |
0 |
0,46 |
0,38 |
0,16 |
|
5 |
f |
30 |
146,8 |
1,09 |
4 |
0 |
0,38 |
0,37 |
0,25 |
|
6 |
f |
58 |
236,9 |
1,5 |
4 |
0 |
0,5 |
0,4 |
0,1 |
|
7 |
f |
58 |
179,6 |
1,13 |
4 |
0 |
0,5 |
0,4 |
0,1 |
|
8 |
m |
37 |
212,8 |
1,52 |
4 |
0 |
0,5 |
0,4 |
0,1 |
|
9 |
f |
28 |
508,7 |
3,08 |
4 |
0 |
0,5 |
0,4 |
0,1 |
|
10 |
m |
43 |
196,4 |
1,32 |
4 |
0 |
0,5 |
0,4 |
0,1 |
|
11 |
m |
41 |
153,5 |
0,99 |
4 |
0 |
0,42 |
0,43 |
0,15 |
|
12 |
f |
58 |
163,2 |
1,16 |
3 |
1 |
0,38 |
0,46 |
0,16 |
|
13 |
m |
29 |
66,5 |
0,47 |
3 |
1 |
0,31 |
0,37 |
0,27 |
|
14 |
f |
33 |
90,6 |
0,59 |
3 |
1 |
0,34 |
0,34 |
0,27 |
|
15 |
m |
59 |
139,5 |
0,98 |
4 |
0 |
0,43 |
0,39 |
0,18 |
|
Примечание: |
6M – среднее значение плотности опухоли после 6 введений препарата, k6M – индекс относительной плотности опухоли после |
||||||||
|
6 введений препарата. |
|||||||||
Notes: 6M – the mean value of the tumor density after 6 injections of denosumab, k6M – the idex of the relative tumor density after 6 injections of denosumab.
личие жизнеспособной опухоли ≤5 %, Grade 4 – без жизнеспособной опухоли [13]. У 22 (73,3 %) пациентов определялась степень патоморфоза Grade 4, у 8 (26,7 %) больных – Grade 3.
Также учитывалось удельное соотношение других элементов, выявленных в препарате. Были выявлены рыхлая соединительная ткань, костная ткань, воспалительный компонент, некроз. Рыхлая соединительная ткань представляла собой слабо полиморфные клетки эпителиоидного и веретеновидного типа с гипохромным ядром, с ядрышком, с неширокой светлой или бледно-эозинофильной цитоплазмой, образующие пучковые, вихревые, солидные структуры, лежащие в умеренном рыхлом матриксе с многочисленными очаговыми лимфоидно-плазмоцитарными инфильтратами, с очаговыми кровоизлияниями, с очаговыми скоплениями ксантомных клеток, с очаговыми включениями жировой ткани. Количество рыхлой соединительной ткани в препарате варьировало от 37 до 42 %. Костная ткань была представлена двумя типами: незрелая костная ткань губчатого типа, соединительная ткань с незначительным содержанием незрелого костного компонента. В препарате костная ткань занимала от 30 до 50 %. Также при исследовании выявлялся некроз в 10–30 % препарата.
Зависимость количественных данных об элементах в морфологическом препарате и денситоме-трических показателей исследовалась с помощью коэффициента ранговой корреляции Спирмена.
При этом определялась сильная прямая связь со средним значением плотности после 6 введений препарата (r=0,922), а также с индексом относительной плотности опухоли после 6 введений (r=0,875) (таблица). Кроме того, выявлено, что чем выше показатели среднего значения плотности и индекса относительной плотности опухоли, тем больший процент костной ткани определяется в препарате. При оценке данных изменений относительно пола отмечалась несколько большая зависимость у мужчин (r=0,945 – у мужчин против r=0,773 – у женщин).
Также выявлена сильная обратная связь между количественными показателями костной ткани и некроза в гистологическом препарате (r=-0,965). Количественные данные о некрозе имели обратную связь с показателями среднего значения плотности, среднего отклонения плотности и индекса относительной плотности опухоли с увеличением этой зависимости на этапах терапии и выражением более сильной корреляции после 6 курсов для среднего значения плотности и индекса относительной плотности опухоли – -0,896 и -0,871 соответственно. При анализе данных относительно пола пациентов также выявлена более сильная связь между показателями у мужчин.
При анализе показателей среднего значения плотности и индекса относительной плотности опухоли после 6 курсов терапии деносумабом и отдельных случаев наличия опухолевых клеток в морфологиче- ском препарате, что позволяло трактовать степень патоморфоза как Grade 3, использовались медианы и квартили. Так, при наличии опухолевых клеток показатель среднего значения плотности составил 87,8 (78,3; 112,4), индекс относительной плотности опухоли – 0,65 (0,53; 0,82). В остальных случаях, когда опухолевых клеток не было найдено, среднее значение плотности было 190,9 (161,8; 230,6), индекс относительной плотности опухоли – 1,31 (1,13; 1,5). Это может означать, что при средней плотности опухоли, больше или равной 161,8 единицы Хаунсфилда, можно, с большей долей вероятности, предполагать отсутствие опухолевых клеток в морфологическом препарате после 6 курсов введения деносумаба. При значении индекса относительной плотности опухоли менее 0,82 высока вероятность наличия резидуальных опухолевых клеток. При
Список литературы Сравнительный анализ количественных данных компьютерной томографии и морфологического исследования у пациентов с гигантоклеточной опухолью кости при лечении деносумабом
- Huh A., Villelli N., Martinez D., Ting J., Birhiray R., Payner T.D., Kulwin C.G. Denosumab Treatment for a Residual Giant Cell Tumor of the Clivus: A Case Report and Review of the Literature. World Neurosurg. 2018 Oct; 118: 98-101. https://doi.org/10.1016/j.wneu.2018.06.242.
- Bachini P., Bertoni F., Boulytcheva I. Differential diagnosis of giant cell-containing bone lesions. Sarcomas of bones, soft tissues and skin tumors. 2013; 3: 31-38.
- Oktay K., Guzel E., Simsek S., Guzel A. Giant cell tumor of the eleventh thoracic vertebra in a pediatric patient: an interesting case report and comprehensive literature review. Childs Nerv Syst. 2019 Mar; 35(3): 553-557. https://doi.org/10.1007/s00381-018-3980-x.
- Dianov S.V. Ad"yuvantnoe kriovozdeistvie v lechenii gigantokletochnoi opukholi kosti. Travmatologiya i ortopediya Rossii. 2018; 24(1): 8-17. https://doi.org/10.21823/2311-2905-2018-24-1-8-17.
- Amanatullah D.F., Clark T.R., Lopez M.J., Borys D., Tamurian R.M. Giant cell tumor of bone. Orthopedics. 2014 Feb; 37(2): 112-20. https://doi.org/10.3928/01477447-20140124-08.
- Balberkin A.V., Shavyrin D.A. Klinika, diagnostika i khirurgicheskoe lechenie opukholei kostei oblasti kolennogo sustava (obzor literatury). Sarkomy kostei, myagkikh tkanei i opukholi kozhi. 2013; (1): 15-23.
- Tikhilov R.M., Ptashnikov D.A., Mikailov I.M., Zasul'skii F.Yu., Grigor'ev P.V. Operativnoe lechenie bol'nykh c gigantokletochnoi opukhol'yu kostei. Onkologiya. Zhurnal im. P.A. Gertsena. 2017; 6(1): 5-11. https://doi.org/10.17116/onkolog2017615-11.
- Tadzhibaev A.A., Gafur-Akhunov M.A. Optimizatsiya metodov khirurgicheskogo lecheniya pri gigantokletochnoi opukholi trubchatykh kostei. Evraziiskii onkologicheskii zhurnal. 2015; 4(7): 52-59.
- Terskov A.Yu., Ivanov V.V., Nikolaenko A.N. Nasha taktika v diagnostike i lechenii bol'nykh s gigantokletochnymi opukholyami kostei. Genii ortopedii. 2013; (2): 67-71.
- Dydykina P.S., Petrova E.V., Dydykina I.S., Smirnov A.V., Murav'ev Yu.V., Glukhova S.I., Nasonov E.L. Dinamika kliniko-rentgenologicheskikh pokazatelei na fone terapii denosumabom u bol'nykh revmatoidnym artritom, poluchayushchikh glyukokortikoidy: predvaritel'nye rezul'taty. Nauchno-prakticheskaya revmatologiya. 2015; 53(4): 397-402. https://doi.org/10.14412/1995-4484-2015-397-402.
- Gershtein E.S., Timofeev Yu.S., Zuev A.A., Kushlinskii N.E. Ligand-retseptornaya sistema RANK/RANKL/OPG i ee rol' pri pervichnykh novoobrazovaniyakh kostei (analiz literatury i sobstvennye rezul'taty). Uspekhi molekulyarnoi onkologii. 2015; 3(2): 51-59. https://doi.org/10.17650/2313-805X-2015-2-3-51-59.
- Manzyuk L.V., Bagrova S.G., Kopp M.V., Kutukova S.I., Semiglazova T.Yu. Ispol'zovanie osteomodifitsiruyushchikh agentov dlya profilaktiki i lecheniya patologii kostnoi tkani pri zlokachestvennykh novoobrazovaniyakh. Zlokachestvennye opukholi: Prakticheskie rekomendatsii RUSSCO. 2017; 7: 3s2: 477-485.
- Huvos A.G., Rosen G., Marcove R.C. Primary osteogenic sarcoma: pathologic aspects in 20 patients after treatment with chemotherapy en bloc resection, and prosthetic bone replacement. Arch Pathol Lab Med. 1977 Jan; 101(1): 14-8.


