Сравнительный анализ первично-забрюшинного и трансабдоминального доступов в лапароскопической хирургии рака левых отделов ободочной кишки: исследование типа "случай-контроль"
Автор: Ефетов С.К., Зубайраева А.А., Козий А.Ю.
Журнал: Московский хирургический журнал @mossj
Рубрика: Онкология
Статья в выпуске: 4 (90), 2024 года.
Бесплатный доступ
Введение. В хирургическом лечении рака левых отделов ободочной кишки доступно использование как первично-забрюшинного, так и трансабдоминального доступов при выполнении лимфодиссекции. Технически оба доступа осуществимы при помощи системы хирургических плоскостей и анатомических ориентиров.Материалы и методы. В исследование было включено 28 пациентов, которым выполнялось малоинвазивное вмешательство по поводу аденокарциномы левых отделов ободочной кишки с использованием навигации в пределах виртуальных плоскостей. В результате группировки пациентов по возрасту, полу, индексу массы тела (ИМТ), ASA и уровню перевязки нижней брыжеечной артерии в соотношении 1:1 было подобрано 14 пар пациентов. Проведен сравнительный анализ непосредственных результатов хирургического лечения с использованием классического трансабдоминального и первично-забрюшинного доступов.Результаты. Длительность операции (250 мин против 305 мин, p=0.277), кровопотеря (50 мл против 75 мл, p=0.946), количество апикальных (3 штуки против 2 штук, p=0.376) лимфоузлов статистически значимо не отличались. Время до отхождения газов (1 день против 1 дня, p=0.874) и появления первого стула (3,5 дня против 3 дней, p=0.804), сроки госпитализации (8 дней против 8 дней, p=0.874), а также частота послеоперационных осложнений (p=0.308) были сопоставимы в обеих группах.Заключение. Первично-забрюшинный доступ может быть использован в качестве альтернативы трансабдоминальному доступу в хирургии рака левых отделов ободочной кишки. Следование анатомическим ориентирам и «плоскостной навигации» позволяет получать сопоставимые непосредственные результаты хирургического лечения из обоих доступов.
Колоректальный рак, д3-лимфодиссекция, лапароскопическая хирургия, первично-забрюшинный доступ, рак ободочной кишки
Короткий адрес: https://sciup.org/142243808
IDR: 142243808 | УДК: 617.-089 | DOI: 10.17238/2072-3180-2024-4-126-135
Текст научной статьи Сравнительный анализ первично-забрюшинного и трансабдоминального доступов в лапароскопической хирургии рака левых отделов ободочной кишки: исследование типа "случай-контроль"
Колоректальный рак занимает третье место по встречаемости в структуре онкологических заболеваний [1]. Основным методом лечения колоректального рака остается хирургический, что обусловливает актуальность исследований, направленных на улучшение качества хирургической помощи. Малоинвазивная хирургия колоректального рака стала стандартом в лечении локализованных форм колоректального рака [2, 3].
В 2023 году было предложено использовать первично-забрюшинный доступ к сосудосберегающей лимфодиссекции при раке левых отделов ободочной кишки [4]. Непосредственные результаты лечения первой выборки пациентов с использованием первично-забрюшинного доступа к Д3 лимфодиссекции с сохранением кровотока по нижней брыжеечной артерии показали, что предложенный метод безопасен, не ассоциирован с высокой частотой осложнений и послеоперационной летальностью, что позволяет продолжить его изучение [5]. Однако, сравнительный анализ результатов хирургического лечения с использованием первично-забрюшинного доступа и традиционного трансабдоминального доступа еще не проводился.
Целью настоящего исследования стало сравнить непосредственные результаты лечения по поводу рака левой половины ободочной кишки с использованием первично-забрюшинного и трансабдоминального доступов в малоинвазивной хирургии c использованием системы плоскостей и анатомических ориентиров для стандартизации оперативных вмешательств из различных доступов.
Материалы и методы
В исследование вошли пациенты, которым выполнялись малоинвазивные хирургические вмешательства по поводу злокачественных новообразований левых отделов ободочной кишки в период с апреля 2022 года по май 2024 года в объеме
сегментарной резекции левых отделов ободочной кишки с Д3-лимфодиссекцией.
Критериями включения стали: 1) гистологически верифицированная аденокарцинома, 2) опухоль селезеночного изгиба ободочной кишки, нисходящей ободочной кишки, сигмовидной кишки, ректосигмоидного соединения ободочной кишки, 3) лимфодиссекция в объеме Д3, 4) малоинвазивное вмешательство с использованием лапароскопической техники, 5) операция с сохранением кровотока по нижней брыжеечной артерии (НБА).
В исследование вошло 28 пациентов, которым была выполнена резекция левых отделов ободочной кишки с лимфодиссекцией из первично-забрюшинного и классического трансадоминаль-ного доступов. Было подобрано 28 пациентов (14 пар) в соотношении 1:1 для исследования по типу «случай-контроль».
Пациенты в парах соответствовали друг другу по возрастной группе, полу, индексу ASA, ИМТ и уровню пересечения НБА.
Статистический анализ данных
Статистический анализ был проведен при помощи программы SPSS 26 (SPSS Inc., Чикаго, США).
Категориальные переменные выражались в абсолютных значениях и процентах от общего числа. Для оценки различий между двумя выборками использовали критерий хи-квадрат Пирсона или тест Фишера, если его использование было допустимо.
Количественные переменные были представлены медианой и межквартильным размахом (Me±IQR). Для оценки различий между двумя независимыми выборками использовали критерий Манна-Уитни.
Хирургическое лечение
Всем пациентам были выполнены хирургические вмешательства в объеме сегментарных резекций участка кишки,
пораженного опухолью и расширенной Д3-лимфодиссекцией с радикальными намерениями. При выполнении лимфодиссекции использовался сосудо-сберегающий подход, при котором выполнялось селективное пересечения артерии, кровоснабжающей пораженный участок кишки с сохранением кровотока по НБА.
При локализации опухоли в селезеночном изгибе и нисходящей ободочной кишке пересекалась левая ободочная артерия (ЛОА) с сохранением верхней прямокишечной артерии (ВПА). При локализации опухоли в проксимальной части сигмовидной кишки выполнялась резекция левых отделов ободочной кишки с пересечением сигмовидных артерией. При локализации опухоли в дистальной части сигмовидной кишки и ректосигмоидном соединении пересекалась ВПА после отхождения ЛОА [6].
Для более уверенной навигации хирурга во время операции вне зависимости от доступа, нами были применена виртуальная трехмерная хирургическая модель, для которой обозначены плоскости диссекции и анатомические ориентиры.
Сагиттальная плоскость проходит вдоль медиального края брыжейки левых отделов ободочной кишки на уровне фиксации фасции к брюшине, покрывающей аорту — medial mesenteric edge plane (MME-plane, рис. 1).
Фронтальная плоскость располагается между париетальной мезоколической фасцией и преренальной фасцией и соответствует бессосудистой зоне диссекции, используемой для мобилизации мезоколон по задней поверхности — mesocolic interfascial plane (MIF-plane, рис. 1).
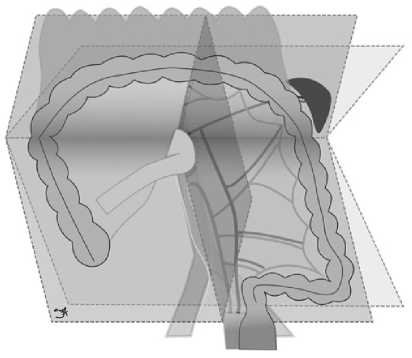
Рис. 1. Плоскости разделения тканей при выполнении Д3 лимфодиссекции при раке левых отделов ободочной кишки: 1) MME plane — сагиттальная плоскость, 2) MIF plane — фронтальная плоскость, 3) GPE plane — аксиальная плоскость
Fig. 1. Surgical planes of dissection in D3 lymph node dissection for left colon cancer: 1) MME plane — sagittal plane, 2) MIF plane — frontal plane, 3) GPE plane — axial plane
Результаты
Группы пациентов с трансабдоминальным и забрюшинным доступом были сопоставимы по возрасту, полу, ИМТ, ASA и уровню пересечения сосудов. Следует отметить, что группы также статистически значимо не различались по степени инвазии опухоли (p=0.343), поражения регионарных лимфоузлов (p=0.127), отдаленному метастазированию (p=0.513), а также конечной стадии опухолевого процесса (p=0.466) (табл. 1).
Таблица 1
Демографические и клинические характеристики пациентов, оперированных по поводу рака левых отделов с использованием первично-забрюшинного и трансабдоминального доступов
Table 1
Demographic and clinical characteristics of the patients, who underwent surgical treatment for left colon cancer using conventional transabdominal and primary retroperitoneal approach
|
Параметр Parameter |
Лапароскопический трансабдоминальный доступ (n=14), Conventional transabdominal approach (n=14) |
Первично-забрюшинный доступ (n=14), Primary retroperitoneal approach (n=14) |
Значение p, p-value |
|
Возраст, годы, Me (IQR)* Age, years, Me (IQR) |
62.5 (49–68) |
58.0 (53–66) |
0.982 |
|
ИМТ, кг/м2, Me (IQR) BMI, kg/м2, Me (IQR) |
25.0 (23.8–28.7) |
24.6 (22.9–29.3) |
0.603 |
|
Пол, n (%) Gender, n (%) |
|||
Продолжение Таблицы 1
|
Мужской Male |
6 (429) |
6 (42.9) |
1.000 |
|
Женский Female |
8 (57.1) |
8 (57.1) |
|
|
Индекс ASA*, n (%) ASA, n (%) |
|||
|
ASA 1 |
0 (0.0) |
0 (0.0) |
0.704 |
|
ASA 2 |
7 (50.0) |
5 (35.7) |
|
|
ASA 3 |
7 (50.0) |
9 (64.3) |
|
|
Локализация опухоли Tumor site |
|||
|
Селезеночный изгиб Splenic flexure |
2 (14.3) |
2 (14.3) |
0.707 |
|
Нисходящая ободочная кишка Descending colon |
1 (7.1) |
3 (21.4) |
|
|
Сигмовидная кишка Sigmoid colon |
9 (64.3) |
8 (57.1) |
|
|
Ректосигмоидное соединение Rectosigmoid junction |
2 (14.3) |
1 (7.1) |
|
|
Стадия AJCC*, n (%) AJCC stage, n (%) |
|||
|
I |
3 (21.4) |
2 (14.3) |
0.466 |
|
II |
5 (35.7) |
2 (14.3) |
|
|
III |
4 (14.3) |
6 (21.4) |
|
|
IV |
2 (14.3) |
4 (28.6) |
|
|
pT-стадия, n (%) pT-stage, n (%) |
|||
|
pTis |
0 (0.0) |
0 (0.0) |
0.343 |
|
pT1 |
1 (7.1) |
2 (14.3) |
|
|
pT2 |
2 (14.3) |
2 (14.3) |
|
|
pT3 |
9 (64.3) |
10 (71.4) |
|
|
pT4a |
1 (7.1) |
1 (7.1) |
|
|
pT4b |
0 (0.0) |
0 (0.0) |
|
|
pN-стадия, n (%) pN-stage, n (%) |
|||
|
pN0 |
8 (57.1) |
4 (28.6) |
0.127 |
|
pN1a |
3 (21.4) |
5 (36.7) |
|
|
pN1b |
2 (14.3) |
0 (0.0) |
|
|
pN1c |
0 (0.0) |
0 (0.0) |
|
|
pN2a |
0 (0.0) |
3 (21.4) |
|
|
pN2b |
1 (7.1) |
2 (14.3) |
|
|
M-стадия, n (%) M-stage, n (%) |
|||
Продолжение Таблицы 1
|
cM0 |
12 (85.7) |
11 (78.6) |
0.513 |
|
M1a |
2 (14.3) |
2 (14.3) |
|
|
M1b |
0 (0.0) |
1 (7.1) |
|
|
M1c |
0 (0.0) |
0 (0.0) |
Также, группы были сопоставимы по объемам хирургического вмешательства — статистически значимых различий в частоте комбинированных вмешательств не встречалось (2 [14,3 %] при классическом трансабдоминальном доступе и 4 [28,6 %] при первично-забрюшинном доступе).
Длительность оперативного вмешательства (250 мин против 305 мин, p=0.277), кровопотеря (p=0.401), количество удаленных регионарных (26,5 против 22,5, p=0.946) и апикальных (3 штуки против 2 штук, p=0.376) лимфоузлов статистически значимо не отличались в двух сравниваемых группах.
Время до отхождения газов (1 день против 1 дня, p=0.874) и появления первого стула (3,5 дня против 3 дней, p=0.804), сроки госпитализации (8 дней против 8 дней, p=0.874), а также частота послеоперационных осложнений (p=0.308) были сопоставимы.
Ни в одной из наблюдаемых групп не встречались случаи с положительными границами резекции. У одного пациента, которому было выполнено вмешательство с использованием первично-забрюшинного доступа был выявлен дефект по задней стенке сигморектального анастомоза, потребовавший дополнительного укрепления одиночным швом и выполнения трансверзостомии. Статистически значимых различий в частоте интраоперационных осложнений не получено (p=0.309).
Ни в одном из представленных случаев с использованием сосудосберегающей методики не наблюдалось повреждение ветвей НБА, который необходимо было сохранить.
Ни в одной из исследуемых групп не наблюдались интраоперационная и ранняя послеоперационная 30-дневная летальность.
Также не выявлено статистически значимых различий в частоте встречаемости послеоперационных осложнений (p=0.308). Осложнения III степени тяжести по шкале Clavien-Dindo встречались у 1 пациента в каждой группе (7,1 %).
У одного пациента с лимфодиссекцией из трансабдоминального доступа в послеоперационном периоде зарегистрирована перфорация тонкой кишки, по поводу которой выполнена лапаротомия с ревизией брюшной полости и ушиванием тонкой кишки, санацией и дренированием брюшной полости, илеостомией.
Сроки лечения и нахождения в стационаре статистически значимо не различались и в среднем составили 8,5 и 8 дней (p=0.874) в обеих группах (табл. 2).
Таблица 2
Непосредственные результаты хирургического лечения пациентов с раком левых отделов ободочной кишки, которые прооперированны из трансабдоминального лапароскопического и первично-забрюшинного доступов
Table 2
Intraoperative and early postoperative outcomes of the patients, who underwent surgical treatment for left colon cancer using conventional transabdominal and primary retroperitoneal approach.
|
Параметр Parameter |
Лапароскопический трансабдоминальный доступ (n=14), Conventional transabdominal approach (n=14) |
Первично-забрюшинный доступ (n=14), Primary retroperitoneal approach (n=14) |
Значение p, p-value |
|
Длительность операции, Me (IQR) Operation time, Me (IQR) |
250 (195–300) |
305 (245–340) |
0.227 |
|
Кровопотеря, Me (IQR) Blood loss, Me (IQR) |
50 (50–100) |
75 (50–100) |
0.401 |
|
Удаленные регионарные лимфатические узлы, Me (IQR) Harvested regional lymph nodes, Me (IQR) |
26.5 (20–32) |
22.5 (21–37) |
0.946 |
|
Удаленные апикальные лимфатические узлы, Me (IQR) Harvested apical lymph nodes, Me (IQR) |
3 (1–5) |
2 (1–5) |
0.376 |
Продолжение Таблицы 2
|
Время до первого отхождения газов, дни, Me (IQR) Time to first flatus, days, Me (IQR) |
1.5 (1–2) |
1 (1–2) |
0.874 |
|
Время до первого отхождения стула, дни, Me (IQR) Time to first defecation, days, Me (IQR) |
3.5 (2–5) |
3 (2–5) |
0.804 |
|
Время нахождения в стационаре, дни, Me (IQR) Hospital stay, days, Me (IQR) |
8.5 (7–10) |
8 (7–8) |
0.874 |
Таблица 3
Непосредственные результаты хирургического лечения рака ободочной кишки из трансабдоминального и первичнозабрюшинного доступов
Table 3
Short-term outcomes of the patients, who underwent surgical treatment for left colon cancer using conventional transabdominal and primary retroperitoneal approach
|
Параметр Parameter |
Лапароскопический трансабдоминальный доступ (n=14) Conventional transabdominal approach (n=14) |
Первично-забрюшинный доступ (n=14) Primary retroperitoneal approach (n=14) |
Значение p p-value |
|
Конверсия, n (%) Conversion n (%) |
0 (0.0) |
0 (0.0) |
na* |
|
Положительные края резекции Positive resection margin |
0 (0.0) |
0 (0.0) |
na |
|
Комбинированное хирургическое вмешательство Combined surgery |
2 (14.3) |
4 (28.6) |
0.326 |
|
Интраоперационные осложнения Intraoperative complications |
0 (0.0) |
1 (7.1) |
0.309 |
|
Повреждение ветвей нижней брыжеечной артерии в ходе скелетизации IMA branches injury with conversion to high ligation |
0 (0.0) |
0 (0.0) |
na |
|
Послеоперационные осложнения: Postoperative complications: |
|||
|
Осложнения не зарегистрированы No complications registered |
9 (64,4) |
11 (78.6) |
0.308 |
|
Клавьен-Диндо 1 Clavien-Dindo 1 |
1 (7.1) |
1 (7.1) |
|
|
Клавьен-Диндо 2 Clavien-Dindo 2 |
3 (21.4) |
0 (0.0) |
|
|
Клавьен-Диндо 3 Clavien-Dindo 3 |
1 (7.1) |
1 (7.1) |
|
|
Послеоперационные осложнения, потребовавшие хирургического/эндоскопического лечения (Клавьен Диндо 3-4) Postoperative complications, which demanded endoscopic/surgical treatment (CD 3-4) |
|||
|
Перфорация тонкой кишки Perforation of the bowel |
1 (7.1) |
0 (0.0) |
|
|
Желудочно-кишечное кровотечение Gastrointestinal bleeding |
0 (0.0) |
1 (7.1) |
|
|
Нарушение эякуляции и сексуальная дисфункция, развившиеся в послеоперационном периоде Sexual and ejaculatory disorders, associated with LND |
0 (0.0) |
0 (0.0) |
na |
Примечание. Me (median) — медиана; IQR (interquartile range) — межквартильный размах; AJCC (American Joint Committee on Cancer) — Американский Объединенный Комитет по раку, ASA (American Society of Anesthesiologists) — Американское общество анестезиологов, n/a (not available) — не применимо
Расширенная Д3-лимфодиссекция с сохранением кровотока по НБА не привела к сексуальной дисфункции пациента ни в одной из исследованных групп (табл. 3).
Обсуждение
Малоинвазивный доступ к колоректальному раку является золотым стандартом в хирургическом лечении I–III стадии. Помимо классического трансабдоминального доступа, заслуживает внимания первично-забрюшинный доступ, который может стать доступной и безопасной альтернативой у пациентов с высоким ИМТ и спаечным процессом [4, 5].
Этот доступ был впервые предложен в 1995 году для мобилизации ободочной кишки в работе Darzi и соавторов, где были описаны некоторые технические аспекты этой процедуры [7].
Только в 2023–2024 годах снова появились упоминания об этом доступе для Д3-лимфодиссекции с высокой перевязкой НБА [8, 9] и для сосудосберегающей Д3-лимфодиссекции при раке левых отделов ободочной и прямой кишки [4, 5].
Для выделения нижней брыжеечной артерии с сохранением как ЛОА, так и ВПА эта технология впервые применяется и описывается в России [4, 5].
Первично-забрюшинный доступ может быть предпочтителен в ряде клинических случаев при оперативных вмешательствах по поводу рака левых отделов ободочной кишки. Этот доступ может быть использован у пациентов с висцеральным ожирением. По данным мета-анализа, лапароскопическая хирургия у пациентов с ожирением ассоциирована с большей частотой положительных границ резекции, меньшим количеством удаленных лимфоузлов, а также большей длительностью оперативного вмешательства, кровопотери, и длительностью пребывания в стационаре [10].
Наиболее вероятно, такие результаты связаны с техническими сложностями выполнения оперативного вмешательства у пациентов с ожирением.
Первично-забрюшинный доступ позволяет избежать выполнения Д3-лимфодиссекции из классического трансабдоминального доступа, которая резко ограничена и технически затруднительна при наличии у пациента висцерального ожирения. Он может способствовать улучшению результатов хирургического лечения колоректального рака у данной когорты пациентов и расширить возможности использования малоинвазивного доступа.
Стандартный пневмоперитонеум (11–12 мм рт. ст.), необходимый при выполнении лапароскопических операций трансабдоминальным доступом, также может отрицательно сказаться на послеоперационном восстановлении пациентов с выраженной сопутствующей патологией [11, 12]. Первичнозабрюшинный доступ, требующий меньшего объема подачи углекислого газа, может стать альтернативным методом для пациентов с высокими рисками сердечно-сосудистых и дыхательных осложнений.
Лапароскопический трансабдоминальный доступ также затруднен у пациентов с риском спаечного процесса в брюшной полости [13].
По данным мета-анализа, спаечный процесс удлиняет последующие оперативные вмешательства в среднем на 15 минут, и в 6 % случаев повторные вмешательства с адгезиолизисом при спаечном процессе сопровождались ятрогенным повреждением тонкой кишки [14].
Первично-забрюшинный доступ может быть рассмотрен как альтернативный вариант стандартному трансабдоминальному лапароскопическому доступу у пациентов с высоким риском спаечного процесса. Более того, первично-забрюшинный доступ может снизить риски развития спаечного процесса в брюшной полости и ассоциированных с ним осложнений в послеоперационном периоде.
Однако, операции из первично-забрюшинного доступа требуют более глубокого понимания анатомических ориентиров и слоев, так как их визуализация в забрюшинном пространстве резко ограничена.
Ранее уже был представлен подробный анализ плоскостных моделей навигации и основных анатомических ориентиров для стандартизации хирургии правых отделов ободочной кишки. Для стандартизированного подхода к правым отделам ободочной кишки были представлены 3 плоскости, каждая из которых включала в себя анатомические ориентиры. При следовании этим принципам статистически значимых различий в непосредственных результатах хирургического лечения для различных видов и направлений доступа получено не было [15].
По аналогии с опубликованным исследованием на правых отделах ободочной кишки, в этой работе мы представили аналогичную плоскостную модель для левых отделов ободочной кишки, которую можно применить как при забрюшинном, так и при трансабдоминальном доступах. Использование плоскостных моделей сводит разницу в непосредственных результатах лечения при различных доступах к минимуму. Безопасное и эффективное применение впервые представленного первично-забрюшинного доступа с сосудосберегающей Д3-лимфодиссекцией возможно с использованием плоскостной модели навигации.
В ходе сравнения пациентов, сопоставимых по ряду показателей, играющих ключевую роль в выборе доступа, было выяснено, что лимфодиссекция из забрюшинного доступа не ассоциирована с худшими непосредственными результатами лечения. Такие результаты свидетельствуют о возможности применения первично-забрюшинного доступа у пациентов, скомпрометированных по сопутствующей патологии, с ранее выполненными оперативными вмешательствами и высоким индексом массы тела.
Ограничения исследования
Ограничениями настоящего исследования является малая выборка пациентов. Для получения более репрезентативных результатов планируется включение большего числа пациентов для увеличения объема исследуемой выборки, а также проведение проспективного исследования для определения преимуществ и недостатков первично-забрюшинного доступа в хирургии рака левых отделов ободочной кишки с сосудосберегающей Д3-лимфодиссекцией.
В свою очередь, данное исследование представляет собой первый сравнительный анализ первично-забрюшинного и транс абдоминального лапароскопического доступов.
Заключение
Непосредственные результаты хирургического лечения с использованием первично-забрюшинного доступа не отличаются от таковых при классическом трансабдоминальном лапароскопическом доступе.
Первично-забрюшинный доступ может иметь преимущества в специфической выборке пациентов, для которых классический трансабдоминальный доступ ассоциирован с рядом технических трудностей, а также интраоперационных и послеоперационных осложнений.
Список литературы Сравнительный анализ первично-забрюшинного и трансабдоминального доступов в лапароскопической хирургии рака левых отделов ободочной кишки: исследование типа "случай-контроль"
- Morgan E., Arnold M., Gini A., Lorenzoni V., Cabasag C.J., Laversanne M., Vignat J., Ferlay J., Murphy N., Bray F. Global burden of colorectal cancer in 2020 and 2040: incidence and mortality estimates from GLOBOCAN. Gut, 2023, Feb; № 72(2), рр. 338-344. https://doi.org/10.1136/bmj.f5588
- Deijen C.L., Vasmel J.E., de Lange-de Klerk E.S.M., Cuesta M.A., Coene P.L.O., Lange J.F., Meijerink W.J.H.J., Jakimowicz J.J., Jeekel J., Kazemier G., Janssen I.M.C., Påhlman L., Haglind E., Bonjer H.J. COLOR (Colon cancer Laparoscopic or Open Resection) study group. Ten-year outcomes of a randomised trial of laparoscopic versus open surgery for colon cancer. Surgical Endoscopy, 2017, № 31(6), рр. 2607. https://doi.org/10.1007/s00464-016-5270-6
- Veldkamp R., Kuhry E., Hop W.C., Jeekel J., Kazemier G., Bonjer H.J., Haglind E., Phlman L., Cuesta M.A., Msika S., Morino M., Lacy A.M. Colon cancer Laparoscopic or Open Resection Study Group (COLOR). Laparoscopic surgery versus open surgery for colon cancer: short-term out-comes of a randomised trial. The Lancet Oncology, 2005, № 6(7), рр. 477-484. https://doi.org/10.1016/S1470-2045(05)70221-7
- Efetov S.K., Zubayraeva A.A., Panova P.D. The retroperitoneal approach to vessel-sparing D3 lymph node dissection in left-sided colorectal cancer resections: a video vignette. Colorectal Disease, 2023, № 25(9), рр. 1940-1941. https://doi.org/10.1111/codi.16705
- Ефетов С.К., Зубайраева А.А., Семченко Б.С., Панова П.Д., Волгин М.В., Рычкова А.К. Первично-забрюшинный доступ для сосудосберегающей лимфодиссекции в лечении рака левой половины ободочной и прямой кишки - первый российский опыт. Хирургия. Журнал им. Н.И. Пирогова, 2023, № 12, рр. 26-33. https://doi.org/10.17116/hirurgia202312126
- Efetov S., Zubayraeva A., Kayaalp C., Minenkova A., Bağ Y., Alekberzade A., Tsarkov P. Selective approach to arterial ligation in radical sigmoid colon cancer surgery with D3 lymph node dissection: A multicenter comparative study. Turk J Surg., 2022, Dec, № 20; 38(4), рр. 382-390. https://doi.org/10.47717/turkjsurg.2022.5867
- Darzi A, Hunt N, Stacey R. Retroperitoneoscopy and retroperitoneal colonic mobilization: A new approach in laparoscopic colonic surgery. British Journal of Surgery, 1995, № 82(8), рр. 1038-1039. https://doi.org/10.1002/bjs.1800820812
- Hany T.S., Jadav A.M., Parkin E., Bhowmick A.K. Extraperitoneal approach to left-sided colorectal resections (EXPERTS procedure). Br J Surg., 2023, Sep 6; № 110(10), рр. 1348-1354. https://doi.org/10.1093/bjs/znad173
- Hany T.S., Jadav A.M., Lamoon C., Cassidy K., Bhowmick A.K. The Extraperitoneal Approach to Left-Sided Colorectal Rectal Resections: EXPERTS Procedure. Ann Surg Oncol, 2023, Mar; № 30(3), рр. 1739-1740. https://doi.org/10.1245/s10434-022-12848-8
- Bell S., Kong J.C., Carne P.W.G., Chin M., Simpson P., Farmer C., Warrier S.K. Oncological safety of laparoscopic versus open colorectal cancer surgery in obesity: a systematic review and meta-analysis. ANZ J Surg., 2019, Dec; № 89(12), рр. 1549-1555. https://doi.org/10.1111/ans.15081
- Casati A., Comotti L., Tommasino C., Leggieri C., Bignami E., Tarantino F., Torri G. Effects of pneumoperitoneum and reverse Trendelenburg position on cardiopulmonary function in morbidly obese patients receiving laparoscopic gastric banding. European Journal of Anaesthesiology, 2000, № 17(5), рр. 300-305. https://doi.org/10.1046/j.1365-2346.2000.00662.x7
- Katayama S., Mori K., Pradere B., Yanagisawa T., Mostafaei H., Quhal F., Motlagh R.S., Laukhtina E., Grossmann N.C., Rajwa P., Aydh A., König F., Karakiewicz P.I., Araki M., Nasu Y., Shariat S.F. Influence of steep Trendelenburg position on postoperative complications: a systematic review and meta-analysis. Journal of Robotic Surgery, 2022, № 16(6), рр. 1233-1247. https://doi.org/10.1007/s11701-021-01361-x
- Kim I.Y., Kim B.R., Kim Y.W.. Impact of Prior Abdominal Surgery on Rates of Conversion to Open Surgery and Short-Term Outcomes after Laparoscopic Surgery for Colorectal Cancer. PLoS One, 2015, Jul 24; № 10(7), рр. e0134058. https://doi.org/10.1371/journal.pone.0134058
- ten Broek R.P., Issa Y., van Santbrink E.J., Bouvy N.D., Kruitwagen R.F., Jeekel J., Bakkum E.A., Rovers M.M., van Goor H. Burden of adhesions in abdominal and pelvic surgery: systematic review and met-analysis. BMJ, 2013, Oct 3; № 347, рр. f5588. https://doi.org/10.1136/bmj.f5588
- Efetov S.K., Picciariello A., Tulina I.A., Sidorova L.V., Kochneva K.A., Bergamaschi R., Tsarkov P.V. Three-plane Model to Standardize Laparoscopic Right Hemicolectomy with Extended D3 Lymph Node Dissection. Surg Technol Int., 2020, May, № 28;36, рр. 136-142. PMID: 31821523


