Сравнительный анализ показателей криоконсервированной и свежеполученной спермы баранов-производителей романовской породы
Автор: Лариса Александровна Гнездилова, Сеидфатима Мировна Борунова, Анаида Арутюновна Кочконян
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 10, 2021 года.
Бесплатный доступ
Был проведен системный анализ нативной и криоконсервированной спермы, полученной от баранов-производителей романовской породы. Опыт проводился на базе ФГБУ «ВГНКИ» в 2020–2021 гг. Всего было проанализировано 20 спермопроб от 10 баранов-производителей. В статье изучены такие параметры идентификации морфофункциональных отклонений спермиев баранов-производителей, как подвижность (нормокинезис, гипокинезис), аномальная акросома, патологические и аномальные формы сперматозоидов, индекс фрагментации ДНК. Взятие генетического материала проводилось согласно требованиям нормативных документов. В сравнительном анализе по показателю подвижности сперматозоидов установили отклонение от нормы только в криоконсервированной сперме, ППД = 13,2 %. При оценке морфологии в криоконсервированной сперме в 7 спермопробах было выявлено более 20 % аномальных сперматозоидов. Установлено что, в криоконсервированной сперме 9 спермопроб с фрагментированной ядерной и митохондриальной ДНК сперматозоидов. Выявлено уменьшение количества спермиев (олигоспермия), снижение их общей и поступательной подвижности (астеноспермия), появление большого количества спермиев с различными аномальными формами (тератозооспермия). Достаточно часто наблюдалось единовременное наличие сочетанных нарушений (олигоастеноспермия, олигоастенотератозооспермия). Обзорные данные по методологии ветеринарно-санитарного контроля спермы баранов не дают нам расширенной интерпретации исследуемых данных. Метод окрашивания по Романовскому с красителем эозин, азур-эозин, указанный в нормативном документе, затрудняет проводить исследования на выявление поврежденной акросомы и патологических форм спермиев. Предложенный метод окраски с помощью тест набора «Диффквик» позволяет ускорить время на окрашивании и более быстро получать результаты. Методика окрашивания акридин-оранжевым позволит выявить фрагментированную ядерную и митохондриальную ДНК.
ДНК, акросома, сперматозоид, баран-производитель, подвижность.
Короткий адрес: https://sciup.org/140257846
IDR: 140257846 | УДК: 636.32:636.082.451 | DOI: 10.36718/1819-4036-2021-10-135-143
Текст научной статьи Сравнительный анализ показателей криоконсервированной и свежеполученной спермы баранов-производителей романовской породы
Введение. Важным направлением научнопрактических и научно-исследовательских работ для овцеводства в Российской Федерации является создание современных, продуктивных типов овец, которые соответствуют лучшим породам мирового уровня [1].
Согласно определению В.В. Абонеева, искусственное осеменение – целенаправленное усовершенствование породных и продуктивных качеств в овцеводстве за счет активного использования наиболее ценных баранов-производителей [2]. Результативность искусственного осеменения, а это и высокая оплодотворяемость и плодовитость маток, эффективна лишь тогда, когда правильно проведена работа по подготовке к случке маток баранов-производителей, а самое главное – когда проведены скрининговые мероприятия по проверке генетического материала по всем актуализированным методикам [1].
Оплодотворяющая способность баранов-производителей зависит от комплекса различных бифакторов [3]. Необходимо, чтобы биологическое качество эякулята соответствовало определенным критериям [4]. В результате этого обязательное проведение комплексной оценки спермопродукции необходимо для последующего использования высопродуктивных сельскохозяйственных животных в воспроизводстве [5]. Совместно с классическими методами оценки качества спермы возникает необходимость комплексного подхода к оценке спермопродукции производителей, использования современных методов, а именно определения индекса фрагментации ДНК сперматозоидов и подсчета половых клеток с интактной ак-росомой [6, 7].
Причиной идиопатического бесплодия является содержание большого количества сперми-ев с аномальной акросомой в полученном эякуляте, в случае если в спермограмме диагносци-руется положительные параметры. P. Gottardo объясняет это тем, что в акросоме уменьшается проницаемость плазматической мембраны для ионов кальция, что отражается на их способности прикрепляться к мембране ооцита [8]. В поврежденной дегенеративной акросоме часто наблюдаются выраженные разрушения плазматической мембраны, впоследствии они приводят к низкой оплодотворящей способности сперми-ев баранов-производителей [9]. Отсутствие или повреждение апикального тельца у спермокле-ток проявляется нарушением различных процессов в сперматогенезе.
Митохондриальная дисфункция приводит к нарушению синтеза АТФ и гиперпродукции АФК в сперме, в настоящее время данная патология пополняет группу патологических отклонений у спермиев, которые выражаются чаще всего генетическими, структурными биохимическими дефектами в митохондриях [10, 11].
По данным, представленным С.М. Боруновой (2018 г.), флагманом передовых методов контроля морфофункциональных качеств спермиев является изучение их подвижности и индекса фрагментации ДНК как в головной части, так и в срединной.
Цель исследования. Проведение сравнительной оценки криоконсервированной и свеже-полученной спермы баранов-производителей по морфофункциональным показателям качества семени (подвижность, патологические и ано- мальные формы спермиев, аномальная акро-сома, индекс фрагментации ДНК).
Задачи исследования: провести сравнительную оценку морфологических показателей свежеполученной и криоконсервированной спермы баранов-производителей романовской породы по идентификации аномальных сперматозоидов; установить индекс фрагментации ДНК и митохондриальной дисфункции сперматозоидов в свежеполученной и криоконсервирован-ной сперме баранов-производителей романовской породы.
Материалы и методы. Научные работы исполняли в осенний период 2020 г. на базе кафедры диагностики болезней, терапии, акушерства и репродукции животных МГАВМиБ им. К.И. Скрябина и в лаборатории отдела по контролю качества и стандартизации генетического материала и препаратов, применяемых при воспроизводстве животных ФГБУ «ВГНКИ», по ГОСТ 32277-2013 «Средства воспроизводства. Сперма. Методы испытаний физических свойств и биологического, биохимического, морфологического анализов». Материалом для исследований послужили пробы свежеполученной и крио-консервированной спермы, полученной от баранов-производителей романовской породы. Всего было исследовано 20 спермопроб от 10 баранов-производителей в трехкратной повторности на определение морфофункциональных показателей спермопродукции. Для изучения качественных характеристик спермы (подвижность, скорость движения, аномальные формы, интактная акросома, индекс фрагментации ДНК) использовали сперму баранов-производителей, замороженную в полипропиленовых соломинках.
Подвижность спермиев изучали визуально в световом микроскопе, увеличение х 180 раз, все образцы при микроскопии помещали на термостолик, который был подогрет до t +38 °С. Этот же образец подвергали исследованию на спер-моанализаторе Andro Vision Minitube, позволяющем фиксировать концентрацию, подвижность и скорость движения половых клеток. С помощью микроскопа рассчитывали количественное соотношение прямолинейно-поступательного движения к общему числу спермокле-ток. В исследуемых образцах мы подробно изучили параметры скорости движения спермато- зоидов благодаря расширенной спермаграмме и диаграмме:
-
1. VCL – криволинейная скорость (мик-рон/секунд). Скорость движения спермиев по фактическому пути.
-
2. VSL – прямолинейная скорость (мик-рон/секунд). Скорость перемещения спермиев в прямолинейном направлении.
-
3. VAP – средняя скорость по траектории (микрон/секунд). Скорость в расчете на среднюю длину пути.
-
4. LIN – линейность . Индекс линейности движения реального пути.
-
5. STR – прямолинейность . Индекс прямолинейности движения средней траектории пути.
-
6. BCF – частота колебаний (бие-ний/секунд). Средняя частота, с которой реальная траектория спермоклетки пересекает усредненную траекторию.
-
7. ALH – амплитуда бокового смещения головки . Отклонение головки относительно средней траектории.
-
8. WOB – колебание . Величина, описывающая колебание реальной траектории относительно усредненной, VAP/VCL.
В зависимости от направления движения все половые клетки, по рекомендациям ВОЗ, делят на 3 категории.
-
1. Прогрессивно-подвижные сперматозоиды (PR) (когда клетки осуществляют движение по прямой).
-
2. Непрогрессивно-подвижные сперматозоиды (NP) (когда клетки двигаются по кругу и имеют малый радиус перемещения).
-
3. Неподвижные сперматозоиды (IM).
Интактную акросому и аномальные формы спермиев выявляли с помощью тест-набора «Дифф-Квик». Экспресс-метод основан на минимально затраченном времени. Приготовленные мазки из разбавленной спермы фиксировали буферным раствором. После остатки раствора сливали на фильтровальную бумагу и переходили к красителю № 1 (розовый), используя дозатор на 1–2 мл и равномерно покрывая каждое предметное стекло биожидкостью. Для прокраски требуется 10 мин, далее остатки красителя сливаем на фильтровальную бумагу. На прокрашенную основу наносим краситель № 2 (синий), полностью покрывая розовую зону, даем прокраситься 10 мин и смываем, окуная в емкость с дистиллированной водой два-три раза. Спермии считали морфологически нормальными, если все структурные элементы его сохранены и соответствовали известным нормам. Расчет производили высчитывая от процента общего числа нормальных спермиев число поврежденных по различным критериям и категориям повреждений, таких как аномальные головки, склоненная головка, скрученные и сломанные хвосты, оторвавшиеся головки.
Состояние дизоксирибонуклеиновой кислоты в ядре и митохондриях изучали методом акри-дин-оранжевого теста. Микроскопирование проводили с использованием флуоресцентного микроскопа. Этот метод считают одним из современных в системе биологической экспертизы племенной продукции, так как он является одним из технологически усовершенствованных маркеров апотоза (играет особую роль в регуляции фертильности), что необходимо учитывать при искусственном и естественном осеменении сельскохозяйственных животных. В каждом препарате насчитывают от 100 до 200 сперматозоидов, сначала подсчитывали сперматозоиды с неповрежденной, далее с фрагментированной ДНК. Сперматозоиды с фрагментированной ДНК окрашиваются в оттенки красного цвета, а целые в зеленый. Подсчет ведется по формуле, указанной в МУ «Определение индекса фрагментации ДНК в замороженной сперме у животных-производителей».
Результаты исследования и их обсуждение. При оценке качества семени мы провели исследования полученного эякулята во всех образцах. Сперма, сохраняемая более 25–30 мин после взятия, по физическим показателям соответствовала требованиям и нормам ГОСТ 322002013. Сперма баранов-производителей однородная, молочно-белая с желтым оттенком, вязкая, без примеси крови, гноя и мочи.
Оценку спермы по густоте проводили на микроскопе при увеличении в 180 раз. Степень насыщения спермы спермиями – густая (Г).
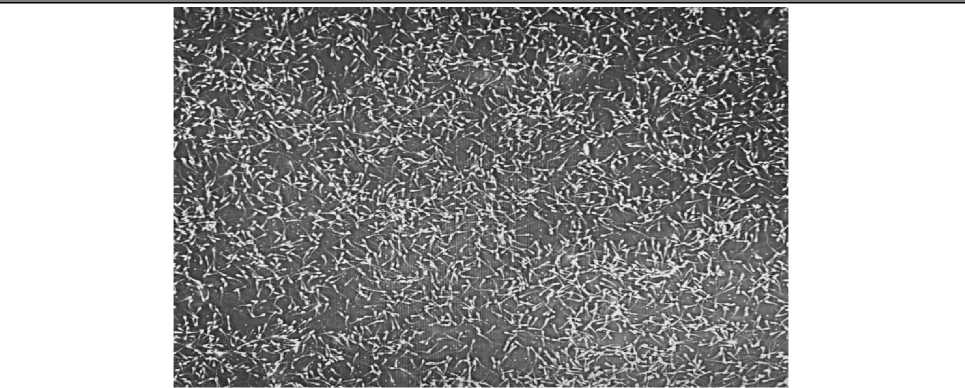
Рис.1. Оценка спермы по густоте. Область с незначительными промежутками (Ув. х 180)
При определении подвижности сперматозоидов в результате проведенных нами исследований все полученные показатели были включены в следующие категории:
^ PR (прогрессивно-подвижные (нормоки-незис) – быстрая прямолинейно-поступательная подвижность, медленная прямолинейнопоступательная подвижность);
^ NP (непрогрессивно-подвижные (гипоки-незис) – круговая подвижность, локальная подвижность);
^ IM (неподвижные (акинезис) - мертвые).
Таблица 1
Показатели подвижности свежеполученной и криоконсервированной спермы, %
|
Общее кол-во проанализ, спермы |
1 802,00 |
|
|
Количество полей |
2.00 |
|
|
Концентрация |
[107мл] |
352,31 |
|
Общая подвижность |
(%) |
98,06 |
|
Поступательная подвижность |
с%> |
92,73 |
|
■ Быстрая поступ. подв-ть |
W |
63,65 |
|
Медл. поступ. подв-ть |
W |
27,86 |
|
■ Круговая подвижность |
(%) |
1,22 |
|
Локальная подвижность |
(%) |
5,33 |
|
■ неподвижный |
(%) |
1,94 |
|
Общ. кол-во сперм/доза |
[13Т |
528,46 |
|
Критерий |
Свежеполученная сперма |
Криоконсервированная сперма |
|
PR |
92,4 – соотв. норме |
13,2 – не соотв. норме |
|
PR+NP |
97,1 – соотв норме |
58,89 – соотв. норме |
|
VCL (pm,'сек) |
VSL (ртАсек) |
VAP (рт/сек) |
DCL [рт] |
DSL ftim] |
DAP (pm] |
ALH [pm] |
BCF (Hz) |
НАС (рад) |
WOB (VAP/VCL) |
LIN (VSL/VCL |
STR (VSL/VAP) |
|
|
Сред.зн.переж, |
172,71 |
68,99 |
89,24 |
37,02 |
13,12 |
18,08 |
1,76 |
12,03 |
0,43 |
0,52 |
0,40 |
0,77 |
Рис. 2. Анализ свежеполученного эякулята
|
VCL (рт/сек) |
VSL (рт/сек) |
VAP (р т/сек) |
DCL [Щп] |
DSL [Мт] |
DAP &ип] |
ALH [рт] |
BCF (Hz) |
НАС (рад) |
WOB LIN (VAP/VCL) (VSUVCL |
STR (VSUVAP) |
|
|
Сред.зн.переж, |
55,30 |
36,75 |
39.93 |
7,39 |
2,76 |
3,56 |
0,40 |
0,90 |
0,17 |
0,72 0,66 |
0,92 |
Рис. 3. Анализ криоконсервированной спермы

|
Общее кол-во проанализ. спермы |
6 528.00 |
|
|
Количество полей |
3,00 |
|
|
Концентрация |
[107мл] |
425,43 |
|
Общая подвижность |
W |
54,78 |
|
Поступательная подвижность |
W |
15,46 |
|
■ Быстрая лоступ. подв-ть |
W |
10,22 |
|
Медл. лоступ. подв-ть |
(%) |
5,13 |
|
■ Круговая подвижность |
(%) |
0,11 |
|
Локальная подвижность |
(%) |
39,32 |
|
■ неподвижный |
(%) |
45,22 |
|
Общ. кол-во слерм/доза |
[«п |
425,43 |
По показателям подвижности были проведены исследования 20 спермопроб от 10 баранов-производителей. Показатель ППД в криоконсер-вированной сперме варьировал от 10,27 до 15,46 %, что не соответствует нормам ГОСТ 32200-2013 (не менее 40 %), показатель ло- кальной подвижности варьировал от 39,32 до 55,00 %. Показатель ППД в свежеполученной сперме варьировал от 88,12 до 96,23 %, что соответствует нормам ГОСТ 32200-2013 (не менее 80 %), показатель локальной подвижности варьировал от 1,89 до 6,9 %.
Таблица 2
Морфологические показатели свежеполученной и криоконсервированной спермы, %
|
Показатель |
Свежеполученная сперма |
Криоконсервированная сперма |
|
Поврежденная акросома |
5,9 (норма не более 10 %) |
11,21 (норма не более 40 %) – соотв. норме |
|
Аномальные формы |
6,5 (норма не более 18 %) |
16,36 (норма не более 20 %) – соотв норме |
Были выявлены 5 спермопроб в свежеполу-ченном эякуляте с поврежденной акросомой более 10 %, которые не соответствовали нормам ГОСТ 32200-2013, – от 3 до 10 %. Средние показатели всех спермпороб: оторвавшиеся головки – 3,4 %; аномальные головки – 4,25; согнутые хвосты – 4,66; закрученные – 4,1 %. Были выявлены 7 спермопроб в замороженном эякуляте с аномальной морфологией более 20 %, которые не соответствовали нормам ГОСТ 32200-2013, – не более 20 %. Показатель интакной акросомы соответствовал нормам и составлял от 3,3 до 25 %, при норме не более 40 %.
Таким образом, морфологические нарушения спермиев выражают изменения в двигательной активности спермоклеток, снижают фертильную способность и их функциональную полноценность в процессе оплодотворения.
Состояние ДНК в сперматозоидах изучали методом SCSA. Измеряли процент сперматозоидов с высокой чувствительностью к pH-индуци-рованной денатурации, который обозначается как индекс фрагментации ДНК – DFI (этот параметр отражает уровень разрывов в ДНК).
Показатель индекса фрагментации ДНК (DFI) свежеполученной и криоконсервированной спермы, %
Таблица 3
|
Показатель |
Свежеполученная сперма |
Криоконсервированная сперма |
|
DFI |
7 |
29 |
Средний показатель количества сперматозоидов с фрагментацией ДНК составил в свеже-полученном эякуляте DFI < 7 %, в замороженооттаянном DFI 29 %. Оба показателя находятся в пределах нормы (не более 30 % с фрагменти- рованной ДНК). В нескольких свежеполученных и криоконсервированных спермопробах нами была выявлена фрагментация ядерной и митохондриальной ДНК более 30 % – DFIi 30 %.
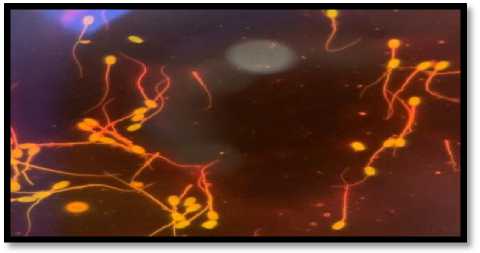
Рис. 4. Большое количество спермиев, окрашенных в оранжевый цвет, свечение в хвостовой части, т.е. митохондриальная дисфункция. Ув. × 40
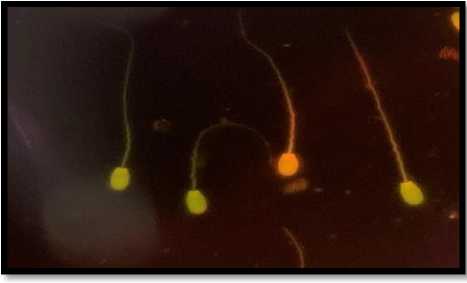
Рис. 5. Фрагментированная ядерная ДНК и митохондриальная ДНК сперматозоида. Ув. × 100
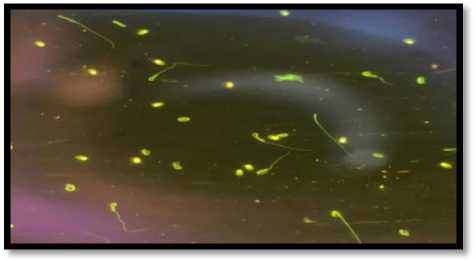
Рис. 6. Большое количество сперматозоидов с аномальной морфологией, несколько головок с незрелым ядром, имеющим аномальную структуру хроматина (HDS).
Заключение. Интерпретируя полученные результаты, можно сделать выводы по сравнительной оценке свежеполученной и криоконсер-вированной спермы. Установлено, что по показателю подвижности сперматозоидов имело место отклонение от нормы только в криокон-сервированной сперме, ППД = 13,204±0,1 %. При оценке морфологических показателей наибольшее количество поврежденных сперматозоидов было обнаружено в 7 криоконсервиро-ванных спермопробах с общей аномалий спер-миев, их среднее значение составляло 25,3 %, что не соответствует нормам ГОСТа. Также было выявлено в криоконсервированной сперме: оторвавшиеся головки – 15,85 %; дефектные головки – 10,2; согнутые хвосты – 6,97; закрученные – 5,55 %. Интактная акросома в крио-консервирванной сперме во всех спермопробах в пределах нормативных данных – ГОСТ не менее 90 %, но в свежеполученном эякуляте было выявлено в 5 спермопробах более 10 % сперматозоидов с поврежденной акросомой более 40 % – ГОСТ не менее 60 %. По показателю индекса фрагментации ДНК выявлено в свежепо-лученной сперме – 3 спермопробы и в криокон-сервированной – 9 спермопроб с фрагментированной ядерной и митохондриальной ДНК сперматозоидов – более 30 % – DFIi 30 % [6]. Определение морфофункциональных параметров спермы баранов-производителей позволяет наиболее полно и расширенно интерпретировать полученные данные спермограммы сельскохозяйственных производителей, установить связь морфофункциональных характеристик и репродуктивных параметров, а также установить критерии, влияющие на оплодотворяющую способность спермы в целом.
Новые методики исследования морфологических показателей позволяют более детально и точно определить биологическую полноценность спермопродукции. Полученные результаты исследований в дальнейшем могут быть стандартизированы, а показатель – индекс фрагментации ДНК включен в ГОСТ 32200-2013 (Средства воспроизводства. Сперма баранов. Технические условия).
Список литературы Сравнительный анализ показателей криоконсервированной и свежеполученной спермы баранов-производителей романовской породы
- Постановление главы администрации Крас-нодарского края о мерах по выводу отрасли овцеводства из кризисного состояния и на-ращиванию поголовью на период 2000–2005 годов. Краснодар, 2002. № 351.
- Абонеев В.В., Гнездилова Л.А., Ранюк В.Т. и др. Воспроизводительная способность ов-цематок и сохранность молодняка различно-го происхождения. 2019; (1): С. 120–125.
- Кидун К.А., Угольник Т.С. Митохондриаль-ная дисфункция сперматозоидов в патоге-незе патоспермий при окислительном стрес-се (обзор литературы) // Проблемы здоро-вья и экологии. 2013. № 2 (36). С. 20–24.
- Иолчиев Б.С., Багиров В.А., Кленовиц-кий П.М. Индекс фрагментации ДНК хрома-тина в сперматозоидах при оценке качества семени у быков-производителей // Сельско-хозяйственная биология. 2012. Т. 47. № 4. С. 31–35.
- Засемчук И.В., Кириченко И.С. Воспроизво-дительные качества баранов породы со-ветский меринос // Вестник Донского госу-дарственного аграрного университета. 2019. № 33. Ч. 1. С. 5–6.
- Evenson D.P. The sperm chromatin structure assay (SCSA) and other sperm DNA fragmen-tation tests for evaluation of sperm nuclear DNA integrity as related to fertility. Anim. Reprod. Sci. 2016; 169: P. 56–75.
- Ushakova I.V., Volodyaeva T.O., Volodin M.A., Pyataeva S.V., Vysokikh M.U., Abubaki-rov A.N.. Prospect for using the evaluation test mitochondrial membrane potential spermatozo-ids in art programs. Materials of the ХХVI inter-national conference Russian association Hu-man reproduction. 2016; 136.
- A strategy to exploit surrogate sire technology in livestock breeding programs / P. Gottardo, G. Gorjanc, M. Battagin et al. // G3: Genes, ge-nomes, genetics. 2019. Vol. 9. No. 1. P. 203–215. DOI: 10.1534/g3.118.200890.
- Mohammadzadeh S., Hoseini S.A., Kadivar A. Сравнительное изучение семени баранов романовской породы и породы Lori Bakhtiari // Сельскохозяйственная биология. 2018. № 2. С. 318–325.
- Борунова С.М., Иолчиев Б.С., Абрамов П.Н. Эффективный метод определения целост-ности акросомы сперматозоида у быков-производителей // Ветеринария, зоотехния и биотехнология. 2017. № 4. С. 29–34.
- Храпко К. Митохондрии, митохондриальная ДНК и соматические митохондриальные мутации: имеют ли они отношение к старе-нию. 2007. С. 54–60.


