Сравнительный анализ результатов формирования панкреатодигестивных анастомозов
Автор: Шабунин А.В., Тавобилов М.М., Карпов А.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Клинические исследования
Статья в выпуске: 1 (47), 2016 года.
Бесплатный доступ
Цель работы. Провести сравнительный анализ результатов ПДР у больных, которым на реконструктивном этапе в нашей хирургической клинике был сформирован либо ПЕА либо ПГА при неудовлетворительных условиях со стороны культи поджелудочной железы. Материалы и методы. В исследовании использовался анализ лечения 659 пациентов в возрасте от 27 до 80 лет (59,4±11,3) с новообразованиями периампулярной зоны, находившихся в клинике за период с августа 2007 года по декабрь 2013 года. Радикальное оперативное вмешательство выполнено 153 (23,2%) больным. Учитывая наибольшую сложность формирования ПДА при неудовлетворительных условиях - только данная категория больных и стала объектом нашего исследования. Тем самым, эти больные и составили две группы - ПЕА был сформирован в 51, ПГА - в 53 случаях. Результаты. Анализ результатов формирования ПДА показал достаточно большой процент специфических осложнений независимо от способа его формирования (ПЕА либо ПГА). Так явления гастростаза в послеоперационном периоде примерно одинаково встречались в обеих группах больных (15,7% и 16,9% соответственно). Количество геморрагических осложнений чаще встречались после формирования ПГА (7,8% и 11,3% соответственно). Послеоперационные панкреатические свищи значительно чаще возникали у пациентов после ПЕА (27,5% против 16,9%), так как ПГА показал себя более надежным у пациентов с неудовлетворительными условиями для формирования панкреатодигестивного анастомоза. Полученные результаты говорят о том, что использование ПГА обосновано для применения у больных с неудовлетворительными условиями для формирования ПДА; в свою очередь ПЕА, по нашему мнению, следует применять при наличии удовлетворительных условий для формирования соустья. заключение. Применение ПГА может служить способом выбора при формировании панкреатодигестивного анастомоза у больных с мягкой тканью культи поджелудочной железы и узким диаметром Вирсунгова протока, позволяя при этом снизить количество специфических осложнений и улучшить результаты лечения.
Рак поджелудочной железы, состояние культи поджелудочной железы, панкреатоеюностомия, панкреатогастростомия
Короткий адрес: https://sciup.org/142211246
IDR: 142211246 | УДК: 617.58-001-089
Текст научной статьи Сравнительный анализ результатов формирования панкреатодигестивных анастомозов
Несмотря на совершенствование способов хирургического лечения больных с опухолями периампулярной зоны, проблема послеоперационных осложнений остается весьма актуальной. [1] Со времени впервые выполненной Whipple в 1936 г. панкреатодуоденальной резекции не умолкают споры среди хирургов о выборе варианта реконструктивного этапа операции. В первую очередь, о способе формирования панкреатодигестивного соустья. [2, 3] С течением времени из всех видов панкреатодигестивных анастомозов (ПДА) остались лишь два основополагающих - анастомоз культи поджелудочной железы с тощей кишкой либо с желудком. Наиболее частым послеоперационным осложнением после ПДР является несостоятельность панкреатодигестивного соустья и формирование панкреатического свища на фоне краевого некроза культи поджелудочной железы.
Даже несмотря на положительные тенденции, связанные с уменьшением послеоперационных осложнений и смертности, процент послеоперационных панкреатических свищей и по сей день продолжает оставаться весьма высоким, достигая даже в крупных хирургических центрах 30% [4] Проведенные к настоящему времени мультицентровые проспективные исследования не дали утвердительного ответа о явном преимуществе панкреатогастроанастомоза (ПГА) либо панкреатоеюноанастомоза (ПЕА). [5, 6] Причиной этому, во многом, явилась разрозненность данных различных исследований, отсутствие определенности в понятии панкреатического свища, большое количество технических модификаций ПДР и самое, на наш взгляд важное, не учитывалось состояние культи поджелудочной железы. [7,8] Вместе с тем, большинство авторов констатируют, что в случаях плотной культи поджелудочной железы, расширенном Вирсунговом протоке количество осложнений, связанных с ПДА, минимальное.
В этой связи, мы поставили цель провести сравнительный анализ результатов ПДР у больных, которым на реконструктивном этапе в нашей хирургической клинике был сформирован либо ПЕА либо ПГА при неудовлетворительных условиях со стороны культи поджелудочной железы (ткань поджелудочной железы мягкая, узкий диаметр главного панкреатического протока).
Материалы и методы
В исследовании использовался анализ лечения 659 пациентов в возрасте от 27 до 80 лет (59,4±11,3) с новообразованиями периампулярной зоны, находившихся в клинике за период с августа 2007 года по декабрь 2013 года. Из них с раком головки поджелудочной железы было 362 (54,9%) пациента, раком терминального отдела холедоха 149 (22,6%), опухолью БДС – 148 (22,5%).
Радикальное оперативное вмешательство выполнено 153 (23,2%) больным. На реконструктивном этапе при выпол- нении ПДР при наличии удовлетворительных условий для формирования панкреатодигестивного соустья («плотная» ткань поджелудочной железы, диаметр Вирсунгова протока больше 3 мм) формировался панкреатоеюноанастомоз (ПЕА) – 49 больных. Необходимо отметить, что дренаж в панкреатический проток при удовлетворительных условиях для формирования ДА не устанавливался.
При наличии неудовлетворительных условий (узкий Вирсунгов проток – менее 3 мм; мягкая, дольчатая ткань поджелудочной железы) – формировался либо ПЕА с наружным дренажом главного панкреатического протока либо панкреатогастроанастомоз (ПГА) с «потерянным» дренажем главного панкреатического протока. Учитывая наибольшую сложность формирования ПДА при наличии вышеописанных условий – только данная категория больных и стала объектом нашего исследования. Тем самым, эти больные и составили две группы - ПЕА был сформирован в 51, ПГА – в 53 случаях.
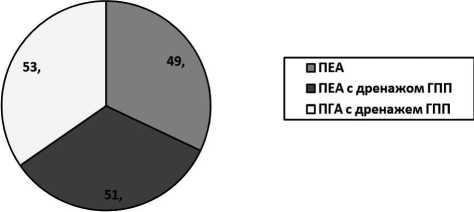
Рис. 1. Типы панкреатодигестивных анастомозов, использованных на реконструктивном этапе ПДР
Способы профилактики краевого панкреонекроза и последующей несостоятельности панкреатодигестивного соустья были стандартными как при формировании ПЕА, так ПГА.
Техника операции
У всех пациентов, которые вошли в наше исследование, выполнялась ПГДР с антрум резекцией желудка, выполнение пилоросохраняющей ПДР было критерием исключения из нашего исследования.
При выполнении реконструктивного этапа ПДР всем больным, несмотря на состояние остающейся ткани культи поджелудочной железы мы формировали панкреатоею-ноанастомоз. Он формировался позадиободочно, «конец в бок», однорядными узловыми швами ПДС 4/0 с прошиванием всей толщи поджелудочной железы и с выколом иглы в просвет Вирсунгова протока. При диаметре главного панкреатического протока менее 3 мм, предварительно в него устанавливался дренаж, который выводился через петлю тонкой кишки наружу.
В виду отсутствия динамики уменьшения количества послеоперационных осложнений у больных с неудовлетво-
рительными условиями для формирования ПДА на реконструктивном этапе ПДР мы стали применять панкреатога-строанастомоз.
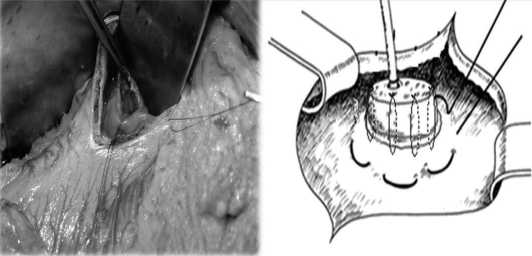
Рис. 2, 3 Этапы формирования панкреатогастроанастомоза
Особенности техники его формирования следующие: выполняются два гастротомических отверстия (на передней и задней стенке желудка). С целью повышения герметичности анастомоза гастротомия задней стенки желудка производится минимальная, что позволяет ей эластично охватывать культю поджелудочной железы, и отступя на 1,5 см от края заднего гастротомического отверстия, на стенку желудка накладывается кисетный шов (рис. 2, 3). Мобилизация культи поджелудочной железы составляет до 3-4 см, после чего она «погружается» в просвет желудка с предварительной установкой в главный панкреатический проток «потерянного» дренажа. Капсула поджелудочной железы сшивается с серозно-мышечным слоем стенки желудка однорядными узловыми швами монофиламентной нитью из рассасывающегося материала, после чего затягивается кисетный шов, с целью еще большего увеличения герметичности соустья. Последним этапом ушивается переднее га-стротомическое отверстие.
Послеоперационное ведение больных
В послеоперационном периоде проводился контроль за амилазной активностью отделяемого по страховочным дренажам из брюшной полости. Амилазная активность определялась на 1, 3 и 5 сутки послеоперационного периода. В дальнейшем он проводился по показаниям (при сохранении повышенного уровня амилазы). Также на уровень амилазы исследовалась любая жидкость, полученная при пункции из интраабдоминальных жидкостных скоплений.
Результаты
Необходимо еще раз подчеркнуть, что в нашем исследовании проводился анализ результатов лечения только наиболее сложной категории больных, у которых условия для формирования панкреатодигестивного соустья в обеих группах были неудовлетворительными (ткань поджелудочной железы мягкая, дольчатая, диаметр Вирсунгова протока менее 3 мм). В этих условиях ПЕА с дренажем главного панкреатического протока был сформирован - 51, ПГА с дренажем главного панкреатического протока – 53 больным.
При сравнении результатов применения ПЕА и ПГА мы использовали классификацию осложнений реконструктивного этапа ПДР, которую предлагает International Group of Pancreatic Surgery (ISGPS).
В 2005 году ISGPS ввела понятия, по которым можно объективно оценивать преимущества того либо иного варианта анастомоза - это послеоперационный панкреатический свищ (ПОПС), гастростаз, послеоперационные геморрагические осложнения (ПОГО). [9, 10]
Послеоперационным панкреатическим свищом (ПОПС) является любое количество свободной жидкости, выделяющейся по дренажу на третий и последующие послеоперационные дни с амилазной активностью трехкратно превышающей уровень амилазы в сыворотке (нормальным уровнем принято считать 300 Ед/л). Классификация панкреатических свищей ISGPF включает разделение послеоперационных панкреатических свищей на 3 категории: «A», «В», «C» по потребности в специфическом лечении, возможности визуализации с помощью неинвазивных методик, таких как КТ и УЗИ, потребности в дренировании, реоперации, повторной госпитализации. [11]
У больных с ПЕА в 14 (27,5%) случаях отмечен ПОПС. По классификации ISGPS класс «А» был у 3, класс «В» – у 7, класс «С» – у 4 больных (Рис.4).
При формировании ПГА панкреатический свищ выявлен у 9 (16,9%) больных. Класс «А» – у 5, класс «В» – у 4 пациентов. Необходимо отметить, что в этой группе больных свищей класса «С» не было (Рис. 5).
ПОПС категории «А» не нуждается в специфическом лечении, ограничении диеты. Из лекарственных средств применялись только прокинетики. При наличии свища категории «В» уже применялась специфическая терапия, которая включала длительное назначение препарата «Сандостатин» (Октреотида). Клинико-инструментальная картина свища категории «С» требовала срочного либо отсроченного оперативного лечения в объеме чрескожного дренирования жидкостного образования под УЗ либо повторной операции.
Гастростаз в группе больных с ПЕА отмечен у 8 (15,7%) пациентов. У 5 больных – класс «А», у двух больных – класс «В и у одного больного – класс «С» (Рис. 4).
У больных с ПГА явления гастростаза выявлены в 9 (16,9%) случаях. У одного больного – класс «А», у шести – класс «В», у двух – класс «С» (Рис. 5).
Понятие «гастростаз» определено как невозможность удаления назогастрального зонда на третий и следующие после операции дни или же невозможность приема твердой пищи на 7 день послеоперационного периода. В зависимости от длительности нахождения назогастрального зонда

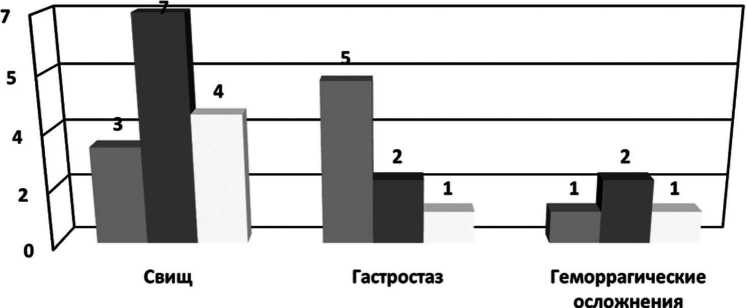
Рис. 4. Специфические осложнения у больных, перенесших формирование ПЕА
-
■ Класс А
-
■ Класс В Класс С
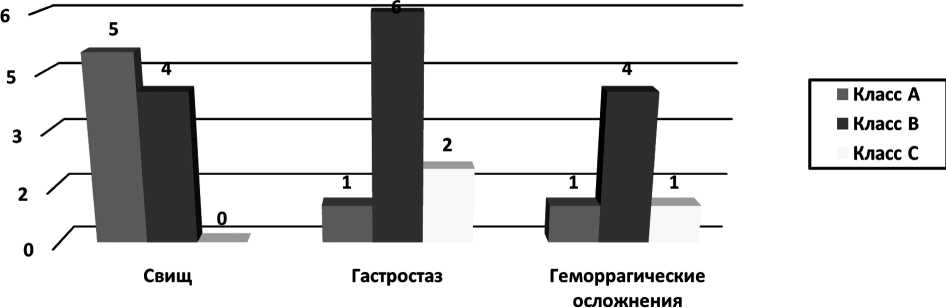
Рис. 5. Специфические осложнения у больных, перенесших формирование ПГА
(7, 14, 21 день), возможности приема твердой пищи (14, 21 день), гастростаз разделялся на 3 класса: «А», «В» и «С». Класс «А» требовал лишь прокинетической консервативной терапии, класс «В» - удлинение стационарного лечения и в некоторых случаях диагностический поиск возможной причины гастростаза, класс «С» - инвазивных манипуляций (проведения контрольных гастроскопий, установки зонда для проведения интестинального питания).
Геморрагические осложнения у больных с ПЕА отмечены у 4 (7,8%) пациентов. Класс «А» – у одного, класс «В» – у двух, класс «С» – у одного пациента (Рис.4).
У больных с ПГА геморрагические осложнения отмечены в 6 (11,3%) случаях. Класс «А» – в одном, класс «В» – в 4, класс «С» – в одном случае (Рис.5).
Понятие «геморрагическое осложнение» (ПОГО) определено ISGPS как любое геморрагическое осложнение вследствие формирования панкреатического свища. Геморрагические осложнения разделяли во времени: на ранние (в течение первых 24 часов после операции) и поздние, и по источнику кровотечения: внутри- и внепросветные. Хирургическим вмешательством «первой линии» служило ЭГДС с проведением эндоскопического гемостаза. При наличии не- массивных внутрипросветных кровотечений проводилась консервативная терапия в объеме плазмотрансфузии, при неэффективности которой, выполняли лапаротомию с ревизией анастомоза.
Сравнивая между собой осложнения после ПЕА и ПГА согласно классификации Clavien-Dindo [12], мы в итоге получили следующие результаты. Осложнения первой степени отмечены у 7 больных с ПЕА и у 8 больных с ПГА, второй степени у 10 и 9 пациентов, третьей степени у 4 и 6 больных соответственно, четвертой степени по одному больному в каждой группе, осложнение пятой степени было у одного больного после формирования ПЕА (Рис. 6).
С целью купирования последствий несостоятельности ПЕА пункционно-дренирующие способы лечения применены у 9 пациентов. Релапаротомия выполнена двум больным.
Летальный исход зафиксирован в трех случаях. У двух (3,9%) больных с арозивным кровотечением из верхнебрыжеечной вены на фоне несостоятельности панкреатоеюноа-настомоза, с формированием внутрибрюшного абсцесса, приведшему к арозии сосуда, внутрибрюшному кровотечению и массивной кровопотере, полиорганной недостаточ-
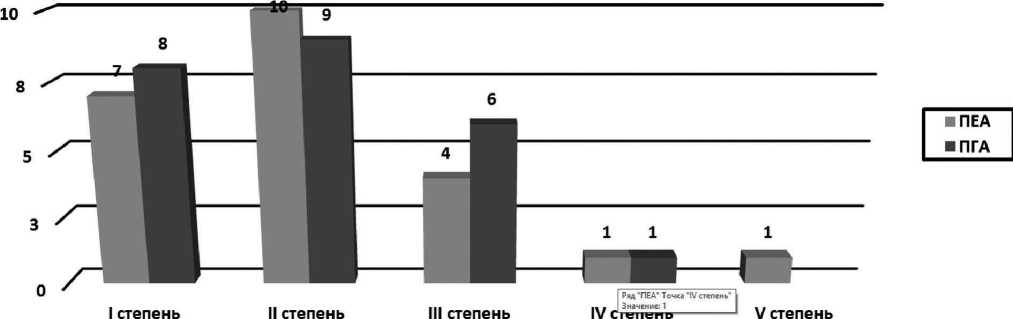
Рис. 6. Распределение больных по группам классификации Clavien-Dindo.
ности. У одного (1,8%) больного после формирования ПГА в послеоперационном периоде развилась острая сердечная недостаточность, причиной которой явилась ТЭЛА.
Обсуждение
Множество различных исследований сравнивают ПГА и ПЕА, но, к сожалению, они дают противоречивые данные о явном преимуществе ПГА либо ПЕА в развитие в послеоперационном периоде ПОПС. Причиной этому по нашему мнению является отсутствие разграничения больных по условиям формирования ПДА. Мы провели анализ результатов лечения больных только с неудовлетворительными условиями для формирования панкреатодигестивного соустья, используя критерии ISGPS. Класс «А» послеоперационного панкреатического свища не учитывался нами как первичная точка отсчета, так как, по сути, свищ этого класса представляет собой только биохимические изменения, не требующие вмешательства. Класс свищей «В» и «С» реже встречался у больных с ПГА, что подтверждает данные ISGPS в отношении профилактики ПОПС у больных со сформированным ПГА.
Таблица 1
Специфические осложнения у больных, перенесших формирование ПЕА и ПГА
|
ПОПС |
Гастростаз |
ПОГО |
|
|
ПЕА (n-51) |
14 (27,5%) |
8 (15,7%) |
4 (7,8%) |
|
ПГА (n-53) |
9 (16,9%) |
9 (16,9%) |
6 (11,3%) |
Анализ результатов формирования панкреатодигестив-ного анастомоза при неудовлетворительных условиях его выполнения (узкий Вирсунгов проток – менее 3 мм; мягкая, дольчатая ткань поджелудочной железы) показывает достаточно большой процент специфических осложнений независимо от способа его формирования (ПЕА либо ПГА).
Так явления гастростаза в послеоперационном периоде примерно одинаково встречались в обеих группах больных (15,7% и 16,9% соответственно). Количество геморрагических осложнений чаще встречались после формирования ПГА (7,8% и 11,3% соответственно). Послеоперационные панкреатические свищи значительно чаще возникали у пациентов после ПЕА (27,5% против 16,9%), так как ПГА показал себя более надежным у пациентов с неудовлетворительными условиями для формирования панкреатоди-гестивного анастомоза (таб. 1). Необходимо отметить, что релапаротомии были только в группе пациентов с ПЕА, а летальность в этой группе была выше, чем у пациентов с ПГА (3,8% и 1,8% соответственно).
Полученные результаты говорят о том, что использование ПГА обосновано для применения у больных с неудовлетворительными условиями для формирования ПДА; в свою очередь ПЕА, по нашему мнению, следует применять при наличии удовлетворительных условий для формирования соустья.
Заключение
Объективное сравнение результатов реконструктивного этапа ПДР у больных с неудовлетворительными условиями для формирования панкреатодигестивного соустья позволяет сделать вывод, что применение ПГА может служить способом выбора при формировании панкреатодигестив-ного анастомоза у больных с мягкой тканью культи поджелудочной железы и узким диаметром Вирсунгова протока, позволяя при этом снизить количество специфических осложнений и улучшить результаты лечения.
Список литературы Сравнительный анализ результатов формирования панкреатодигестивных анастомозов
- Кубышкин В.А. Важнейшие осложнения панкреатодуоденальных резекций. Анналы хирургической гепатологии. 1998.Т.З. №3. С. 35-40. Kubishkin v.A. Main complications after pancreatic resections Annaly khirurgicheskoy gepatologii. 1998.У.З. №3. P. 35-40.
- Патютко Ю.И., Котельников А.Г. Рак поджелудочной железы: диагностика и хирургическое лечение на современном этапе. Анналы хирургической гепатологии. 1998, том 3, 1, C. 96-111. Patutko Y.I., Kotelnikov A.G. Pancreatic cancer: diagnostic and surgical treatment. Annaly khirurgicheskoy gepatologii. 1998, V. 3, 1, P. 96-111.
- wente MN, Shrikhande Sv, Muller Mw, Diener MK, Seiler CM, Friess H, et al. Pancreaticojejunostomy versus pancreaticogastrostomy: systematic review and meta-analysis. Am J Surg 2007;193(2):171-183. PMID: 17236843 DOI: 10.1016/j.amjsurg.2006.10.010
- Bassi C, Dervenis C, Butturini G, Fingerhut A, Yeo C, Izbicki J, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005;138(1):8-13. doi:10.1016/j. surg.2005.05.001. PMID: 16003309
- Yeo CJ, Cameron JL, Maher MM, Sauter PK, Zahurak ML, Talamini MA, et al. A prospective randomized trial of pancreaticogastrostomyversuspancreaticojejunostomyafterpancreaticoduodenectomy. Ann Surg 1995;222(4):580-588. discussion 588-92. PMID: 7574936
- Bassi C, Falconi M, Molinari E, Salvia R, Butturini G, Sartori N, et al. Reconstruction by pancreaticojejunostomy versus pancreaticogastrostomy following pancreatectomy: results of a comparative study. Ann Surg 2005;242(6):767-771. doi:10.1097/01. sla.0000189124.47589.6d, discussion 771-3. PMID: 16327486
- Duffas JP, Suc B, Msika S, Fourtanier G,Muscari F, hay JM, et al. A controlled randomized multicenter trial of pancreatogastrostomy or pancreatojejunostomy after pancreatoduodenectomy. Am J Surg 2005;189(6):720-729. PMID: 15910726 DOI: 10.1016/j.amjsurg.2005.03.015
- wente MN, Bassi C, Dervenis C, Fingerhut A, Gouma DJ, izbicki JR, et al. Delayed gastric emptying (DGE) after pancreatic surgery: a suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery2007;142(5):761-768. doi:10.1016/j. surg.2007.05.005. PMID: 17981197
- Hashimoto D, Chikamoto A, Ohmuraya M, Hirota M, Baba H. Pancreaticodigestive anastomosis and the postoperative management strategies to prevent postoperative pancreatic fistula formation after pancreaticoduodenectomy. Surg Today. 2013 Jul 11. oi: 10.1007/s00595-013-0662-x. Epub 2013 Jul 11. PMID: 23842691
- Mimatsu K, Kano H, Kawasaki A, Kuboi Y, Fukino N, Kida K, Amano S. Oida T. Pancreaticogastrostomy in patients with considerably dilated pancreatic ducts. Hepatogastroenterology. 2012 0ct;59(119):2330-2. PMID: 23435147 DOI: 10.5754/hge10206
- Clavien PA, Barkun J, de Oliveira Ml, vauthey JN, Dindo D, Schulick RD, de Santibanes E, Pekolj J, Slankamenac K, Bassi C, Graf R, Vonlanthen R, Padbury R, Cameron JL, Makuuchi M.The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009 Aug;250(2):187-96. PMID: 19638912 DOI: 10.1097/SLA.0b013e3181b13ca2
- Casadei R, Ricci C, Pezzilli R, Calculli L, Rega D, D'Amb-ra M, Minni F. Usefulness of the Clavien-Dindo classification after pancreaticoduodenectomy. ANZ J Surg. 2011 0ct;81(10):747-8. PMID: 22295320


