Сравнительный анализ результатов хирургического и лучевого лечения I стадии рака почки
Автор: Сабельникова Ж.Е., Сарычева М.М., Мозерова Е.Я., Важенин А.В., Ложков А.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования. Вопросы лучевой терапии
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Цель исследования: Провести сравнительную оценку результатов хирургического и лучевого лечения пациентов с I стадией почечно-клеточного рака (ПКР) в аспекте показателей общей выживаемости (ОВ), выживаемости без прогрессирования (ВБП), локального контроля и изменения почечной функции. Материал и методы: С 2011 г. по 2022 г. в Челябинском областном клиническом центре онкологии и ядерной медицины пролечено 170 пациентов с I стадией ПКР. Нами проведено ретроспективное исследование результатов их лечения. Первая группа - 115 пациентов, которые подверглись хирургическому лечению рака почки в стадии T1N0M0 (преимущественно в объеме резекции почки - 85 человек), вторая группа - 55 пациентов с верифицированным T1N0M0 почечно-клеточным раком, которым проводилась стереотаксическая лучевая терапия (СТЛТ) до 30-45 Гр за 3 фракции на аппарате CyberKnife. СТЛТ проводилась преимущественно по поводу лечения первичной опухоли почки, в 7 случаях - по поводу рецидива рака почки, в том числе у 1 пациента по поводу рецидива рака обеих почек. Средний возраст больных в группе операции составил 73 года, в группе СТЛТ - 69,9 лет. Средний диаметр опухоли в группе операции - 4,3 см, в группе СТЛТ - 3,5 см.
Рак почки, резекция почки, нефрэктомия, стереотаксическая лучевая терапия, почечная токсичность
Короткий адрес: https://sciup.org/140306978
IDR: 140306978 | DOI: 10.18027/2224-5057-2024-009
Текст научной статьи Сравнительный анализ результатов хирургического и лучевого лечения I стадии рака почки
На протяжении последних 10 лет рак почки в структуре онкологической заболеваемости занимает 3,8% [1]. Основным методом лечения локализованного рака почки является операция в объеме резекции почки или нефрэктомии [2]. Это обусловлено высокими результатами общей выживаемости (ОВ), онкоспецифической выживаемости, выживаемости без прогрессирования (ВБП). Так, трехлетняя онкоспецифическая выживаемость пациентов с почечно-клеточной карциномой T1N0M0 составила 99,3% и 99,2% после лапароскопической и открытой резекции почки соответственно [3]. Двухлетние показатели локального контроля, ВБП, онкоспецифической и общей выживаемости среди 219 пациентов при медиане наблюдения в 2,6 года составили 98%, 77,5%, 98,2% и 81,5% соответственно [4].
Краеугольным камнем сравнения нефрэктомии и резекции почки является изменение почечной функции. По настоящее время проведены многочисленные исследования с целью определения оптимальной тактики хирургического лечения для пациентов с T1N0M0 почечно-клеточным раком (ПКР), в том числе в аспекте сохранения почечной функции. Известно, что ее снижение связано с более высо- ким риском тяжелых сердечно-сосудистых заболеваний и смертностью. По результатам мета-анализа 21 исследования случай-контроль с участием 11204 пациентов, опубликованного в 2017 году, резекция почки может привести к меньшим рискам развития почечной недостаточности, но частота возникновения тяжелой хронической болезни почек (СКФ < 30 мл/мин) почти одинакова между сравниваемыми объемами оперативного вмешательства [5]. К аналогичным выводам пришел Forbs C.M. с соавторами, продемонстрировав, что ВБП после резекции почки и нефрэктомии при T1N0M0 раке почки была одинаковой, но после резекции почечная функция оставалась более высокой [6]. В 2019 году опубликованы результаты мета-анализа, в который было включено 16 исследований с участием 33117 пациентов. Не было обнаружено существенной разницы в 5- и 10-летних показателях ОВ и ВБП, при этом 5- и 10-летние показатели онкоспецифической выживаемости были выше в группе нефрэктомии. Таким образом, резекция почки позволяет обеспечить сопоставимые результаты ОВ и ВБП и, что важно, лучшее сохранение почечной функции, несмотря на более низкие показатели онкоспецифической выживаемости [5,7].
Однако несмотря на то, что хирургическое вмешательство является стандартом лечения локализованного ПКР, значительное число пациентов остается неоперабельным из-за тяжести сопутствующей патологии, некоторые отказываются от хирургического вмешательства. Альтернативные локальные подходы, такие как радиочастотная абляция или криоабляция, являются инвазивными и часто ограничиваются малыми размерами опухоли, следовательно, существует потребность в альтернативных местных методах лечения, таких как стереотаксическая лучевая терапия опухоли почки [8].
Стереотаксическая лучевая терапия (СТЛТ) — сравнительно новый метод лечения первичной опухоли почки, и в настоящее время не рекомендуется его проведение в рутинной клинической практике лечения опухоли почки в связи с недостаточной изученностью вопроса [2]. Однако из всей проводимой лучевой терапии пропорция СТЛТ в лечении локализованного ПКР резко увеличилась с 2004 по 2013 год с 25% до 95% [9].
Литературные данные демонстрируют имеющуюся эффективность СТЛТ в лечении локализованного рака почки в аспекте достаточно высоких показателей ОВ и локального контроля при низкой почечной токсичности. Так, Ali M. с соавторами опубликовали обзор, в который были включены два мета-анализа (54 исследования), а также 13 проспективных и 20 ретроспективных исследований. В совокупности СТЛТ для 589 первичных ПКР привела к локальному контролю выше 90% с токсичностью 3–4 степени 0–9% [10].
В 2022 году были опубликованы многообещающие результаты применения СТЛТ в лечении ПКР, в том числе у пациентов с единственной почкой. СТЛТ в режиме радиохирургии была проведена 81 пациенту, в режиме гипофрационирования — 109 пациентам. Медиана диаметра опухоли составила 4 см. Единственная почка была у 56 (29%) из 190 пациентов. Медиана расчетной скорости клубочковой фильтрации на исходном уровне составила 60 мл/мин/1,73 м2 (42,0–76,0) и снизилась на 14,2 мл/мин/ 1,73 м2 к 5 годам после СТЛТ. Семь (4%) пациентов нуждались в диализе после СТЛТ. Частота возникновения продолженного роста опухоли за 5 лет составила 5,5%. Не было токсических эффектов 3 степени или летальных исходов, связанных с лечением. У одного (1%) больного развилась острая язва двенадцатиперстной кишки 4 степени [112].
В проспективном исследовании Siva S. с соавторами проанализировали результаты лечения 34 почек у 33 пациентов со средним возрастом 78 лет. Связанная с лечением токсичность 1–2 степени наблюдалась у 26 пациентов (78%) и токсичность 3 степени у одного пациента (3%). Не было зарегистрировано токсичности 4–5 степени, и шесть пациентов (18%) сообщили об отсутствии токсичности. Двухлетние показатели локального контроля, ВБИ и ОВ составили 100%, 89% и 92% соответственно. Средняя исходная скорость клубочковой фильтрации составляла 55 мл/мин/1,73 м2, которая снизилась до 44 мл/мин/1,73 м2 через 1 и 2 года (р < 0,001) [12].
Следует отметить, что оценка локального контроля осуществлялась с помощью инструментальных методов диагностики, а именно — компьютерной томографии с контрастным усилением, и преимущественно не ранее, чем через 6 месяцев после завершения СТЛТ из-за возникающей зоны радионекроза, которая может быть принята за продолженный рост. Известно, что в случае проведения лучевой терапии высокими разовыми очаговыми дозами гибель клеток протекает по механизму апоптоза. Однако поскольку ионизирующее излучение может вызвать и отсроченную гибель клеток, жизнеспособные опухолевые клетки могут быть обнаружены вскоре после СТЛТ, поэтому рутинная биопсия после СТЛТ не рекомендуется [13].
С целью сравнения результатов хирургического и лучевого лечения I стадии ПКР было проведено крупномасштабное ретроспективное исследование, включившее около двухсот тысяч пациентов. Операция проводилась 165298 пациентов, 104 пациента получили СТЛТ и 18241 пациентов были в группе наблюдения. Показатели 5-летней ОВ в группе оперативного лечения были значимо выше, чем в группе СТЛТ (86% и 73% соответственно, p < 0,001). Но следует отметить, что в контрольной группе 5-летняя ОВ была почти в 2 раза ниже, чем в группе СТЛТ (43% против 73% соответственно), что свидетельствует об эффективности применения лучевой терапии [14].
Все вышеперечисленное послужило поводом к проведению этого исследования.
Цель исследования: Провести сравнительную оценку результатов хирургического и лучевого лечения пациентов с I стадией почечно-клеточного рака (ПКР) в аспекте показателей общей выживаемости (ОВ), выживаемости без прогрессирования (ВБП), локального контроля и изменения почечной функции.
Материалы и методы исследования: нами было проведено ретроспективное исследование, в котором мы сравнили результаты разного вида лечения T1N0M0 ПКР. Первая группа — хирургическое лечение, вторая — СТЛТ. Группа хирургического лечения включила 115 пациентов, группа лучевой терапии — 55 пациентов. Лечение проводилось в Челябинском областном клиническом центре онкологии и ядерной медицины в период с 2011 по 2022 гг. Выбор тактики лечения осуществлялся на мультидисци-плинарном консилиуме. В обеих группах пациенты были с T1N0M0 стадией ПКР, соматически стабильные, с сохранной функцией почек.
Средний возраст больных в группе хирургического лечения составил 73 ± 6,6 лет (от 51 до 85 лет). Средний диаметр опухоли — 4,3 см. Преимущественно пациентам выполнялась резекция почки — 85 пациентов, в 30 случаях проводилась нефрэктомия. Преобладал светлоклеточный вариант ПКР (105 случаев), в 7 случаях определен хромофобный вариант и по 1 случаю — папиллярный, эозинофильноклеточный и смешанный.
СТЛТ проводилась в случае неоперабельности пациента из-за тяжести сопутствующей патологии, степени анестезиологического риска ASA IV, при размерах опухоли до 5 см в диаметре. Не проводилась СТЛТ при декомпенсации сопутствующей патологии, генерализации процесса, при хронической болезни почек С5, при опухоли более 5 см в диаметре. Средний возраст больных в группе лучевой терапии составил 69,9 ± 8,9 лет (от 49 до 93). Средний диаметр опухоли — 3,5 см. Преимущественно лучевая терапия проводилась по поводу первичной опухоли (49 случаев), но в 7 случаях — по поводу рецидива ПКР после хирургического лечения, в том числе у 1 пациента по поводу рецидива ПКР обеих почек. Гистологически также преобладал светлоклеточный вариант ПКР (52 случая), реже — папиллярный (3 случая) и темноклеточный (1 случай).
Более подробно характеристика пациентов представлена в таблице 1.
СТЛТ проводилась с использованием разных режимов фракционирования, радиохирургия не использовалась, чаще всего подводилось 45 Гр за 3 фракции (33 случая). Выбор разовой очаговой дозы и режима фракционирования определялся с учетом объема первичной опухоли, толерантности критических структур. Случаи подведения меньших суммарных очаговых доз связаны с невозможностью преодоления толерантности критических структур (чаще всего тонкого кишечника, при расстоянии между опухолью и тонким кишечником менее 5 мм разовая и суммарная очаговые дозы уменьшались): 30 Грей — в 12 случаях, 36 Гр — в 7 случаях, 39 Гр — в 4 случаях.
Стереотаксическая лучевая терапия проводилась на аппарате CyberKnife с предшествующей подготовкой: установкой 3 рентгеноконтрастных маркеров в опухоль почки под ультразвуковым контролем, проведением МСКТ-разметки на индивидуальном фиксирующем матрасе через 7 дней после имплантации меток в почку. Физико-техническое планирование осуществлялось по 80%-ной изодозе. Средняя доза в опухоли составила 51 Гр (от 30 до 63 Гр). Лечение проводилось с использованием системы слежения за дыханием Synchrony®. Необходимость в описанной подготовке диктуется имеющимися внутри- и межфракционными движениями почек и органов риска, особенно тонким кишечником и печенью. Однако перечисленные меры подготовки обеспечивают прецизионность лучевой терапии, что позволяет подводить высокие разовые и суммарные дозы без увеличения почечной токсичности.
Таблица 1. Характеристика пациентов
Table 1. Patients’ characteristics
|
Показатель |
Операция |
СТЛТ |
|||
|
% |
Абс. |
% |
Абс. |
||
|
Пол |
Мужчины |
34% |
39 |
56% |
31 |
|
Женщины |
66% |
76 |
44% |
24 |
|
|
Сторона поражения |
Правая почка |
47% |
54 |
55% |
31 |
|
Левая почка |
53% |
61 |
45% |
25 |
|
|
Стадия |
Т1а |
51,3% |
59 |
66% |
37 |
|
Т1b |
48,7% |
56 |
34% |
19 |
|
Статистическая обработка данных производилась при помощи пакетов прикладных программ IBM SPSS Statistics Version 20 (IBM, USA). Критериями оценки результатов лечения были показатели общей выживаемости, одно-, трех- и пятилетней ОВ, выживаемости без прогрессирования, рассчитанные по методу Каплана-Майера. Локальный контроль в группе хирургического лечения определялся по возникновению рецидива в ложе, в группе лучевой терапии — по критериям RECIST 1.1 спустя 6 месяцев после лечения. Почечная токсичность оценивалась по изменению скорости клубочковой фильтрации спустя 6 месяцев после лечения, определяемой по формуле CKD-EPI.
Результаты и обсуждение: как и ожидалось, показатели ОВ в группе хирургического лечения оказались выше, чем в группе лучевой терапии (рис. 1).
Следует отметить, что в группе СТЛТ медиана ОВ не достигнута в связи с тем, что большинство пациентов в настоящее время живы (49 пациентов из 55), при этом среднее время наблюдения составило 125 месяцев (табл. 2). Важно, что 1-летняя онкоспецифическая выживаемость в обеих группах составила 100 %.
В целом такая же тенденция наблюдается при оценке ВБП. Так, 1-летняя ОВ в группе операции составляет 96,9%, в группе СТЛТ — 93,4%. После хирургического лечения ВБП остается высокой и спустя 5 лет и составляет 89,6%.
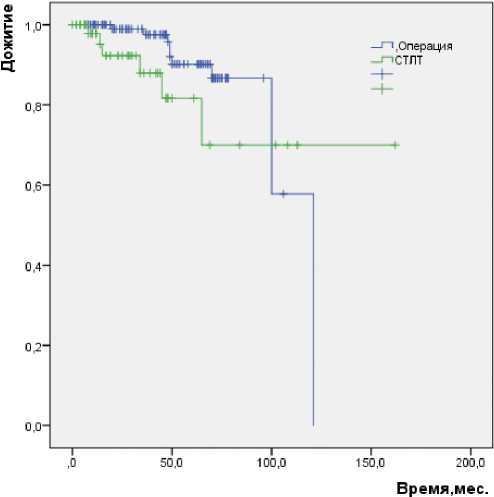
Рисунок 1. Общая выживаемость в обеих группах (по оси абсцисс — время жизни в месяцах, по оси ординат — показатель выживаемости, синяя кривая — группа хирургического лечения, зеленая кривая — группа СТЛТ)
Figure 1. Overall survival in both groups (X-axis — survival time in months, Y-axis — survival rate, blue curve — surgical treatment group, green curve — stereotactic radiation therapy group)
Таблица 2. Показатели ОВ в исследуемых группах
Table 2. Overall survival rates in the study groups
|
Показатель |
Операция |
СТЛТ |
р |
|
Медиана ОВ |
121 месяц |
Не достигнута |
< 0,05 |
|
1-летняя |
98,9% |
95,1% |
|
|
3-летняя |
97,5 % |
87,9% |
|
|
5-летняя |
90,2% |
70% |
В структуре прогрессирования после операции преобладала генерализация процесса (15 пациентов) преимущественно с поражением легких и костей, в большинстве случаев после резекции почки (10 случаев). В аспекте нашего исследования больший интерес представляло возникновение рецидива в ложе удаленной опухоли. Так, у 4 пациентов (3,5%) возник рецидив в ложе удаленной опухоли, в среднем спустя 28 месяцев. Во всех случаях он возникал после резекции почки.
При анализе локального контроля в группе лучевой терапии, как и ожидалось, отмечена стабилизация процесса в большинстве случаев. Так, у 42 пациентов (75%) по критериям RECIST 1.1 спустя 6 месяцев после СТЛТ зафиксирована стабилизация процесса, в 20% случаях (11 пациентов) — частичный ответ, в 5% (3 пациента) — прогрессирование процесса: продолженный рост опухоли через 144 месяца в случае подведения СОД в 30 Гр и 2 случая продолженного роста через 12 месяцев — в случае СОД = 45 Гр. Зафиксирован уровень 1-летнего локального контроля в 96,4 %.
Оценка почечной токсичности производилась по изменению показателя скорости клубочковой фильтрации (СКФ), рассчитанной по формуле CKD-EPI, через 6 месяцев после проведенного лечения. Так, появление ренальной токсичности было зафиксировано у 10 пациентов (18%) в группе лучевой терапии и у 38 пациентов (33%) в группе
Таблица 3. Динамика изменения СКФ
Table 3. Dynamics of changes in glomerular filtration rate
В группе хирургического лечения СКФ снижалась более выраженно у пациентов, перенесших нефрэктомию, что закономерно и не требует пояснения. У пациентов в группе лучевой терапии, у которых снижалась СКФ после лечения, почечная функция восстановилась в течение года или осталась стабильной. Важно, что ни в одном случае ни в одной группе не требовалось осуществления диализа после проведенного хирургического или лучевого лечения. Таким образом, оба метода лечения T1N0M0 ПКР безопасны с точки зрения почечной токсичности.
Заключение: полученные нами данные свидетельствуют о том, что наиболее эффективным методом лечения ПКР остается хирургический, который позволяет полностью убрать опухолевый процесс без значимого изменения почечной функции. Однако проведение СТЛТ в лечении T1N0M0 ПКР демонстрирует многообещающие результаты и при наличии противопоказаний к операции, вероятно, может быть применена в лечении неоперабельных пациентов с I стадией ПКР.
Список литературы Сравнительный анализ результатов хирургического и лучевого лечения I стадии рака почки
- Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022.252 с. Malignant tumors in Russia in 2021 (morbidity and mortality). Eds.: A.D. Kaprin, V.V. Starinskiy, A.O. Shachzadova. Moscow: MNIOI im. P.A. Gertsena - filial FGBU "NMITS radiologic Minzdrava Rossii, 2022.252 p. (In Russ.)
- Клинические рекомендации. Злокачественные новообразования паренхимы почки, 2021. Доступно по: https:// cr.minzdrav.gov.ru/recomend/10_2 Clinical Guidelines. Malignant neoplasms of the renal parenchyma, 2021. Available at: https://cr.minzdrav.gov.ru/ recomend/10_2. (In Russ.)
- Gill I.S., Kavoussi L.R., Lane B.R., et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol 2007;178(l):41-6. https://doi.Org/10.1016/j.juro.2007.03.038
- Magee D.E., Wong J.K., Correa A.F. Stereotactic ablative body radiotherapy: an emerging weapon in the treatment armamentarium for renal cell carcinoma or a potential avenue for overtreatment? Eur Urol 2022;82(6):623-624. https:// doi.org/10.1016/j.eururo.2022.07.020
- Mir M.C., Derweesh I., Porpiglia F., et al. Partial nephrectomy versus radical nephrectomy for clinical Tib and T2 renal tumors: a systematic review and meta-analysis of comparative studies. Eur Urol 2017;71(4):606-17. https://doi. org/10.1016/j.eururo.2016.08.060
- Forbes C.M., Rendon R.A., Finelli A., et al. Disease progression and kidney function after partial vs. radical nephrectomy for T1 renal cancer. Urol Oncol 2016;34(ll):486.el7-23. https://doi.Org/10.1016/j.urolonc.2016.05.034.
- Jiang Y.L., Peng C.X., Wang H.Z., Qian L.J. Comparison of the long-term follow-up and perioperative outcomes of partial nephrectomy and radical nephrectomy for 4 cm to 7 cm renal cell carcinoma: a systematic review and me-ta-analysis. BMC Urol 2019;19(1):48. https://doi.org/10.1186/sl2894-019-0480-6
- Rühle A., Andratschke N., Siva S., Guckenberger M. Is there a role for stereotactic radiotherapy in the treatment of renal cell carcinoma? Clin Transl Radiat Oncol 2019;18:104-112. https://doi.Org/10.1016/j.ctro.2019.04.012
- Haque W., Verma V., Lewis G.D., et al. Utilization of radiotherapy and stereotactic body radiation therapy for renal cell cancer in the USA. Future Oncol 2018;14(9):819-827. https://doi.org/10.2217/fon-2017-0536.
- Ali M., Mooi J., Lawrentschuk N., et al. The role of stereotactic ablative body radiotherapy in renal cell carcinoma. Eur Urol 2022;82(6):613-622. https://doi.org/10.1016/j.eururo.2022.06.017
- Siva S., Ali M., Correa R.J.M., et al. 5-year outcomes after stereotactic ablative body radiotherapy for primary renal cell carcinoma: an individual patient data meta-analysis from IROCK (the International Radiosurgery Consortium of the Kidney). Lancet Oncol 2022;23(12):1508-1516. https://doi.org/10.1016/S1470-2045(22)00656-8
- Siva S., Pham D., Krön T., et al. Stereotactic ablative body radiotherapy for inoperable primary kidney cancer: a prospective clinical trial. BJU Int 2017;120(5):623-630. https://doi.org/10.llll/bju.138U
- Siva S., Ellis R.J., Ponsky L., et al. Consensus statement from the International radiosurgery oncology consortium for kidney for primary renal cell carcinoma. Future Oncol 2016;12(5):637-45. https://doi.org/10.2217/fon.l6.2
- Grant S.R., Lei X., Hess K.R., et al. Stereotactic body radiation terapy for the definitive treatment of early stage kidney cancer: a survival comparison with surgery, tumor ablation, and observation. Adv Radiat Oncol 2020;5(3):495-502. https://doi.Org/10.1016/j.adro.2020.01.002.


