Сравнительный анализ результатов стереотаксической радиотерапии и резекции печени при солитарных метастазах рака толстой кишки в печени
Автор: Москаленко А.Н., Черных М.В., Сагайдак И.В., Малинина К.А., Магомедов М.М., Лядов В.К.
Журнал: Московский хирургический журнал @mossj
Рубрика: Онкология
Статья в выпуске: 2 (88), 2024 года.
Бесплатный доступ
Актуальность. Современный стандарт лечения при солитарных метастазах колоректального рака в печени - комбинация резекции печени и полихимиотерапии. При невозможности проведения хирургического лечения возможно применение стереотаксической радиотерапии (СРТ).Цель. Оценить результаты применения СРТ и резекции печени у пациентов с солитарными метастазами рака толстой кишки в печени.Материалы и методы. Выполнена ретро-проспективная оценка локального контроля (ЛК), общей выживаемости (ОВ), выживаемости без прогрессирования (ВБП), частоты осложнений в группах хирургического и лучевого лечения. В группу СРТ вошло 26 больных, которым проводилась СРТ с медианой дозы 54 Гр. в 3 фракции. Резекции печени были выполнены 32 пациентам. Группы не имели статистически значимых различий по основным показателям.Результаты. Медиана наблюдения составила 33,6 мес. в группе СРТ и 30,5 мес. в группе хирургического лечения (p>0,05). Токсичности 2 степени и выше не отмечено. Показатель трехлетнего ЛК в группе СРТ достиг 64,2 % (95 %ДИ = 46-89,6 %) и 72,8 % (95 %ДИ = 56,7-93,6 %) в группе хирургии (р=0,53), медиана ЛК не была достигнута. Трехлетняя ОВ в группе СРТ составила 67,9 % (95 %ДИ = 50,8-90,7 %) и 64,4 % (95 % ДИ = 44,5-93,2 %) в группе хирургического лечения (р=0,85). Трехлетняя ВБП для группы СРТ составила 5,8 % (95 %ДИ = 3,9-8,7 %) с медианой 9,2 мес. и 15,6 % (95 %ДИ = 5,9-40,8 %) в группе хирургии с медианой 16,5 мес. (р=0,44). Статистически значимых различий между СРТ и резекцией печени в ЛК и ОВ не было.Заключение. При неоперабельных солитарных метастазах рака толстой кишки в печени СРТ может обеспечить ЛК и ОВ, сопоставимые с результатами хирургического лечения, при соблюдении режима гипофракционирования и СОД ≥ 51 Гр.
Стереотаксическая радиотерапия, рак толстой кишки, олигометастатическое поражение, солитарный метастаз, резекция печени
Короткий адрес: https://sciup.org/142241731
IDR: 142241731 | УДК: 616-006.66 | DOI: 10.17238/2072-3180-2024-2-44-51
Текст научной статьи Сравнительный анализ результатов стереотаксической радиотерапии и резекции печени при солитарных метастазах рака толстой кишки в печени
Рак толстой кишки занимает 3 место (9,8 %) в структуре онкологической заболеваемости и 2 (9,2 %) место по смертности: в 2022 г. в мире выявлено более 1,85 млн пациентов и отмечено более 850 тысяч летальных исходов [1]. Отдаленные метастазы при этом заболевании диагностируют у 20–50 % пациентов, чаще всего в печени [2]. Больным с олигометастатическим поражением (1–5 метастазов в 1 или нескольких органах) показано применение комбинированного подхода к лечению, сочетающего локальные методы воздействия и проведение системной лекарственной терапии [3].
Комбинированное лечение в виде резекции печени в сочетании с системным противоопухолевым лечением позволяет достичь 5-летней общей выживаемости (ОВ) более чем у 40 % пациентов с олигометастатическим процессом и 71 % при наличии солитарного метастаза [4]. В то же время проведение радикальной резекции печени возможно лишь у 10–25 % пациентов в связи с особенностями расположения очагов, функциональным состоянием паренхимы или ее дефицитом после ранее выполненных операций, наличием тяжелых сопутствующих заболеваний [5]. В связи с этим активно развиваются различные варианты обеспечения локального контроля (ЛК) метастатических очагов в печени, одним из которых является стереотаксическая радиотерапия (СРТ). У большинства пациентов СРТ проводится в связи с невозможностью выполнения резекции печени, что делает затруднительным прямое срав- нение результатов этих методов лечения. Нами предпринята попытка сравнительной оценки онкологических результатов СРТ и резекции печени у отобранных по наиболее значимым клиническим параметрам пациентов. Учитывая ключевое значение числа опухолевых очагов для выживаемости пациентов [7], нами было принято решение оценить результаты лечения лишь у пациентов с солитарными метастазами в печени.
Материалы и методы
В ретро-проспективное исследование включено 58 пациентов с верифицированной аденокарциномой толстой кишки с солитарными синхронными или метахронными метастазами в печени. В группу лучевой терапии было включено 26 пациентов, которым проводилось лечение на базе ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (n=14) и клиники ООО «ПЭТ-Технолоджи Подольск» (n=12) в 2018–2022 гг. В группу хирургического лечения вошли 32 пациента, которым выполнялись резекции печени на базе ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (n=21) и ГБУЗ «ГКОБ1 ДЗМ» (n=11) в 2019–2020 гг.
В данное исследование были включены пациенты, прошедшие не более 2 линий ПХТ и не имевшие неконтролируемых внепеченочных метастазов. Ограничение по числу полученных линий ПХТ позволило исключить из исследования пациентов, имевших множественные эпизоды прогрессирования заболевания и, следовательно, имеющих худший прогноз по показа- телям выживаемости, с целью обеспечения сопоставимости групп сравнения.
Все больные в данном исследовании были предварительно обсуждены на междисциплинарном консилиуме. Пациенты, вошедшие в группу СРТ, были признаны неоперабельными в силу малого объема остатка печени после проведенного ранее оперативного лечения (n=17) или особенностей расположения метастатических очагов (n=9). Пациентам, соответствовавшим критериям операбельности и резектабельности, было проведено хирургическое лечение. Статистически значимых различий между группами пациентов в данном исследовании по ключевым клиническим параметрам не было (табл. 1).
Таблица 1
Основные клинико-эпидемиологические характеристики изученной группы пациентов
Patient characteristics
Table 1
|
Показатель/ Indicator |
СРТ / SBRT (n=26) |
Резекция печени / liver resection (n=32) |
p-value |
|
Пол: мужской / женский, (%) / Gender: male/female, (%) |
16/10 (61,5/38,5) |
12/20 (37,5/62,5) |
0,112 |
|
Средний возраст, лет ± стандартное отклонение (минимум-максимум) / Age, mean ± standart deviation (minimum-maximum) |
61,9±13,6 (30-84) |
63,9±8,8 (47-82) |
0,778 |
|
ECOG, n (%) |
0,891 |
||
|
0 |
1 (3,8) |
3 (9,4) |
|
|
1 |
21 (80,8) |
24 (75) |
|
|
2 |
4 (15,4) |
5 (15,6) |
|
|
Число линий ПХТ до начала лечения (%) / Сhemotherapy lines before treatment (%) |
|||
|
1 |
22 (84,6) |
21 (65,6) |
0,135 |
|
2 |
4 (15,4) |
11 (34,4) |
|
|
Т первичной опухоли (%) / T of primary tumor (%) |
|||
|
3 |
17 (65,4) |
21 (65,6) |
1 |
|
4 |
9 (34,6) |
11 (34,4) |
|
|
N первичной опухоли (%) / N of primary tumor (%) |
|||
|
0 |
10 (38,5) |
13 (40,6) |
0,839 |
|
1 |
11 (42,3) |
11 (34,4) |
|
|
2 |
5 (19,2) |
8 (25,0) |
|
|
Степень дифференцировки первичной опухоли (%) / Grаde of primary tumor (%) |
0,581 |
||
|
1 |
2 (7,7) |
5 (15,6) |
|
|
2 |
19 (73,1) |
23 (71,9) |
|
|
3 |
5 (19,2) |
4 (12,5) |
|
|
Наличие мутации в генах системы RAS (%) / RAS mutation (%) |
|||
|
нет/ no |
18 (69,2) |
18 (56,2) |
0,416 |
|
да/ yes |
8 (30,8) |
14 (43,2) |
|
|
Средний размер очага, см (минимум-максимум) / Average lesion size, sm (minimum-maximum) |
2,7±1,4 (1 – 6,5) |
3,1±1,7 (0,9-6,8) |
0,429 |
Продолжение Таблицы 1
|
Предшествовавшее локальное лечение метастаза/ов в печени, да/нет (%) / Previous local treatment of liver metastases, yes/no (%) |
15/11 (57,7/42,3) |
14/18 (43,8/56,2) |
0,428 |
|
Внепеченочные метастазы в анамнезе, да/нет (%) / Extrahepatic metastases, yes/no (%) |
7/19 (26,9 /73,1) |
10/22 (31,2/68,8) |
0,778 |
|
Синхронные / метахронные метастазы на момент дебюта болезни (%) / initially synchronous / metachronous metastases (%) |
14/12 (53,8/46,2) |
18/14 (56,3/43,7) |
0,9 |
У всех пациентов, включенных в данное исследование, первичная опухоль была удалена в объеме R0 до начала лечения метастазов.
Все больные в данном исследовании получили как минимум 1 линию ПХТ. Резекции печени на предыдущих этапах лечения проводились 15 (57,7 %) больным в группе СРТ и 14 (43,8 %) пациентам в группе хирургического лечения.
В группе СРТ внепеченочные очаги имелись у 7 (26,9 %) пациентов: у 4 больных ранее были проведены резекции легкого по поводу солитарных метастазов, у 3 пациентов отмечалась стабилизация после СРТ солитарных очагов в легком, забрюшинном лимфатическом узле, теле 5 поясничного позвонка, соответственно. В группе хирургического лечения у 10 (31,2 %) пациентов ранее были выполнены резекции легкого по поводу солитарного метастаза.
СРТ проводилась в режиме гипофракционирования с достижением СОД от 40 до 60 Гр. на очаг в 1–5 фракций с медианой 54 Гр. в 3 фракциях.
СРТ проводилась на ускорителе электронов Varian Clinac 2300 iX с применением трёхмерного планирования, многолепесткового коллиматора Milenium 120 и динамических клиновидных фильтров энергией фотонов 6 МэВ. Для исключения влияния дыхательных движений применялась технология проведения лучевой терапии с задержкой дыхания на вдохе под контролем системы RPM (Real-time Position Management). Предлучевая подготовка проводилась на спиральном компьютерном томографе GE Light Speed с последующим совмещением данных топометрической компьютерной томографии и магнитно-резонансной томографии с применением технологии Fusion для выбора объёмов облучения. Верификация плана дистанционной лучевой терапии проводилась с использованием технологии компьютерной томографии в коническом пучке и рентгеновских снимков в киловольтном пучке на ускорителе Clinac 2300iX. Укладка пациента производилась с помощью индивидуального фиксирующего средства.
Объем резекции печени определялся на основании данных предоперационного КТ или МРТ органов брюшной полости с внутривенным болюсным контрастированием и окончательно утверждался в соответствии с данными интраоперационной ревизии и интраоперационного ультразвукового исследования печени. Было выполнено 24 (75 %) атипичных резекции печени, 3 (9,3 %) сегментэктомии и 5 (15,7 %) гемигепатэктомий. У 12
(28 %) пациентов операция выполнялась лапароскопическим доступом.
Конечными точками исследования были: частота осложнений, постлучевая токсичность, ЛК, ОВ, выживаемость без прогрессирования (ВБП). После проведения локального воздействия на метастазы пациентам проводилось динамическое наблюдение: КТ или МРТ органов брюшной полости с внутривенным болюсным контрастированием 1 раз в 3 месяца. ЛК оценивался согласно критериям EORTC-RECIST 1.1[6]. Токсичность оценивалась согласно общим терминологическим критериям для нежелательных явлений (CTCAE) 5.0 [7]. Послеоперационные осложнения оценивались согласно критериям Dindo-Clavien [8].
При отсутствии прогрессирования пациентам продолжалось динамическое наблюдение, при прогрессировании проводили ПХТ, реже при олигопрогрессировании рассматривались варианты локального воздействия.
Оценка ЛК, ОВ и ВБП проведена методом Каплана-Майера. Для анализа влияния клинических факторов на ЛК, ОВ и ВБП использована модель пропорциональных рисков Кокса. Уровень значимости равнялся 0,05.
Статистическая обработка результатов проведена в программной среде R (версия 4.1.1) с использованием пакетов survival, survminer и ggplot2.
Результаты
В группе лучевой терапии у 3 (17 %) больных наблюдалась токсичность 1 степени по CTCAE 5.0, проявлявшаяся в виде тошноты и общего недомогания. Токсичности 2 степени и выше отмечено не было.
В группе хирургического лечения средняя продолжительность операции составила 197±24 минут при средней кровопотере 404±30 мл. Осложнения в послеоперационном периоде развились у 5 (15,6 %) пациентов: внутрибрюшные жидкостные скопления, потребовавшие пункционного дренирования у 4 (12,5 %) больных, раневая инфекция у 1 (3,1 %) больного. Летальности в послеоперационном периоде не было. Резекция R1 по данным гистологического исследования была выполнена у 1 (3,1%) больного.
Медиана наблюдения составила 33,6 мес. в группе лучевой терапии и 30,5 мес. в группе хирургического лечения (р>0,05).
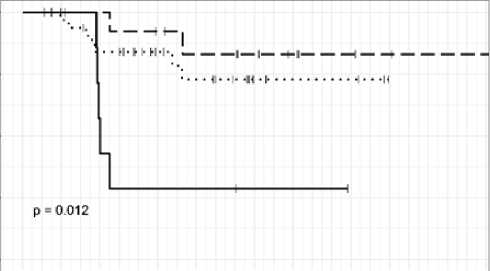
Показатель трехлетнего ЛК в группе СРТ достиг 64,2 % (95 % ДИ = 46–89,6 %) и 72,8 % (95 % ДИ = 56,7–93,6 %) в группе хирургического лечения, медиана ЛК не была достигнута, различие не было статистически значимым (р=0,53). Исходя из анализа кривых Каплана-Майера, можно отметить, что локальные рецидивы опухоли происходили на протяжении первого года после проведения лечения и уровень ЛК в обеих группах вышел на плато на втором году наблюдения. При исключении из анализа 12 пациентов, получивших СД ≤ 50 Гр, показатель ЛК в группе СРТ достигает 86,2 % (рис. 1).
1«'
— СРТ £50Гр Ч- СРТ, 251 Гр «һ Хирургия
075'
050'
0 2 4 • е 10 12 14 15 18 20 22 24 26 2« 30 32 М 36 М 40 42 *4 46 48
Орсын, месяцы
Рис. 1. Уровень ЛК при солитарных метастазах
Fig. 1. LC level in solitary metastases
Показатель трехлетней ОВ в группе СРТ составил 67,9 % (95 % ДИ = 50,8–90,7 %) и 64,4% (95 % ДИ = 44,5–93,2 %) в группе хирургического лечения. Показатель трехлетней ВБП для группы СРТ составил 5,8 % (95 % ДИ = 3,9–8,7 %) с медианой 9,2 мес. и 15,6 % (95 % ДИ = 5,9–40,8 %) в группе хирургического лечения с медианой 16,5 мес. Статистически значимых различий за период наблюдения по показателям ОВ и ВБП выявлено не было (рис. 3–4), хотя и отмечена тенденция к более раннему системному прогрессированию в группе СРТ.
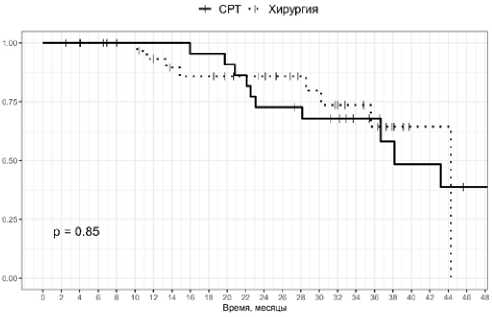
Рис. 2. ОВ для солитарных метастазов
Fig. 2. OS in solitary metastases
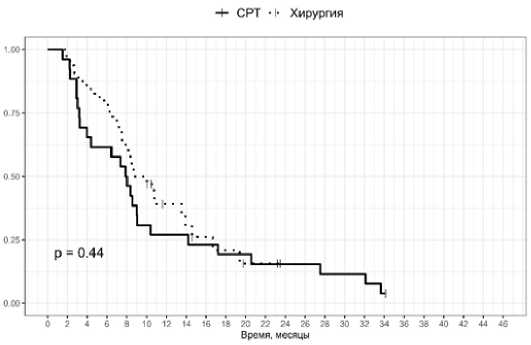
Рис. 3. ВБП для солитарных метастазов Fig. 3. DFS in solitary metastases
При проведении однофакторного анализа с целью поиска предикторов показателей ЛК, ОВ и ВБП установлено повышение вероятности нарушения ЛК у пациентов, ранее перенесших резекцию печени: ОШ 1,47 (95 % ДИ 0,65–2,268), р=0,023. Также было установлено повышение вероятности прогрессирования у пациентов с метастатическим поражением регионарных лимфатических узлов первичной опухоли (N1–2 против N0): ОШ 2,19 (95 % ДИ 1,06–4,5), р=0,03. Дальнейший многофакторный анализ не проводился в связи с отсутствием достаточного количества наблюдений.
Обсуждение
Комбинированная терапия, включающая резекцию печени и ПХТ, является наиболее эффективным лечебным подходом у больных с резектабельными и потенциально резектабельными метастазами рака толстой кишки в печени [2, 3]. При невозможности проведения хирургического лечения СРТ может применяться в качестве метода локального контроля.
Нами в 2023 г. был проведен анализ результатов применения СРТ (n=62) и резекции печени (n=83) у пациентов с олигометастазами рака толстой кишки в печени, показавший преимущество хирургического метода лечения перед лучевой терапией у данной группы больных. Показатель двухлетнего ЛК составил 62 % в группе СРТ и 80 % в группе хирургии (p=0,019), а двухлетняя OВ составила 69,5 % в группе СРТ и 84,7 % в группе хирургии (p=0,03). Однако группы исследования статистически значимо различались по числу предшествующих линий ПХТ, количеству и размерам метастазов, наличию внепеченочных метастазов [9]. Тем не менее были выявлены некоторые прогностические предикторы. Так, суммарная доза облучения ≥ 51 Гр. явилась значимым фактором улучшения ЛК, в то время как размер метастаза более 3 см служил негативным фактором для ОВ. С целью дальнейшей оценки возможностей СРТ метастазов рака толстой кишки в печени и индивидуализации показаний к ее проведению было принято решение провести сравнительный анализ данного метода и резекции печени у сопоставимых групп пациентов с солитарными метастазами колоректального рака в печени, прошедших не более 2 линий ПХТ.
В доступной нам литературе удалось найти единственное зарубежное исследование, в котором напрямую сравнивалась СРТ и резекция печени. Исследование Roman и соавт. 2019 г. [10] включало 90 больных, которые были разделены на группы хирургии (n=55) и СРТ (n=45). Анализ показал отсутствие достоверных различий в однолетней ОВ в группе СРТ (86,1 %) и хирургии (88,7 %). Однако при сроке наблюдения в 3 года ОВ в группе СРТ составила 21,2 % против 60,9 % в группе хирургии. Стоит отметить, что в данном исследовании не была выделена группа солитарных метастазов и не оценивался показатель ЛК, а также не представлены данные по различиям между группами по степени предлеченности пациентов.
Наиболее актуальный на данный момент мета-анализ за авторством Petrelli включал 18 исследований и 656 больных, которым проводилась СРТ по поводу олигометастазов колоректального рака в печени. Однолетняя ОВ составила 67 % (95 % ДИ = 42,1 – 92,2 %), медиана ОВ – 31,5 месяцев. Показатель однолетнего локального контроля составил 67 % (95 % ДИ = 43,8 –90,2 %). Частота токсических реакций 3 степени и выше по CTCAE составила 8,5 % [11]. Данные нашего исследования соответствуют этим результатам. Обращает на себя внимание, что в исследуемой нами группе пациентов не было отмечено тяжелых постлучевых реакций несмотря на высокую медиану СОД 54 Гр. в 3 фракциях.
Нами не было найдено отдельных исследований, посвященных применению СРТ при солитарных очагах в печени, однако многие авторы, включая крупное исследование Mahadevan и соавт. (213 больных), отмечают статистически значимое улучшение результатов СРТ при уменьшении числа очагов [12]. В определенной степени можно рассматривать в качестве сопоставимых по дизайну исследования, посвященные сравнению результатов радиочастотной абляции и резекции печени. Так, Meijerink и соавт. [13] в 2018 г. провели систематический обзор и мета-анализ данных 48 сравнительных исследований у пациентов с различным числом метастазов. Было показано преимущество резекции печени по выживаемости, однако у отобранной категории больных с небольшими единичными метастатическими очагами в печени при достижении А0 статуса показатели выживаемости могли быть сопоставимы с результатами хирургии.
При анализе полученных результатов обращают на себя внимание отличия нашей группы пациентов от больных, изученных в зарубежных исследованиях СРТ метастазов в печени. Так, в большинстве опубликованных работ пациенты до проведения СРТ получали несколько линий лекарственной терапии. Например, по данным Clerici и соавт., более 2 линий химиотерапии получили 55 % больных [14]. Частота предшествующего хирургического лечения в зарубежных исследованиях составляет 10–60 % против 70,6 % в нашей когорте пациентов [15]. Мы считаем, что отсутствие статистически значимых различий показателей выживаемости в нашем исследовании при достаточной медиане наблюдения (33,6 мес. в группе СРТ и 30,5 мес. в группе хирургии) может быть обусловлено именно тем, что для сравнения были отобраны сопоставимые по степени предлеченности пациенты.
За время наблюдения локальный рост опухоли после СРТ произошел у 7 пациентов. С нашей точки зрения у 5 больных это связано преимущественно с недостаточно интенсивным режимом СРТ, при котором не было достигнуто БЭД 100 Гр. Данное значение рассматривается Petrelli и соавт. в качестве порогового показателя, определяющего высокую вероятность эффективного ЛК [11]. У оставшихся 2 пациентов предикторами развития локального рецидива были размер метастаза более 3 см и наличие мутации в генах системы RAS.
В группе хирургического лечения локорегионарный рецидив за время наблюдения отмечен у 4 пациентов. У 2 из них размер метастатического очага превышал 5 см. Следует отметить, что несмотря на выполение значительной по объему резекции печени (в первом случае гемигепатэктомия справа, во втором – анатомическая резекция 2 и 3 сегментов печени) и отрицательный край резекции, расстояние от опухолевого узла до линии резекции у обоих пациентов составляло менее 5 мм. Еще у 2 пациентов, перенесших атипичные резекции 7 и 8 сегментов печени, соответственно, хирургический край резекции также составил < 1 см. У 2 из 4 пациентов также были выявлены мутации в генах системы RAS.
Очевидными недостатками нашего исследования являются его ретроспективный характер и малый объем выборки, однако мы считаем, что полученные данные все же позволяют сформировать мнение о высокой безопасности и значительной эффективности СРТ у больных с солитарными метастазами колоректального рака в печени, не подлежащих хирургическому лечению.
Заключение
При неоперабельных солитарных метастазах рака толстой кишки в печени СРТ может обеспечить показатели локального контроля и выживаемости, сопоставимые с результатами хирургического лечения, при соблюдении режима гипофракционирования и СОД ≥ 51 гр.
Список литературы Сравнительный анализ результатов стереотаксической радиотерапии и резекции печени при солитарных метастазах рака толстой кишки в печени
- Chhikara B.S. and Parang K. Global Cancer Statistics 2022: the trends projection analysis. Chemical Biology Letters, 2023, № 10, рр. 451.
- Adam R., De Gramont A., Figueras J. et al. The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus. The Oncologist, 2012, № 17, рр. 1225-1239.
- Nordlinger B., Van Cutsem E., Rougier P. et al. Does chemotherapy prior to liver resection increase the potential for cure in patients with metastatic colorectal cancer? A report from the European Colorectal Metastases Treatment Group. Eur J Cancer, 2007, № 43, рр. 2037-2045.
- Aloia T.A., Vauthey J.N., Loyer E.M. et al. Solitary colorectal liver metastasis: resection determines outcome. ArchSurg, 2006, May, № 141(5), рр. 460-466.
- Adam R., De Gramont A., Figueras J. et al. Managing synchronous liver metastases from colorectal cancer: a multidisciplinary international consensus. Cancer Treatment Reviews, 2015, № 41, рр. 729-741
- Guenther L.M., Rowe R.G., Acharya P.T. et al. Response Evaluation Criteria in Solid Tumors (RECIST) following neoadjuvant chemotherapy in osteosarcoma. Pediatr Blood Cancer, 2018, Apr; № 65(4).
- Freites-Martinez A., Santana N., Arias-Santiago S., Viera A. Using the Common Terminology Criteria for Adverse Events (CTCAE - Version 5.0) to Evaluate the Severity of Adverse Events of Anticancer Therapies. ActasDermosifiliogr (Engl Ed), 2021, Jan; № 112(1), рр. 90-92.
- ClavienP.A., BarkunJ., DindoD. TheClavien-Dindo classification of surgical complications: five-yearexperience. Ann Surg., 2009, Aug; № 250(2), рр. 187-196.
- Москаленко А.Н., Лядов В.К., Черных М.В., Сагайдак И.В., Ищанов Д.Г., Гарипов М.Р., Галкин. Сравнительный анализ применения стереотаксической лучевой терапии и хирургического лечения при олигометастазах рака толстой кишки в печени. Практическая онкология, 2023. Т. 24, № 1. С. 48-58.
- Roman J., Vávra P., Ekrtová T. Comparison of surgical intervention to Cyberknife radiotherapy in the treatment of liver malignancies. RozhlChir., 2019, № 98(10), рр. 408-413.
- Petrelli F., Comito T., Barni. SBRT for CRC liver metastases. Stereotactic body radiotherapy for colorectal cancer liver metastases: A systematic review. RadiotherOncol., 2018, Dec; № 129(3),427-434.
- Mahadevan A., Andrew M. Gaya, Rachelle Marie Lanciano. Stereotactic body radiotherapy (SBRT) for colorectal liver metastasis: Clinical outcomes from the international multi-institutional RSSearch Patient Registry. Mahadevan. Journal of ClinicalOncology, 2019, № 37, рр. 15
- Meijerink M.R., Puijk R.S., van Tilborg A.A.J.M. Radiofrequency and Microwave Ablation Compared to Systemic Chemotherapy and to Partial Hepatectomy in the Treatment of Colorectal Liver Metastases: A Systematic Review and Meta-Analysis. Cardiovasc Intervent Radiol., 2018, № 41(8), рр. 1189-1204.
- Clerici E., Comito T., Franzese C. Role of stereotactic body radiation therapy in the treatment of liver metastases: clinical results and prognostic factors. Strahlenther Onkol., 2020, Apr; № 196(4), рр. 325-333.
- Scorsetti M., Comito T., Tozzi A. Final results of a phase II trial for stereotactic body radiation therapy for patients with inoperable liver metastases from colorectal cancer. J Cancer Res Clin Oncol., 2015, Mar; № 141(3), рр. 543-553.


