Сравнительный анализ возможностей динамической контрастной (3D FFE) и время-пролетной (3D TOF) магнитно-резонансной ангиографии в диагностике аневризм и мальформаций сосудов головного мозга
Автор: Бородин О.Ю.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 3-1 т.26, 2011 года.
Бесплатный доступ
Разработка и апробация эффективной методики динамической МРангиографии с возможностью цифровой суб тракции по маске неконтрастных изображений, а также проведение сравнительного анализа диагностических возможностей 3DTOF и 4DМРА явилась целью настоящего исследования. Проведено ретроспективное исследо вание на архивных данных сочетанного использования бесконтрастной времяпролетной 3DTOF и 4D МРанги ографии для диагностики наиболее распространенных заболеваний сосудов головного мозга. По принципу од ного окна, в рамках одного магнитнорезонансного исследования показана возможность диагностики и вери фикации наиболее распространенных патологических изменений сосудов, таких как артериальные аневризмы и сосудистые мальформации.
Магнитно-резонансная ангиография, динамическая контрастная ангиография, времяпролетная ангиография, сравнительный анализ, аневризмы, мальформации
Короткий адрес: https://sciup.org/14919534
IDR: 14919534 | УДК: 616.133.33-007.64:616.145.11/.13-007-053.1]-073.755.4-073.86
Текст научной статьи Сравнительный анализ возможностей динамической контрастной (3D FFE) и время-пролетной (3D TOF) магнитно-резонансной ангиографии в диагностике аневризм и мальформаций сосудов головного мозга
Использование контрастной магнитно-резонансной ангиографии (МРА) позволяет получать высокоинформативные ангиограммы всего тела в качестве метода первичной диагностики [1]. К несомненным преимуществам метода магнитно-резонансной томографии (МРТ) следует отнести отсутствие ионизирующего излучения, высо- кий мягкотканый контраст и возможность одновременной оценки структуры и функции в области интереса. Используемые контрастные средства в диагностических дозах не обладают нефротоксичностью [2]. Это дает возможность проведения более частых динамических контрольных исследований на фоне лечения и/или после оперативного вмешательства.
Контрастная динамическая 3D магнитно-резонансная ангиография (4DМРА) головного мозга в последнее время все больше внедряется в клиническую практику для диагностики таких патологических изменений сосудов, как артерио-венозные мальформации и сосудистые аневризмы. При этом длительность одной фазы контрастной МР-ангиографии может колебаться в диапазоне от 12 до 20 с [3]. Этого достаточно, чтобы получить ангиографические изображения в артериальную фазу без заметного венозного вклада на изображении. При сравнительном анализе цифровой субтракционной ангиографии с контрастированной 4D MRA на сверхпроводящем МР-томог-рафе 1,5 тесла (8 каналов, скорость нарастания градиентов 150 Т/м/с) сходимость результатов, по данным Каппа анализа, при классификации АВМ (питающие артерии, топографическая анатомия узла, дренирующие вены) были в диапазоне от хорошей до превосходной [4]. Контрастная МР-ангиография с болюсным введением парамагнетика в сравнении с цифровой субтракционной ангиографией классифицирована, как эквивалентная в определении питающих артерий, топографической анатомии узла, а также в выявлении дренирующих вен АВМ (ретроспективно 70, 90 и 80% соответственно).
В исследовании [5] на высокопольном МР-сканере 3Т показано, что динамическое 4D МР-ангиографическое исследование значительно расширяет диагностические возможности определения всех характеристик мальформаций в сравнении с субтракционной ангиографией. Выявлена умеренная межмодальная сходимость результатов Каппа анализа в определении питающих артерий (К=0,68), а также превосходная сходимость в определении топографии (К=1,0) и дренирующих вен (К=1,0). Авторы данной работы рекомендуют 4DМР-ангиографию в качестве первичной диагностики мальформаций головного мозга. 4D-МРА способна визуализировать внутримозговые мальформации и приближена по своим возможностям к цифровой субтракционной ангиографии [6]. К сожалению, несмотря на достаточно высокое качество 3DTOF ангиограмм, использование данной техники для визуализации мальформаций головного мозга ограничено. Это связано, в первую очередь, с выраженной сатурацией области низкого потока [7].
В отношении аневризм и диагностики последствий их эмболии высказывается мнение, что контрастная МРА на сверхпроводящем магнитно-резонансном томографе с напряженностью магнитного поля 1,5 тесла предпочтительна перед цифровой субтракционной ангиографией в 91% случаев, а в 9% случаев эквивалентна ей [8].
Приведенные данные позволяют обоснованно признать метод контрастной динамической МР-ангиографии (4D МРА) методом первичной диагностики патологии сосудов всего тела, включая сосуды головного мозга. Вместе с тем, широкое распространение метода время-про-летной бесконтрастной МРА (3DTOF) и в то же время отсутствие данных сравнительного анализа диагностических возможностей 3DTOF и 4D МРА в отечественной литературе, особенно в отношении наиболее распространенных высокопольных МРТ с напряженностью магнитного поля 1,5 тесла, затрудняет внедрение метода 4D МРА в клиническую практику.
Таким образом, целью настоящей работы стало проведение сравнительного анализа методов 3DTOF и 4D магнитно-резонансной ангиографии в оценке возможности диагностики наиболее распространенных патологических состояний сосудов головного мозга.
Материал и методы
Настоящее исследование выполнено ретроспективно на архивных данных пациентов, направленных в кабинет МРТ клиник Сибирского государственного медицинского университета Томска в период с сентября 2008 по май 2011 гг. Каждое магнитно-резонансное томографическое исследование выполнено на высокопольном МРТ Excelart Vantage 1.5T (TOSHIBA, Япония). Параметры градиентной системы: напряженность градиентного поля – 30 мТ/м, скорость нарастания напряжения 50 мТ/м/мс. Использовалась квадратурная одноканальная катушка для головы с центрацией исследования на середину катушки.
В исследование включены все пациенты с направлением на контрастную МРА головного мозга в количестве 63 человек, которым кроме стандартного магнитно-резонансного исследования головного мозга, включающего Т1 и Т2 взвешенные, FLAIR и Т1 постконтрастные изображения, было выполнено ангиографическое исследование без контрастного усиления по протоколу время-про-летной 3DTOF МР-ангиографии и дополнено контрастной динамической 3D FFE МРА (4D МРА).
Бесконтрастное МР-ангиографическое исследование выполнялось по протоколу 3DTOF без контрастного усиления, с толщиной среза 1,3 мм, в аксиальной проекции перпендикулярно ходу магистральных сосудов: внутренних сонных артерий, позвоночных артерий и базилярной артерии. Использовалось 3 слаба, 6 срезов на перекрытие слабов и с общим охватом до 9,5 см. Верхний край области интереса позиционировался чуть выше уровня верхнего края мозолистого тела, а нижний край области интереса, как правило, совпадал с уровнем большого затылочного отверстия. Полученные исходные изображения ангиограмм анализировались, а также по ним строились полипроекционные реформации ангиограмм для вывода на печать.
Динамическая 3D МР-ангиография (4D МРА) головного мозга выполнялась в режиме 3D быстрого градиентного эха (3D FFE) на фоне болюсного введения гадолинийсодержащего парамагнетика в дозе 0,1 ммоль/кг веса. В качестве контрастирующих агентов использовались коммерческие гадолинийсодержащие контрастные препараты: магневист (Gd-DTPA-NMG2, концентрация 0,5 ммоль/мл), омнискан (Gd-DTPA-BMA, концентрация 0,5 ммоль/мл) и гадовист (Gd-DO3A, концентрация 1,0 ммоль/мл). Болюс парамагнетика во всех случаях дополнялся болюсом физиологического раствора (Sol. NaCl 0,9% – 20 мл). Введение парамагнетика обеспечивалось использованием двухколбного автоматического шприца инъектора Spectris Solaris EP. Скорость введения препаратов составила 1–2 мл/с.
Определение начала артериальной фазы осуществлялось с использованием опции “Visual Prepare”. Появление болюса контрастного вещества в области интереса определялось визуально, и запуск основного исследования осуществлялся вручную.
Протокол основного исследования включал в себя получение трех серий изображений быстрого 3D градиентного эха (3D FFE) толщиной одного среза до 2,2 мм с интерполяцией промежуточных срезов, поле зрения FOV=20х22,5см, матрица 160х192, размер воксела с учетом интерполяции 1,3х1,2х1,1 мм. Общая толщина 3D блока исследования составляла до 60 мм, а продолжительность одной серии не превышала 23 с. Позиционирование зависело от цели исследования. Как правило, 4D МРА выполнялось в корональной проекции через область вил-лизиевого круга с захватом внутренних сонных артерий, интракраниальных сегментов позвоночных артерий, базилярной артерии, интракавернозных сегментов обеих ВСА, а также проксимальные и средние отделы передних, средних и задних мозговых артерий. В целом исследование проходило от 35 до 60 мин в зависимости от показаний.
При МРА у каждого пациента оценивались следующие параметры:
– локализация и число аневризм;
– количество питающих мальформацию артерий;
– наличие и размер узла мальформации;
– наличие и число венозных дренажей мальформации.
Статистический анализ сходимости результатов 3DTOF и контрастной динамической 3D FFE МР-ангиог-рафии проводился с использованием Каппа анализа (Cohen, 1960; Fleiss et al., 2003). В данном случае рассчитывается коэффициент Каппа (К) в диапазоне от 0 до 1, где К=1 – характеризует наилучшую сходимость классифицируемых систем, а К=0 – характеризует отсутствие сходимости результатов лучше, чем случайная. При К<0 считается, что сходимость результатов хуже, чем случайная. Интерпретация сходимости по рассчитанному значению К проводилась следующим образом (Altman, 1991):
<0,2 – плохая, 0,21–0,4 – удовлетворительная, 0,41–0,6 – средняя, 0,61–0,8 – хорошая, 0,8–1,0 – очень хорошая.
Результаты
В данное исследование ретроспективно с использованием архивных данных было включено 63 пациента, которым были выполнены 3DTOF и 4DМРА сосудов головного мозга.
Сосудистые артериальные аневризмы были выявлены в 12 исследованиях. Сходимость результатов диагностики аневризм составила от “среднего” уровня до “хорошего” (к=0,46, 95% ДИ от 0,11 до 0,8), таблица 1.
При постановке диагноза сосудистой аневризмы достоверных различий между контрастной и бесконтраст-ной МР-ангиографией не выявлено (табл. 2). Различия наиболее ярко проявлялись в деталях, например, при использовании 4D МРА интенсивность МР-сигнала от полости аневризмы была более высокой, и отмечалась более высокая контрастность двух рядом расположенных аневризм. В то же время при 3D TOF ангиографии интенсивность от содержимого аневризмы определялась ниже интенсивности самой артерии, вероятно, за счет значительно более медленного кровотока. В двух случаях отмечалось слияние двух аневризм в одну, если они располагались на противоположных стенках одного и того же уровня артерии (рис. 1).
Сосудистые мальформации выявлены в 17 исследованиях, согласно классификации Д.Е. Мацко (1991 г.), мы распределили их на следующие группы: кавернозные гемангиомы 5, венозные ангиомы – 3, артериовенозная фистула – 1, артериовенозные мальформации 8. Капиллярные ангиомы выявлены не были. Внутримозговые гематомы чаще встречались в случае глубинного расположения мальформации (n=4), чем поверхностно (n=1). Две глубинные гематомы, визуализированные в субэпендимарных отделах, возможно, связанные с сосудистыми сплетениями боковых желудочков, не содержали в своей структуре ни артериальных, ни венозных функционирующих сосудов и были отнесены к кавернозным ангиомам.
Таблица 1
Каппа анализ выявленных признаков сосудистой патологии при 3D TOF и контрастной 3D FFE МР-ангиографии
|
3D FFE |
3D TOF |
Сходимость результатов |
|
|
Аневризмы: |
|||
|
–одна |
10 |
11 |
К=0,46±0,18, |
|
– две |
1 |
1 |
95% ДИ [0,11–0,8] |
|
– четыре |
1 |
0 |
|
|
Мальформации: |
|||
|
– артерии |
|||
|
– ни одной |
5 |
12 |
К=0,27±0,13, |
|
– одна |
12 |
4 |
95% ДИ [0,02–0,5] |
|
– две |
0 |
1 |
|
|
– размер (по Spetzler–Martin) |
|||
|
– не определено |
3 |
10 |
К=0,49±0,16, |
|
– до 3 см |
8 |
3 |
95% ДИ [0,17–0,8] |
|
– от 3 до 6 см |
4 |
3 |
|
|
– более 6 см |
2 |
1 |
|
|
– венозный дренаж |
|||
|
– нет |
3 |
15 |
К=0,03±0,02, |
|
– одна вена |
7 |
2 |
95%ДИ [(–0,02)–0,07] |
|
– более одной |
7 |
0 |
Таблица 2
|
AUC |
SE |
95% ДИ |
р |
|
|
Аневризмы (выявлено в |
12 из 63 исследований) |
|||
|
– 3D FFE |
1,0 |
0 |
0,9–1,0 |
1,0 |
|
– 3D TOF |
1,0 |
0 |
0,9–1,0 |
|
|
Мальфорации (выявлено в 17 из 63 исследований) |
||||
|
– артерии 3D FFE |
0,85 |
0,06 |
0,7–0,9 |
0,03* |
|
– артерии 3D TOF |
0,65 |
0,08 |
0,5–0,76 |
|
|
– дренаж 3D FFE |
0,91 |
0,05 |
0,8–0,97 |
0,0001* |
|
– дренаж 3D TOF |
0,56 |
0,08 |
0,4–0,7 |
|
|
– SM grade 3D FFE |
0,91 |
0,05 |
0,8–0,97 |
0,01* |
|
– SM grade 3D TOF |
0,71 |
0,08 |
0,6–0,8 |
|
Примечание: AUC – площадь под кривой чувствительностьспецифичность, SE – стандартная ошибка, ДИ – доверительный интервал, р – достигнутый уровень значимости, SM grade – грейд размера мальформации по Spetzler-Martin, * – различия значимы.
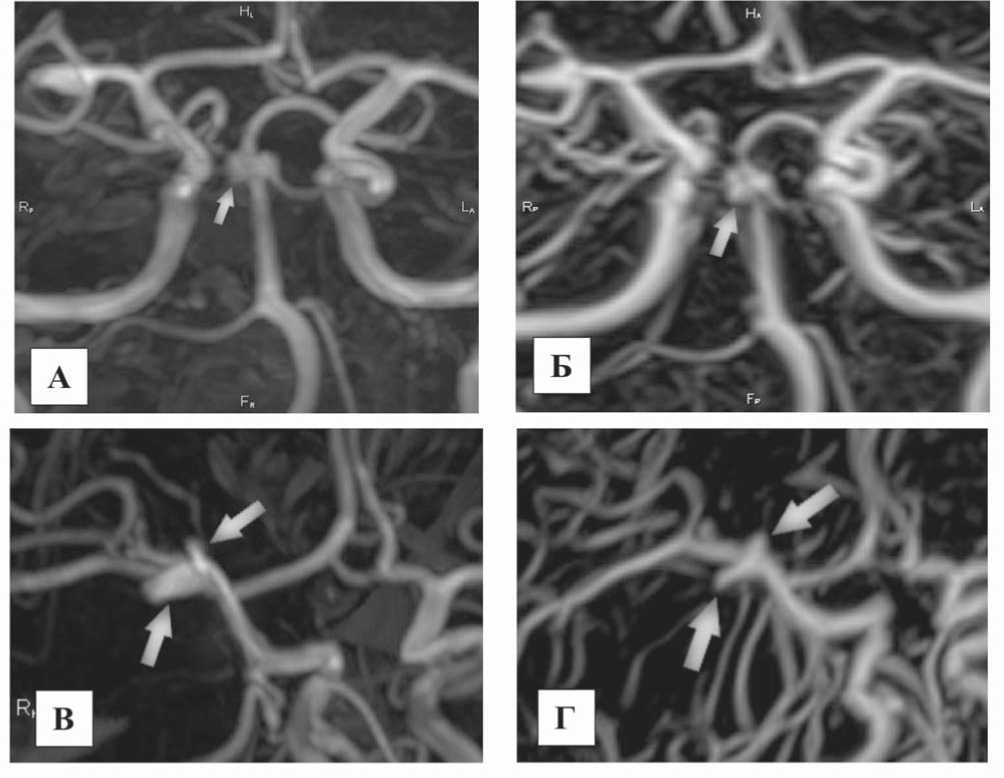
Рис. 1. МР-ангиография сосудов головного мозга, реформации проекции максимальной интенсивности (MIP): А) – 3D TOF – хорошо определяются аневризмы в области терминальных отделов базилярной артерии (белая стрелка); Б) – при 4D MRA выявленное аневризматическое расширение представлено тремя рядом расположенными аневризмами более мелкого калибра (белая стрелка); В) – в области бифуркации М1 сегмента правой средней мозговой артерии на 3D TOF ангиограммах выявлены две аневризмы (белые стрелки); Г) – при 4D МРА подтверждается наличие двух аневризм (белые стрелки)
При сравнительном Каппа анализе (табл. 1) средняя сходимость результатов отмечалась только в определении размеров мальформации (К=0,49; 95% ДИ от 0,17 до 0,8). Плохая сходимость наблюдалась в определении питающих артерий (К=0,27; 95% ДИ от 0,02 до 0,5). При анализе диагностических возможностей выявления венозного дренажа 3D TOF ангиография не позволяла его определить, тогда как 4D МРА высокоэффективно позволила оценить венозное русло мальформаций в каждом случае (К=0,03; 95% ДИ от –0,02 до 0,07).
При сравнительной оценке ROC-кривых определения характеристик сосудистых мальформаций отмечено значимое преимущество контрастной МРА по протоколу быстрого градиентного эха 3D FFE над время-пролетной 3DTOF МРА (рис. 2). Наиболее значимые различия получены в выявлении путей венозного дренажа – в случае 3D TOF оценка имела в большей степени случайный характер (табл. 2). Для бесконтрастной МР-ангиографии по 3D TOF площади под кривой (AUC) чувствительностьс-пецифичность в выявлении питающих мальформацию артерий (AUC=65%), а также в определении размера
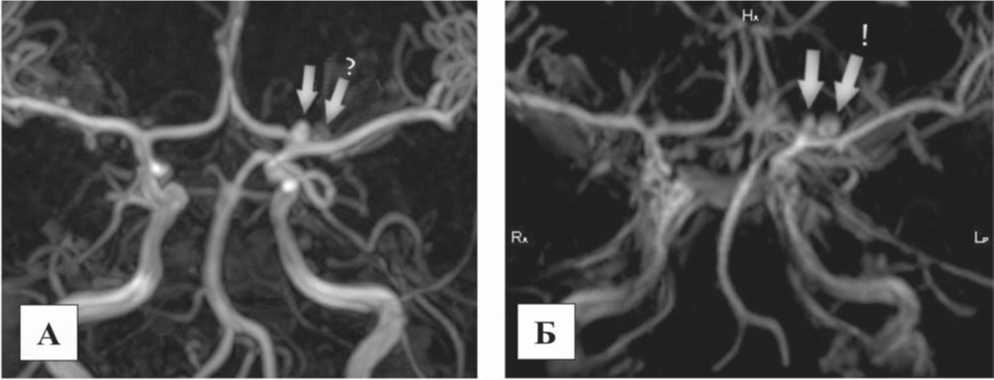
Рис. 2. МР-ангиография сосудов головного мозга, MIP реформации: А) – 3DTOF ангиография, Б) – 4D МР-ангиография
(AUC=71%) оказались достаточно велики для постановки диагноза мальформации, однако значимо отличались от аналогичных характеристик для динамической 3D градиентное эхо МР-ангиогра-фии (AUC в диапазоне от 85 до 91%).
По данным 3D TOF (А) в области бифуркации левой внутренней сонной артерии четко определяется аневризма с хорошим кровотоком в ней, с достаточно высокой контрастностью по отношению к окружающим тканям. Чуть дистальнее определяется еще одна аневризма с достаточно узкой шейкой, в результате чего в ее полости кровоток достаточно низкий и отношение сигнал-шум заметно ниже, чем у первой аневризмы (белые стрелки). В случае контрастной 4D МРА (Б) отношение сигналшум визуально между аневризмами не отличается. Оценивая сочетание результатов бесконтрастной и контрастной МР-ангиографии, можно обоснованно заключить, что первая аневризма обладает высоким внутренним кровотоком, а вторая аневризма достаточно низким. По данным контрастной МР-ангиографии, шейки обеих аневризм узкие, тогда как при бесконтрастной МР-ан-гиографии шейка первой аневризмы широкая.
Обсуждение
80 100
100%-Специфичность
Высокая значимость динамической контрастной МР-ангиографии в диагностике заболеваний периферической сосудистой системы не вызывает сомнения. 3D TOF без контрастного усиления в диагностике заболеваний сосудов головного мозга методами магнитно-резонансной томографии
является бесспорным лидером [9], т.к. позволяет достаточно просто и с высоким пространственным разрешением в течение 10–15 мин получить изолированное изображение всех артериальных сосудов головного мозга. Следует обратить внимание, что качество получаемых изображений сосудов зависит от скорости потока и степени его турбулентности, что заметно сказывается на результатах. При снижении кровотока и при сильных изги-
--- Питающие артерии (3DFFE)
-— Питающие артерии (3DTOF)
........ Дренирующие вены (3DFFE)
----- Дренирующие вены (3DTOF)
------ Размер по Spetzler-Martin (3DFFE) --- Размер по Spetzler-Martin (3DTOF)
Рис. 3. ROC-анализ чувствительности и специфичности выявляемых признаков мальформации по Spetzler-Martin. Отмечается значимое различие диагностических возможностей 3D TOF и 4D МР-ангиографии визуализации мальформаций сосудов головного мозга бах сосуда МР-сигнал может искажаться или пропадать, что создает неопределенность для исследователя в постановке правильного диагноза следующего вида: если выявлены патологические изменения просвета сосуда, значит ли, что они есть на самом деле, равно как и отсутствие патологических изменений дает ли гарантию их отсутствия? В последнее время предлагается использовать внутривенное контрастное усиление в стандартной дозе
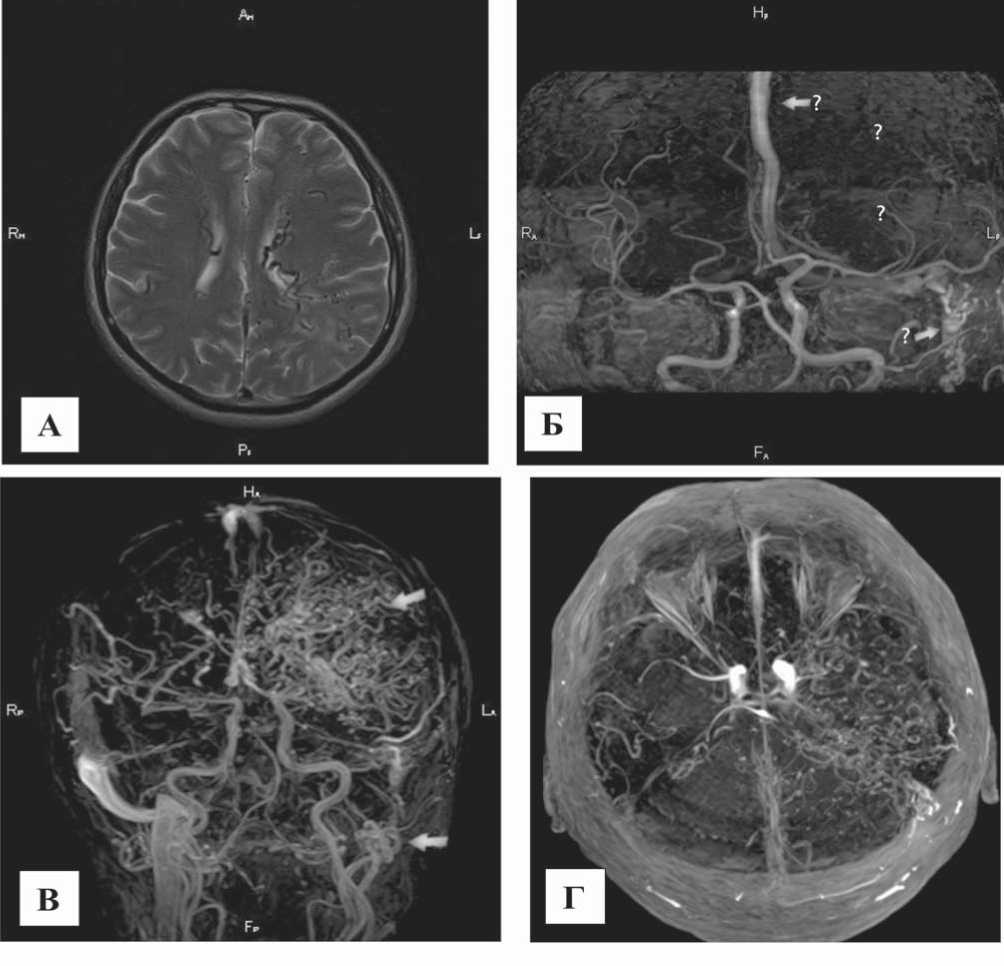
Рис. 4. МР-ангиографическое исследование сосудов пациента К., 52 г. А) Т2 взвешенное изображение, видны множественные извитые гипоинтенсивные сосудистые структуры преимущественно в перивентрикулярных отделах левого полушария. Б) 3D TOF – отмечается визуализация измененного левого сигмовидного и поперечного синуса с переходом на верхний сагиттальный синус. Обеднение сосудистого рисунка в бассейне левой СМА. В) и Г) 4D МР-ангиография артериальная и поздняя венозная фазы. Поперечные синусы, задние отделы верхнего сагиттального синуса и прямой синус не попали в область интереса. Хорошо определяется сосудистая венозная сеть мальформации. Вдоль левой внутренней яремной вены видна еще одна АВ-мальформа-ция, шунтирующая артериальную кровь в венозную сеть левого полушария (белые стрелки). Это объясняет визуализацию верхнего сагиттального синуса при 3D TOF, несмотря на его пресатурацию за счет ретроградного кровотока. Венозный сброс из мальформации осуществляется в правую внутреннюю яремную вену через глубокие вены
для улучшения визуализации сосудистых структур головного мозга с медленным кровотоком при остром нарушении мозгового кровообращения [10]. Техника быстрого градиентного эха является в большей степени Т1 взвешенной и поэтому на постконтрастных МР-ангиограм-мах происходит выраженное обогащение сосудистого рисунка, причем в большей степени за счет венозных сосудов и венозных синусов с медленным кровотоком [11]. К сожалению, задача заметно осложняется при наличии внутримозговой гематомы, т.к. окисленная форма гемоглобина – метгемоглобин обладает парамагнитными свойствами, и на фоне гематомы, а также вблизи от нее выявить патологически измененные сосуды и аневризмы на практике представляется достаточно сложным. Также необходимо помнить о большой длительности сбора данных при время-пролетной МР-ангиграфии, что не позволяет оценить гемодинамику мальформации в отличие от селективной и суперселективной цифровой субтракционной ангиографии, особенно в ситуации “скорой помощи” и при дефиците времени.
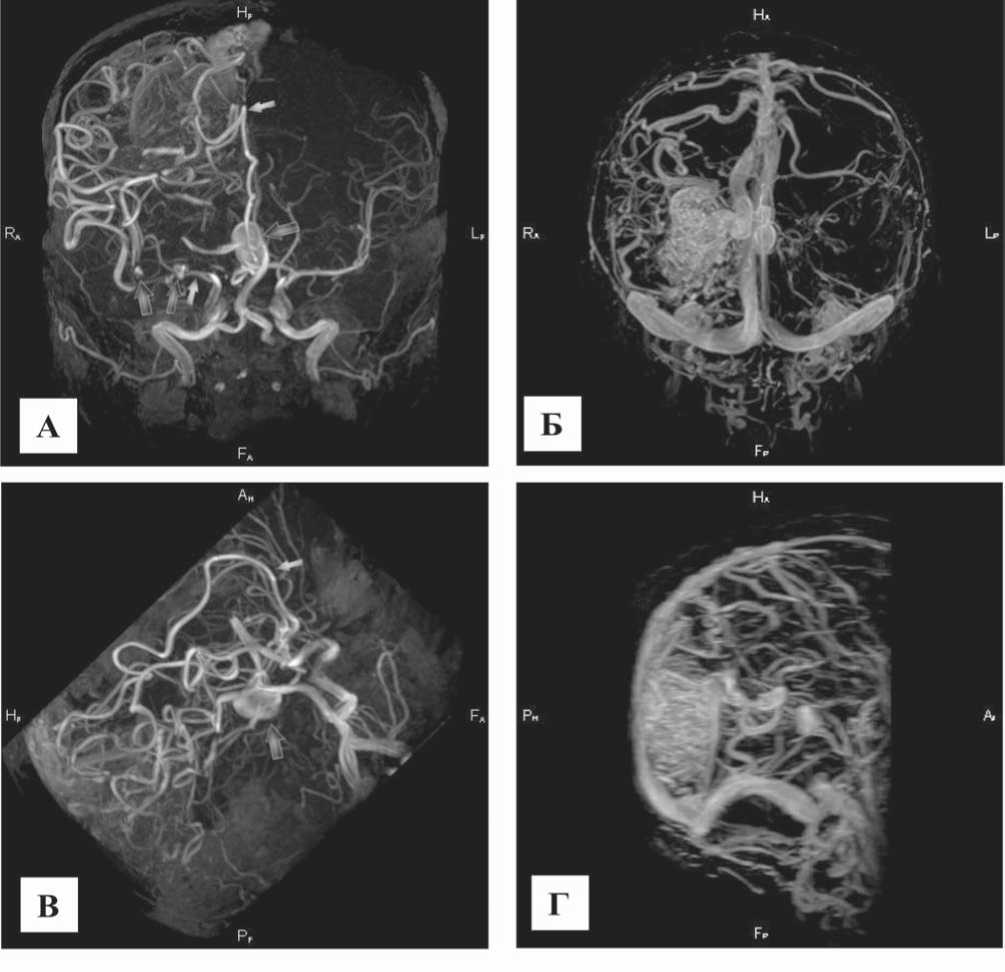
Рис. 5. МР-ангиография сосудов головного мозга пациентки К., 49 л: А) и В) 3D TOF в корональной и боковой проекции. Кровоснабжение мальформации правой затылочной области осуществляется из бассейна правой СМА и правой ПМА (белые стрелки), гигантская аневризма бифуркации базилярной артерии и более мелкого калибра аневризмы по ходу правой средней мозговой артерии (темные стрелки); Б) и Г) 4D МР-ангиография – венозная фаза – хорошо определяется анатомия мальформации и венозный отток в поверхностные и глубокие вены
Поэтому разработка и апробация эффективной методики динамической МРА с возможностью цифровой субтракции по маске неконтрастных изображений, а также проведение сравнительного анализа диагностических возможностей 3D TOF и 4D-МРА стали одной из задач настоящего исследования.
Проведено ретроспективное исследование на архивных данных сочетанного использования бесконтраст-ной время-пролетной 3D TOF и 4D МР-ангиографии для диагностики наиболее распространенных заболеваний сосудов головного мозга. По принципу “одного окна”, в рамках одного магнитно-резонансного исследования показана возможность диагностики и верификации наи- более распространенных патологических изменений сосудов, таких как артериальные аневризмы и сосудистые мальформации.
Параметры чувствительности и специфичности (100% и 100%) в диагностике аневризм методом 3D TOF достоверно не отличались от таковых при 4D МРА. Установлены деликатные отличия при детализации числа аневризм в случае их близкого расположения друг к другу в пользу контрастной МР-ангиографии, которая, несмотря на меньшее пространственное разрешение, в артериальную фазу позволяет их дифференцировать раздельно (к=0,45; 95% ДИ от 0,11 до 0,8). На рисунке 1 видно, что, по данным 3D TOF ангиографии, имеются аневризмы в облас- ти бифуркации базилярной артерии и бифуркации М1 сегмента правой средней мозговой артерии. При контрастной МР-ангиографии выявленные изменения детализируются лучше за счет большей контрастности рядом расположенных аневризм. На рисунке 2 представлен случай выявления и верификации аневризм М1 сегмента левой средней мозговой артерии. Дистальная аневризма визуализирована с большим значением отношения сиг-налшум при 4D МРА в артериальную фазу, чем при 3D TOF.
В то же время при определении характеристик рент-генсемиотики мальформаций выявлены существенные различия диагностических возможностей между 3D TOF и контрастной 4D МРА: 1) визуализация питающих артерий – отмечено значимое различие чувствительности 29,4 и 70,6% соответственно (p<0,001); 2) в определении размера мальформации чувствительность составила 41,2 и 82,4% соответственно (p<0,05); 3) в определении венозного дренажа чувствительность оказалась 11,8 и 82,4% соответственно (p<0,001). При ROC-анализе выявлены высокие значения площади под кривой чувствительно-стьспецифичность (AUC) для контрастной 3D FFE МР-ангиографии: определение питающих артерий – AUC=85%, определение размера мальформации и венозного дренажа AUC=91% (рис. 3).
Необходимо отметить, что в ряде случаев (рис. 4 и 5) только при бесконтрастной время-пролетной МР-анги-ографии удавалось определить питающие мальформацию артерии, тогда как при контрастной 3D FFE ангиографии хорошо визуализировался сосудистый клубок и дренирующие венозные сосуды.
Такой парадокс, вероятнее всего, связан с особенностями гемодинамики артериовенозной мальформации, когда происходит шунтирование крови и время транзита болюса через мальформацию сокращается до 0,5–1,0 с. Это может затруднять визуализацию артерий при времени сканирования одной фазы в 23 секунды. Данная ситуация эффективно решается путем использования высокопольной МРТ с напряженностью магнитного поля 3Тес-ла, а также сокращением времени сканирования одной фазы до 1,7 секунды на каждую фазу с использованием техник, ускоряющих время сбора данных (CENTRA, SENSE и др.) [12–20]. С другой стороны, комбинация бесконтра-стной время-пролетной 3D TOF и контрастной 4D МРА, как в нашем случае, позволяет адекватно оценить все параметры мальформации даже в случае артериовенозного шунтирования.
Выводы
-
1. Сочетание диагностических возможностей бесконт-растной 3D TOF и контрастной 4D МР-ангиографии при визуализации аневризм сосудов головного мозга может быть эквивалентным дигитальной субтракционной ангиографии головного мозга и применяться не только для диагностики, но и для неинвазивного наблюдения эффективности их эмболизации.
-
2. Использование бесконтрастной время-пролетной 3D TOF МРА является эффективным методом исследования в случае диагностики аневризм артерий голов-
- ного мозга. В данном случае контрастную динамическую 3D FFE МРА целесообразно использовать для верификации выявленных аневризм, детализации их топографии, определения гемодинамических характеристик, а также для исключения ложноположительных и ложноотрицательных результатов по принципу “одного окна” в рамках одного МРА исследования. 3. При диагностике мальформаций сосудов головного
мозга бесконтрастная МР-ангиография эффективна в качестве скринингового метода первичного исследования, а также при определении питающих артерий в случае преимущественно артериальной АВ-мальформации. При смешанной и преимущественно венозной сосудистой мальформации наиболее информативным методом диагностики является динамическая 3D быстрого градиентного эха (3D FFE) МР-ангиография в динамическом режиме с временным разрешением 20–23 с.
Заключение
Полученные выводы позволяют отнести динамическую контрастную МР-ангиографию по протоколу 3D градиентного эха (3D FFE) к высокоинформативным методам диагностики, наиболее полно отвечающим на вопросы о состоянии артериального и венозного русла в области интереса. Широкое применение методики позволяет за счет незначительного удорожания магнитно-резонансного исследования наиболее полно выполнить сосудистое исследование головного мозга, по принципу “одного окна” исключить или подтвердить сосудистую патологию в рамках одного исследования. Это, безусловно, сокращает продолжительность диагностического этапа и обеспечивает более ранний переход к началу лечебного процесса. Немаловажно исключение из диагностического процесса фактора ионизирующего излучения и выполнения минимально инвазивных процедур, а также необходимости введения достаточно большой дозы йодных контрастных препаратов. Тем самым можно добиться заметного снижения возможных побочных эффектов и сокращения сроков госпитализации, а также перевода субтракционной ангиографии из лечебно-диагностической процедуры в лечебную.
Особую роль во внедрении методики 4D-МРА играет наличие доступных современных высокоэффективных парамагнитных контрастных средств. К сожалению, их цена весьма высока. Кроме того, на российском рынке отсутствуют отечественные контрастные препараты парамагнетики для магнитно-резонансной томографии. Появление отечественных конкурентноспособных эффективных контрастных средств заметно повысило бы доступность не только обычных контрастных исследований по показаниям, но и возможность более широкого внедрения динамической контрастной 4DМРА, в том числе области головного мозга.
Список литературы Сравнительный анализ возможностей динамической контрастной (3D FFE) и время-пролетной (3D TOF) магнитно-резонансной ангиографии в диагностике аневризм и мальформаций сосудов головного мозга
- Goyen M., Herborn C.U., Krцger K. et al. Detection of atherosclerosis: systemic imaging for systemic disease with wholebody threedimensional MR angiography -initial experience//Radiology. -2003. -No. 227. -P. 277-282.
- Shellock F.G., Kanal E. Safety of magnetic resonance imaging contrast agents//J. Magn. Reson. Imaging. -1999. -No. 10(3). -P. 477-484.
- Isoda H., Takehara Y., Isogai S. et al. Softwaretriggered contrast enhanced threedimensional MR angiography of the intracranial arteries//Am. J. Radiol. -2000. -No. 174. -P. 371-375.
- Farb R.I., McGregor C., Kim J.K. et al. Intracranial arteriovenous malformations: realtime autotriggered elliptic centricordered 3D gadoliniumenhanced MR angiography -initial assessment//Radiology. -2001. -Vol. 220, No. 1. -P. 244-251.
- Nishimuraa S., Hiraia T., Sasaoa A. et al. Evaluation of dural arteriovenous fistulas with 4D contrastenhanced MR angiography at 3T//Am. J. Neuroradiol. -2010(1). -No. 31. -P. 80-85.
- Eddleman C.S., Jeong H.J., Hurley M.C. et al. 4D Radial Acquisition ContrastEnhanced MR Angiography and Intracranial Arteriovenous Malformations//Stroke. -2009. -No. 40. -P. 2749.
- Ozsarlak O., Van Goethem J.W., Maes M. et al. MR angiography of the intracranial vessels: technical aspects and clinical applications//Neuroradiology. -2004(12). -No. 46. -P. 955-972.
- Agida R., Willinskya R.A., Leea S.K. et al. Characterization of Aneurysm Remnants after Endovascular Treatment: Contrast Enhanced MR Angiography versus Catheter Digital Subtraction Angiography//American Journal of Neuroradiology. -2008(9). -No. 29. -P. 1570-1574.
- Sadikin C., Teng M.M., Chen T.Y. et al. The current role of 1.5T noncontrast 3D timeofflight magnetic resonance angiography to detect intracranial stenoocclusive disease//J. Formos Med. Assoc. -2007(9). -No. 106. -P. 691-699.
- Ishimarua H., Ochic M., Morikawad M. et al. Accuracy of pre and postcontrast 3D timeofflight MR angiography in patients with acute ischemic stroke: correlation with catheter angiography//Am. J. Neuroradiol. -2007(5). -No. 28. -P. 923-926.
- Pedraza S., Silva Y., Mendez J. et al. Comparison of preperfusion and postperfusion magnetic resonance angiography in acute stroke//Stroke. -2004. -No. 35. -P. 2105-2110.
- Duran M., Schoenberg S.O., Yuh W.T. et al. Cerebral arteriovenous malformations: Morphologic evaluation by ultrashort 3D gadoliniumenhanced MR angiography//Eur. Radiol. -2002. -No. 12. -Р. 2957-2964.
- Farb R.I., McGregor C., Kim J.K. et al. Intracranial arteriovenous malformations: Realtime autotriggered elliptic centricordered 3D gadoliniumenhanced MR angiography-initial assessment//Radiology. -2001. -No. 220. -Р. 244-251.
- Gauvrit J.Y., Leclerc X., Oppenheim C. et al. Threedimensional dynamic MR digital subtraction angiography using sensitivity encoding for the evaluation of intracranial arteriovenous malformations: A preliminary study.//Am. J. Neuroradiol. -2005. -No. 26. -Р. 1525-1531.
- Ozsarlak O., Van Goethem J.W., Maes M. et al. MR angiography of the intracranial vessels: technical aspects and clinical applications//Neuroradiology. -2004. -No. 46. -Р. 955-972.
- Tsuchiya K., Katase S., Yoshino A. et al. MR digital subtraction angiography of cerebral arteriovenous malformations//Am. J. Neuroradiol. -2000. -No. 21. -Р. 707-711.
- Gauvrit J.Y., Oppenheim C., Nataf F. et al. Threedimensional dynamic magnetic resonance angiography for the evaluation of radiosurgically treated cerebral arteriovenous malformations//Eur. Radiol. -2006. -No. 16. -Р. 583-591.
- Summers P.E., Kollias S.S., Valavanis A. Resolution improvement in thickslab magnetic resonance digital subtraction angiography using SENSE at 3T//J. Magn. Reson. Imaging. -2004. -No. 20. -Р. 662-673.
- Taschner C.A., Gieseke J., Le Thuc V. et al. Intracranial arteriovenous malformation: timeresolved contrastenhanced MR angiography with combination of parallel imaging, keyhole acquisition, and Kspace sampling techniques at 1.5T//Radiology. -2008. -No. 246. -Р. 871-879.
- Tsuchiya K., Aoki C., Fujikawa A. et al. Threedimensional MR digital subtraction angiography using parallel imaging and keyhole data sampling in cerebrovascular diseases: Initial experience//Eur. Radiol. -2004. -No. 14. -Р. 1494-1497.


