Сравнительный ретроспективный анализ результатов бедренно-подколенного шунтирования и стентирования плетеным биомиметическим стентом у пациентов с пролонгированными окклюзиями артерий бедренно-подколенного сегмента
Автор: Гостев А.А., Осипова О.С., Бугуров С.В., Саая Ш.Б., Рабцун А.А., Чебан А.В., Игнатенко П.В., Карпенко А.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.37, 2022 года.
Бесплатный доступ
Введение. При пролонгированных окклюзионных поражениях артерий бедренно-подколенного сегмента золотым стандартом считается аутовенозное шунтирование. Однако не всегда вена анатомически пригодна для шунтирования, может быть уже ранее использована при предыдущих операциях (например, при аортокоронарном шунтировании). Обычные «резаные» нитиноловые стенты показывают неудовлетворительные результаты в бедренно-подколенной позиции в связи с высоким процентом реокклюзий, связанных с их поломками при физиологических движениях в суставах. Модифицированный способ изготовления стентов путем плетения из проволоки позволяет улучшить их биомиметические свойства и снизить процент поломок, а соответственно, и реокклюзий.Цель исследования: сравнение 2 методов хирургического лечения - открытого бедренно-подколенного шунтирования (БПШ) и эндоваскулярной реканализации со стентированием с использованием плетеного биомиметического нитинолового стента при симптомных пролонгированных окклюзионных поражениях артерий бедренно-подколенного сегмента.Материал и методы. В ретроспективный анализ были первоначально включены данные 437 пациентов с пролонгированным атеросклеротическим окклюзионным поражением бедренно-подколенного сегмента (>20 см). В сформированных для исследования 2 группах (группе шунтирования и группе эндоваскулярного вмешательства) методом псевдорандомизации (Propensity score matching) выполнено выравнивание по ряду конфаундеров с целью исключения их влияния на результаты исследования.Результаты. Первичная и вторичная проходимость в течение 2 лет были сопоставимы в группах. В подгруппе «вмешательства выше коленного сустава» 2-летняя вторичная проходимость была значимо выше в группе эндоваскулярного вмешательства, чем в группе шунтирования (90,9 против 77,5%, p = 0,048). В подгруппе «вмешательства ниже коленного сустава» 2-летняя первичная проходимость была значимо выше в группе эндоваскулярного вмешательства, чем в группе шунтирования искусственным протезом из политетрафторэтилена (ПТФЭ) (66,7 против 42,4%, p = 0,046). Аутовенозный шунт показал лучшие результаты первичной проходимости по сравнению с группой эндоваскулярного вмешательства, однако разница статистически не значима (77,2 против 66,7% соответственно, р = 0,3).Заключение. Первичная эндоваскулярная стратегия может быть рекомендована для всех пролонгированных окклюзионных поражений бедренно-подколенного сегмента выше щели коленного сустава. При поражениях ниже щели коленного сустава операцией выбора остается аутовенозное шунтирование, однако при отсутствии подходящего аутовенозного трансплантата стоит также рекомендовать первичную эндоваскулярную стратегию. Требуются дополнительные крупные многоцентровые рандомизированные исследования для уточнения данных рекомендаций.
Хроническая ишемия нижних конечностей, плетеный биомиметический нитиноловый стент, атеросклероз, эндоваскулярное лечение, бедренно-подколенное шунтирование
Короткий адрес: https://sciup.org/149140024
IDR: 149140024 | УДК: 616.137.83/.86-089.86:615.472.5.032.13]-089.168
Текст научной статьи Сравнительный ретроспективный анализ результатов бедренно-подколенного шунтирования и стентирования плетеным биомиметическим стентом у пациентов с пролонгированными окклюзиями артерий бедренно-подколенного сегмента
Выбор того или иного вида оперативного вмешательства регламентируется рекомендациями. Согласно документу TASC (Transatlantic Inter-Society Consensus – Трансатлантический консенсус по лечению атеросклероза артерий нижних конечностей), при длинных поражениях артерий бедренно-подколенного сегмента более 15 см операцией выбора является аутовенозное шунтирование, несмотря на более высокую травматичность по сравнению со стентированием [1, 2]. Однако, согласно последним Российским [3] и Европейским [4] рекомендациям по заболеванию периферических артерий, в настоящее время предлагается использовать эндоваскулярную стратегию для всех поражений короче 25 см.
Проведенное недавно исследование, где авторы изучали эффективность стентирования длинных поражений (200 мм и более) бедренно-подколенного сегмента обычными «резаными» нитиноловыми стентами, показало неудовлетворительные показатели (43,4%) проходимости стентированного сегмента в течение 2 лет [5]. В основном это связано с тем, что стенты, установленные в бедренно-подколенную область, подвергаются выраженной деформации и поломкам при физиологических сгибаниях и разгибаниях тазобедренного и коленного суставов. Деформации и поломки стентов ведут к рестенозам или тромбозам. Так, по данным ряда авторов, 2-летняя частота поломок стентов в поверхностной бедренной артерии колеблется от 15 до 46% [5, 6], а частота рестенозов и окклюзий – от 21,8 до 53,3% [7]. Одним из возможных решений проблемы поломок стентов в бедренно-подколенной позиции является модифицированный способ их изготовления путем плетения из нитиноловой проволоки.
Плетеные нитиноловые стенты продемонстрировали удовлетворительные результаты при имплантации в бедренно-подколенные артерии. Пилотные 2-летние исследования с плетеными стентами показали их устойчивость к поломкам в бедренно-подколенной позиции, при этом частота рестенозов наблюдалась у 27,2% больных [8]. Опубликованные зарубежными авторами результаты эффективности подобной процедуры в течение 12 мес. при средней длине поражения 78,1 мм продемонстрировали обнадеживающие результаты (первичная 12-месячная проходимость составила 78,9%) [9]. Этот факт доказывает необходимость проведения сравнительного исследования при длинных окклюзионных поражениях бедренно-подколенного сегмента с применением плетеного нитинолового стента, лишенного некоторых недостатков резаных стентов (как описано выше), что позволит улуч- шить эффективность данной процедуры как в раннем, так и в отдаленном послеоперационном периоде.
Мы провели ретроспективный сравнительный анализ результатов бедренно-подколенного шунтирования (БПШ) и стентирования артерий бедренно-подколенного сегмента плетеными нитиноловыми стентами у пациентов с пролонгированными окклюзионными поражениями бедренно-подколенного сегмента.
Материал и методы
Дизайн исследования
В ретроспективный анализ были включены пациенты, которым было выполнено БПШ или стентирование биомиметическим плетеным нитиноловым стентом в связи с симптомным пролонгированным (>20 см) окклюзионным поражением бедренно-подколенного сегмента. Анализ данных пациентов проводился в 2 группах в зависимости от времени наблюдения: не менее 1 года наблюдения и не менее 2 лет наблюдения. Первичные конечные точки включали первичную проходимость, первично-асси-стированную проходимость и вторичную проходимость. Вторичные конечные точки включали значимые неблагоприятные сердечно-сосудистые события (MACE), значимые неблагоприятные события на конечностях (MALE), снижение ишемии конечности не менее чем на 1 категорию по классификации R.B. Rutherford (общепринятая за рубежом классификация хронической ишемии нижних конечностей (ХИНК), в которой категория 3 соответствует стадии 2Б, категория 4 – стадии 3, категория 5, 6 – стадии 4 по классификации А.В. Покровского) и выживаемость.
Отбор пациентов и сбор данных
Все пациенты, включенные в анализ, проходили лечение в нашем медицинском исследовательском центре с января 2012 г. по апрель 2020 г. Демографические данные, предоперационные характеристики, периоперационные исходы и данные последующего наблюдения (включая все медицинские записи и диагностические процедуры) были проспективно собраны в специальной базе данных. Все пациенты прошли предоперационную оценку периферических артерий и физикальное обследование в соответствии с клиническими рекомендациями [3, 10].
Критерии включения: возраст > 18 лет; информированное согласие, тяжелая перемежающаяся хромота (дистанция безболевой ходьбы < 200 м) или критическая ишемия, угрожающая конечностям, включая боль в покое и ишемические поражения (категории 3–6 по классификации R.B. Rutherford); атеросклеротическое пролонгиро- ванное бедренно-подколенное окклюзионное поражение, подтвержденное с помощью компьютерной томографии или артериографии, выполненное эндоваскулярное лечение – стентирование бедренно-подколенного сегмента с использованием плетеного нитинолового стента SUPERA (Abbott, Миннесота, США) или открытое оперативное лечение – БПШ; поражение артерий бедренно-подколеного сегмента de novo; наличие не менее одной берцовой проходимой артерии.
Стентирование бедренно-подколенного сегмента выполнялось у пациентов, у которых после выполненной реканализации и ангиопластики был остаточный стеноз > 50% и/или диссекция интимы с лимитацией кровотока. Диаметр стента выбирался исходя из того, что диаметр предилатационного баллона был на 1 мм больше внутреннего диаметра стента. Выбор типа шунтирования (аутовенозный или синтетический протез) зависел от оператора. Трансплантат из политетрафторэтилена (ПТФЭ) использовался в случае недостаточного диаметра (<3 мм), варикозной трансформации или отсутствия большой подкожной вены (БПВ). Расположение дистального анастомоза зависело от дистальной границы окклюзии бедренно-подколенного сегмента. Все операторы были квалифицированными сердечно-сосудистыми и рентгенэндоваскулярными хирургами. Все устройства использовались в соответствии с инструкциями производителя по применению.
Критерии исключения: вмешательство по поводу острой ишемии конечностей, предшествующее бедренно-подколенное стентирование или шунтирование, предшествующее хирургическое лечение аорты и/или ипсилатеральных подвздошных артерий, нарушения гемостаза и тяжелые сопутствующие заболевания с ожидаемой продолжительностью жизни менее 2 лет.
В послеоперационном периоде пациенты, перенесшие шунтирование, ежедневно получали 75 мг ацетилсалициловой кислоты и профилактические дозы низкомолекулярного гепарина в течение 3 дней. Пациенты, перенесшие стентирование, получали двойную анти-тромбоцитарную терапию (75 мг аспирина + 75 мг клопи-догреля) не менее 2 мес.
Последующая оценка проходимости прооперированной конечности включала оценку симптомов, физикальное обследование и регулярное ультразвуковое исследование или компьютерную ангиографию через 3, 6, 12 мес., а затем ежегодно. Пациенты с ухудшением клинических симптомов или неудовлетворительными результатами физикального и инструментального обследования были дополнительно осмотрены и консультированы сосудистым хирургом с определением типа повторного вмешательства, которое необходимо выполнить.
Определение понятий
Рестеноз считался гемодинамически значимым при повышении линейной скорости кровотока более 2 м/с, измеренной с помощью дуплексной визуализации, или при уменьшении диаметра сосуда не менее чем на 50%.
Первичная проходимость определялась как отсутствие окклюзии или рестеноза оперированного сегмента, включая области на 1 см проксимальнее и 1 см дистальнее анастомоза или стента. Первично-ассистированная проходимость определялась как вторичная процедура, выполняемая для предупреждения реокклюзии оперированного сегмента (т. е. при наличии гемодинамически значимого рестеноза в еще проходимом сегменте стента или шунта, включая анастомозы). Вторичная проходимость определялась как вторичная процедура, выполняемая при окклюзии шунта или стента.
Статистический анализ
Метод псевдорандомизации (Рropensity score matching) применялся в соотношении 1:3 (эндоваскулярное стентирование/БПШ), как это было описано ранее [11]. Выравнивание групп проводилось на основе модели логистической регрессии для сопоставимости данных пациентов по следующим показателям: возраст, пол, атеросклеротическое поражение русла оттока, категория ХИНК по классификации R.B. Rutherford, курение, ишемическая болезнь сердца, гипертоническая болезнь, хроническая сердечная недостаточность, почечная недостаточность, дислипидемия, сахарный диабет, рост, вес, индекс массы тела, площадь поверхности тела, окклюзия передней большеберцовой артерии, окклюзия задней большеберцовой артерии, окклюзия малой берцовой артерии, значимое поражение общей бедренной артерии, значимое поражение глубокой бедренной артерии, проходимость третьей порции подколенной артерии. Для проверки нормальности распределения количественных данных использовался W-критерий Шапиро – Уилка. Нормально распределенные количественные данные представлены как среднее значение ± стандартное отклонение, данные, не имевшие нормального распределения, – как медиана и межквартильный интервал. Значимость различий между группами определялась с помощью U-критерия Манна – Уитни и точного двустороннего F-критерия Фишера. Первичная проходимость, первично-ассистированная, вторичная проходимость были дополнительно проанализированы с использованием метода Каплана – Мейера, при этом межгрупповые различия оценивались с помощью лог-рангового теста. Отношения рисков (ОР) были рассчитаны с использованием регрессионной модели пропорциональных рисков Кокса и представлены с их 95% ДИ. Весь анализ был выполнен с использованием программы STATISTICA 12 (StatSoft, США). Применялся 5%-й пороговый уровень значимости результатов.
Результаты
Всего в исследование были включены 437 пациентов (294 пациента – группа БПШ, 143 пациента – группа эндоваскулярной хирургии (ЭВХ)). После псевдорандомизации (ПР) в группах остались 264 и 113 пациентов соответственно. Сопоставление пациентов между группами было приемлемым, учитывая, что значения абсолютных стандартизованных различий (АСР) были <0,1, а отношения дисперсии – <2 для всех переменных. Исходные характеристики исследуемой популяции показаны в таблице 1. Никаких существенных различий между двумя группами не наблюдалось.
Интраоперационные характеристики исследуемой популяции показаны в таблице 2. В группе БПШ 159 пациентам было выполнено шунтирование подколенной артерии выше колена, а 105 пациентам – шунтирование подколенной артерии ниже колена. Аутологичная вена использовалась у 76 (28,9%) пациентов, а протезирование у остальных 187 (71,1%) пациентов. В группе ЭВХ 71 пациенту были имплантированы стенты подколенной артерии выше колена, а у 42 пациентов – ниже колена. Медиана длины используемых стентов составляла 250 мм, межквартильный промежуток – [220; 320].
Таблица 1. Исходные характеристики пациентов в группах до и после псевдорандомизации
Table 1. Baseline characteristics of patients in groups before and after pseudorandomization
|
Показатели Parameters |
До ПР Unmatched |
После ПР Matched |
||||
|
Группа ЭВХ, n = 143 EVT group, n = 143 |
Группа БПШ, n = 294 Bypass group, n = 294 |
АСР ASD |
Группа ЭВХ, n = 113 EVT group, n = 113 |
Группа БПШ, n = 264 Bypass group, n = 264 |
АСР ASD |
|
|
Возраст, лет Age, years |
63,5 ± 6,3 |
65,6 ± 7,2 |
0,022 |
64,7 ± 6,2 |
64,7 ± 7,7 |
0,005 |
|
Пол, мужской Sex, male |
116 (81,1%) |
252 (85,7%) |
0,029 |
94 (83,2%) |
219 (83,0%) |
0,006 |
|
Курение Smoking |
126 (88,1%) |
256 (87,1%) |
0,013 |
99 (87,6%) |
228 (86,3%) |
0,009 |
|
Гипертензия Hypertension |
131 (91,6%) |
278 (94,5%) |
0,029 |
105 (92,9%) |
250 (94,7%) |
0,005 |
|
Ишемическая болезнь сердца Coronary artery disease |
117 (81,8%) |
221 (75,1%) |
0,068 |
94 (83,2%) |
209 (79,1%) |
0,008 |
|
Хроническая сердечная недостаточность Chronic heart failure |
131 (91,6%) |
278 (94,5%) |
0,029 |
105 (92,9%) |
248 (93,9%) |
0,01 |
|
Хроническая почечная недостаточность Chronic kidney disease |
51 (35,6%) |
95 (32,3%) |
0,037 |
41 (36,2%) |
88 (33,3%) |
0,01 |
|
Сахарный диабет Diabetes mellitus |
28 (19,5%) |
66 (22,4%) |
0,029 |
22 (19,4%) |
55 (20,8%) |
0,003 |
|
Дислипидемия Dyslipidemia |
119 (83,2%) |
234 (79,6%) |
0,039 |
94 (83,2%) |
213 (80,7%) |
0,006 |
Категория ХИНК по Rutherford Rutherford classification
|
3 |
103 (72,0%) |
201 (68,3%) |
0,037 |
81 (71,6%) |
184 (69,7%) |
0,000 |
|
4 |
11 (7,6%) |
35 (11,9%) |
0,038 |
9 (7,9%) |
24 (9,1%) |
0,000 |
|
5 |
9 (6,3%) |
20 (6,8%) |
0,002 |
8 (7,1%) |
20 (7,5%) |
0,000 |
|
6 |
18 (15,6%) |
37 (12,6%) |
0,003 |
15 (13,3%) |
35 (13,2%) |
0,000 |
Характеристики целевых артерий Characteristics of the target lesions
|
Значимое поражение общей бедренной артерии Significant lesion of common femoral artery |
51 (35,6%) |
119 (40,4%) |
0,047 |
41 (37,1%) |
99 (37,5%) |
0,01 |
|
Значимое поражение глубокой бедренной артерии Significant lesion of profunda femoral artery |
16 (11.2%) |
42 (14.3%) |
0,031 |
14 (12,4%) |
37 (14,0%) |
0,009 |
|
Окклюзия задней большеберцовой артерии Occlusion of posterior tibial artery |
30 (20,9%) |
82 (27,9%) |
0,068 |
25 (22,1%) |
63 (23,8%) |
0,009 |
|
Окклюзия передней большеберцовой артерии Occlusion of anterior tibial artery |
25 (17,5%) |
57 (19,4%) |
0,015 |
20 (17,7%) |
46 (17,4%) |
0,003 |
|
Окклюзия малоберцовой артерии Occlusion of peroneal artery |
11 (7,7%) |
31 (10,5%) |
0,023 |
9 (7,9%) |
22 (8,3%) |
0,004 |
Проходимость артерий оттока Patency of vessel runoff to the foot
|
3 проходимых артерии Three-vessel runoff |
89 (62,2%) |
170 (57,8%) |
0,044 |
70 (61,9%) |
167 (63,2%) |
0,01 |
|
2 проходимых артерии Two-vessel runoff |
44 (30,7%) |
81 (27,5%) |
0,033 |
33 (29,2%) |
74 (28,0%) |
0,01 |
|
1 проходимая артерия One-vessel runoff |
12 (8,4%) |
44 (14,9%) |
0,064 |
11 (9,7%) |
28 (10,6%) |
0,009 |
Таблица 2. Интраоперационные характеристики пациентов в группах
Table 2. Intraoperative characteristics of patients in groups
|
Показатели Parameters |
Группа БПШ, n = 263 Bypass group, n = 263 |
Группа ЭВХ, n = 113 EVT group, n = 113 |
p |
|
Длина окклюзии, мм Lesion length, mm |
260 [230; 325] |
250 [220; 320] |
0,42 |
|
Вмешательство выше щели коленного сустава Intervention above-knee popliteal artery |
158 (60,0%) |
71 (62,8%) |
0,64 |
|
Количество имплантированных стентов, шт. Number of stents |
– |
1 [1; 2] |
– |
|
Длина стентированного сегмента, мм Stent length, mm |
– |
250 [220; 320] |
– |
|
Диаметр стентов, мм Stent diameter, mm |
– |
5 [5; 6] |
– |
Окончание табл. 2
End of table 2
|
Показатели Parameters |
Группа БПШ, n = 263 Bypass group, n = 263 |
Группа ЭВХ, n = 113 EVT group, n = 113 |
p |
|
ПТФЭ протез PTFE prosthesis |
187 (71,1%) |
– |
– |
|
Реверсированная аутовена Reversed autovein |
41 (15,6%) |
– |
– |
|
Аутовена in situ Autovein in situ |
35 (13,3%) |
– |
– |
|
Диаметр ПТФЭ шунта PTFE bypass diameter |
7 [7; 8] |
– |
– |
Ранний послеоперационный период
Характеристики осложнений в раннем послеоперационном периоде (30 дней) представлены в таблице 3. Группы пациентов не различались по частоте тромбоза или расслоения оперированного сегмента, гематомы, нейропатии и серьезных нежелательных явлений. Од-
нако частота резидуального стеноза в оперированном сегменте была выше в группе ЭВХ, чем в группе БПШ. Причем четыре из пяти случаев наблюдались при имплантации стента выше коленного сустава. Ни в одной из групп не было случаев тромбоза или резидуального стеноза с потерей конечности в раннем послеоперационном периоде.
Таблица 3. Результаты раннего послеоперационного периода
Table 3. Results of the early postoperative period
|
Показатели |
Группа БПШ, n = 263 Bypass group, n = 263 |
Группа ЭВХ, n = 113 EVT group, n = 113 |
p |
|
Тромбоз: Thrombosis: |
19 (7,2%) |
6 (5,3%) |
0,65 |
|
– выше щели коленного сустава; – above-knee joint; |
2 (1,2%) |
3 (4,2%) |
0,17 |
|
– ниже щели коленного сустава – below-knee joint |
17 (16,2%) |
3 (7,1%) |
0,18 |
|
Диссекция Dissection |
0 (0%) |
2 (1,8%) |
0,89 |
|
Резидуальный стеноз: Residual stenosis: |
0 (0%) |
5 (4,4%) |
0,0023 |
|
– выше щели коленного сустава – above-knee joint |
0 (0%) |
4 (5,6%) |
0,0087 |
|
– ниже щели коленного сустава – below-knee joint |
0 (0%) |
1 (2,4%) |
0,28 |
|
Гематома, потребовавшая хирургического вмешательства Hematoma requiring surgery |
4 (1,5%) |
1 (0,8%) |
0,53 |
|
Нейропатия Neuropathy |
2 (0,8%) |
0 (0%) |
0,98 |
|
Инфекция раны Wound infection |
2 (0,8%) |
1 (0,8%) |
0,97 |
|
Инфаркт миокарда Myocardial infarction |
1 (0,4%) |
1 (0,9%) |
0,51 |
|
Острое нарушение мозгового кровообращения Stroke |
0 (0%) |
0 (0%) |
1,00 |
Таблица 4. Показатели проходимости в подгруппе с периодом наблюдения не менее 1 года Table 4. Patency rates in a subgroup analysis for one-year follow-up period
|
Показатели Parameters |
Группа БПШ, n = 184 Bypass group, n = 184 |
Группа ЭВХ, n = 77 EVT group, n = 77 |
p |
|
Первичная проходимость: Primary patency: |
141 (81,0%) |
56 (72,7%) |
0,14 |
|
– выше щели коленного сустава; – above-knee joint; |
90 (86,5%) |
36 (78,3%) |
0,23 |
|
– ниже щели коленного сустава – below-knee joint |
59 (73,8%) |
20 (64,5%) |
0,36 |
|
Первично-ассистированная проходимость: Primary-assisted patency: |
154 (83,7%) |
61 (79,2%) |
0,38 |
|
– выше щели коленного сустава; – above-knee joint; |
92 (88,5%) |
37 (80,5%) |
0,21 |
|
– ниже щели коленного сустава – below-knee joint |
62 (77,5%) |
24 (77,4%) |
1,00 |
|
Вторичная проходимость: Secondary patency: |
163 (88,6%) |
65 (84,4%) |
0,41 |
|
– выше щели коленного сустава; – above-knee joint; |
94 (90,4%) |
41 (89,1%) |
0,77 |
|
– ниже щели коленного сустава – below-knee joint |
69 (86,3%) |
24 (77,4%) |
0,26 |
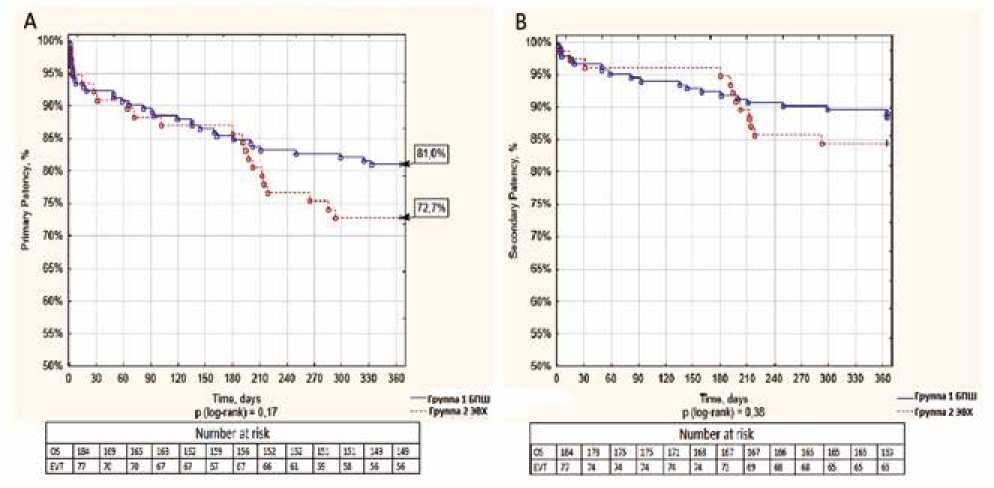
Рис. 1. Первичная и вторичная проходимость на 1-годичном периоде наблюдения. (А): кривые Каплана – Мейера первичной проходимости для группы БПШ (синяя линия) и группы ЭВХ (красная линия), (B): кривые Каплана – Мейера вторичной проходимости для группы БПШ (синяя линия) и группы ЭВХ (красная линия)
Fig. 1. Primary and secondary patency for one-year follow-up period. (A): Kaplan –Meier curves of primary patency for the bypass group (blue line) and the endovascular group (red line), (B): Kaplan – Meier curves for secondary patency for the bypass group (blue line) and the endovascular group (red line)
Таблица 5. Показатели проходимости в подгруппе с периодом наблюдения не менее 2 лет
Table 5. Patency rates in a subgroup analysis for a two-year follow-up period
|
Показатели Parameters |
Группа БПШ, n = 134 Bypass group, n = 134 |
Группа ЭВХ, n = 74 EVT group, n = 74 |
p |
|
Первичная проходимость: Primary patency: |
92 (68,5%) |
51 (68,9%) |
1,00 |
|
– выше щели коленного сустава; – above-knee joint; |
57 (71,2%) |
31 (70,5%) |
1,00 |
|
– ниже щели коленного сустава – below-knee joint |
35 (64,8%) |
20 (66,7%) |
1,00 |
|
Первично-ассистированная проходимость: Primary-assisted patency: |
93 (69,4%) |
56 (75,7%) |
0,42 |
|
– выше щели коленного сустава; – above-knee joint; |
57 (71,2%) |
33 (75,0%) |
0,68 |
Окончание табл. 5
End of table 5
|
Показатели Parameters |
Группа БПШ, n = 134 Bypass group, n = 134 |
Группа ЭВХ, n = 74 EVT group, n = 74 |
p |
|
– ниже щели коленного сустава – below-knee joint |
36 (66,7%) |
23 (76,7%) |
0,46 |
|
Вторичная проходимость: Secondary patency: |
104 (77,6%) |
64 (86,5%) |
0,14 |
|
– выше щели коленного сустава; – above-knee joint; |
62 (77,5%) |
40 (90,9%) |
0,048 |
|
– ниже щели коленного сустава – below-knee joint |
42 (77,8%) |
24 (80,0%) |
1,00 |
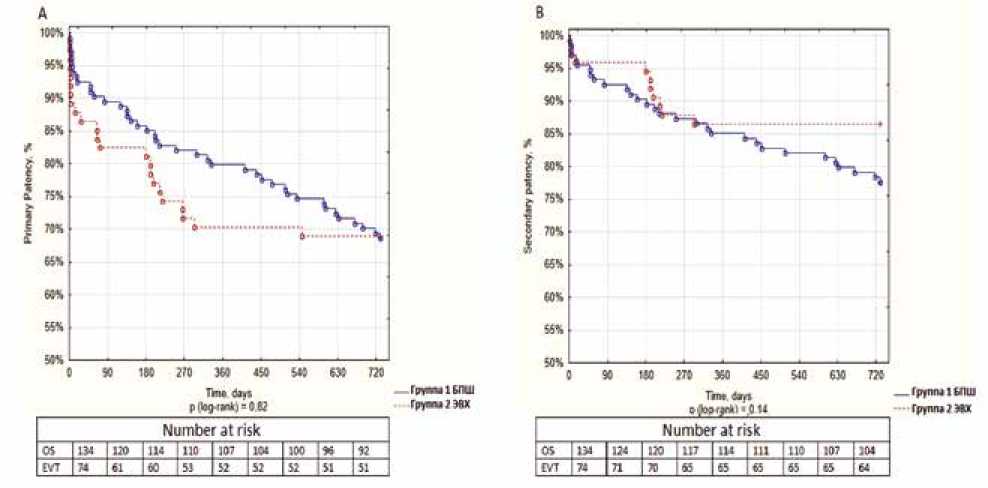
Рис. 2. Первичная и вторичная проходимость на 2-годичном периоде наблюдения. (А): кривые Каплана – Мейера первичной проходимости для группы БПШ (синяя линия) и группы ЭВХ (красная линия), (B): кривые Каплана – Мейера вторичной проходимости для группы БПШ (синяя линия) и группы ЭВХ (красная линия)
Fig. 2. Primary and secondary patency for a two-year follow-up period. (A): Kaplan –Meier curves of primary patency for the bypass group (blue line) and the endovascular group (red line), (B): Kaplan – Meier curves for secondary patency for the bypass group (blue line) and the endovascular group (red line)
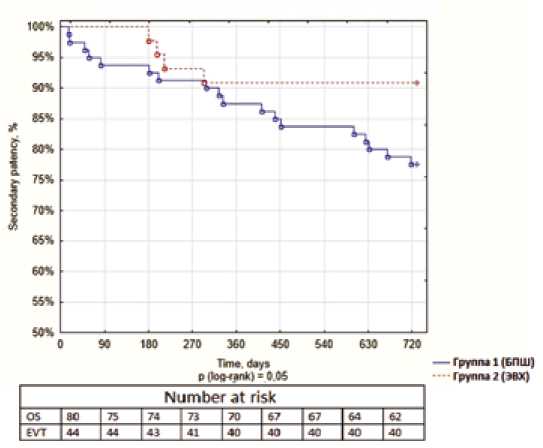
Рис. 3. Кривые Каплана – Мейера вторичной проходимости в подгруппе «выше коленного сустава» на 2-годичном периоде наблюдения, группа БПШ – синяя линия, группа ЭВХ – красная линия
Fig. 3. Kaplan – Meier curves of secondary patency in the above-the-knee subgroup analysis for a two-year follow-up period: bypass group – blue line; endovascular group – red line
Таблица 6. Субгрупповой анализ: проходимости на 2-годичном периоде наблюдения при вмешательствах «ниже коленного сустава»
Table 6. Subgroup analysis: patency rates in below-knee interventions for a two-year follow-up period
|
Показатели Parameters |
Группа БПШ Bypass group |
Группа ЭВХ EVT group |
p |
|
|
Первичная проходимость Primary patency |
||||
|
ПТФЭ шунт ( n = 32) и ЭВХ ( n = 30) ePTFE bypass ( n = 32) vs EVT ( n = 30) |
14 (42,4%) |
20 (66,7%) |
0,046 |
|
|
Аутовенозный шунт ( n = 22) и ЭВХ ( n = 30) Autovenous bypass (n = 22) vs EVT ( n = 30) |
17 (77,2%) |
20 (66,7%) |
0,3 |
|
Первично-ассистированная проходимость Primary-assisted patency
|
ПТФЭ шунт ( n = 32) и ЭВХ ( n = 30) ePTFE Bypass (n=32) vs EVT (n = 30) |
15 (45,5%) |
23 (76,7%) |
0,011 |
|
Аутовенозный шунт (n = 22) и ЭВХ (n = 30) Autovenous bypass ( n = 22) vs EVT (n = 30) |
18 (81,8%) |
23 (76,7%) |
0,46 |
Вторичная проходимость Secondary patency
|
ПТФЭ шунт ( n = 32) и ЭВХ ( n = 30) ePTFE bypass ( n = 32 ) vs EVT ( n = 30) |
21 (63,6%) |
24 (80,0%) |
0,17 |
|
Аутовенозный шунт ( n = 22) и ЭВХ ( n = 30) Autovenous bypass ( n = 22) vs EVT ( n = 30) |
18 (81,8%) |
24 (80,0%) |
0,58 |
Отдаленный послеоперационный период
Как упоминалось выше (см. дизайн исследования), пациенты были разделены на 2 подгруппы в зависимости от продолжительности периода наблюдения. Показатели проходимости за 1 и 2 года первичной, первично-ассисти-рованной и вторичной проходимости были сопоставимы в 2 группах (табл. 4, 5, рис. 1, 2).
При анализе подгруппы с 1-годичным периодом наблюдения значимых различий в подгруппах выше или ниже коленного сустава по проходимости не было выявлено. При анализе подгруппы с 2-годичным периодом наблюдения вторичная проходимость в подгруппе выше коленного сустава была выше в группе ЭВХ, чем
в группе БПШ (90,9 против 77,5%, p = 0,048) (рис. 3, табл. 5).
Снижение выраженности ХИНК не менее чем на 1 категорию по классификации R.B. Rutherford через 1 и 2 года наблюдения было сопоставимо в группах БПШ и ЭВХ (1 год: 70,1 и 65,0% соответственно, p = 0,46; 2 года: 65,7 и 68,9% соответственно, p = 0,65).
Показатели сохранения конечностей в течение 1 и 2 лет в группах БПШ и ЭВХ составили 88,6 против 90,9% ( p = 0,82) и 85,8 против 91,9% ( p = 0,27) соответственно.
Показатели выживаемости пациентов в группах БПШ и ЭВХ на 1-годичном и 2-годичном периоде наблюдения составили 92,9 против 96,1% ( p = 0,76) и 90,3 против 94,6% ( p = 0,58) соответственно.
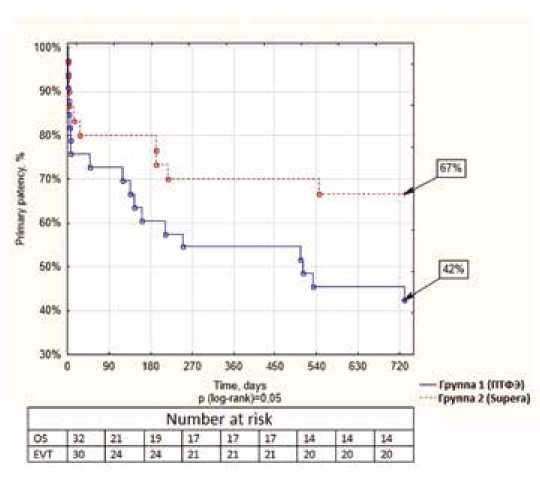
Рис. 4. Кривые Каплана – Мейера первичной проходимости в подгруппе «Ниже коленного сустава» на 2-годичном периоде наблюдения, группа БПШ протезом из ПТФЭ – синяя линия, группа ЭВХ – красная линия
Fig. 4. Kaplan-Meier curves of primary patency in the subgroup analysis below-the-knee interventions for a two-year follow-up period: ePTFE bypass group – blue line; endovascular group – red line
Обсуждение
Большинство проведенных ранее ретроспективных исследований показало преимущество аутовенозного шунтирования перед стентированием по показателям проходимости [12–14]. Однако недавнее проспективное рандомизированное исследование продемонстрировало сопоставимые результаты в группе стентирования и аутовенозного шунтирования по проходимости, сохранению конечности и выживаемости на 2-годичном периоде наблюдения для длинных поражений по классификации TASC: категории C и D [15]. Эти обнадеживающие резуль- таты вызвали интерес в плане сравнения 2 методов лечения, но с использованием плетеных нитиноловых стентов, лишенных некоторых недостатков резаных стентов.
В нашем исследовании медиана длины поражения составила 250 мм в группе стентирования, что значительно выше, чем указано в большинстве опубликованных ранее исследований [14, 16, 17], в которых средняя длина поражений варьировала от 190 до 220 мм, и лишь в исследовании F.K. Enzmann и соавт. [15] средняя длина составила 277 мм. В нашем исследовании результаты годичной первичной и вторичной проходимости не имели различий среди групп, хотя мы видим более низкие показатели для группы ЭВХ. На 2-годичном периоде наблюдения показатели в группах по первичной и вторичной проходимости также статистически значимо не отличались.
При этом наши результаты получились несколько выше, чем приводят F.K. Enzmann и соавт. [15] (там первичная проходимость для группы ЭВХ составила 60%, а для группы БПШ – 56%). Такая разница может быть вызвана немного меньшей средней длиной поражения в нашем исследовании или же фактом использования плетеного биомиметического нитинолового стента. В других ретроспективных исследованиях показатели первичной и вторичной проходимости были выше, чем у нас (от 75 до 80% – для первичной проходимости и 85–90% – для вторичной проходимости) на 2-годичном периоде наблюдения, что может быть связано с меньшей длиной поражения [12–14].
Дополнительное разделение пациентов на подгруппы по виду поражения (выше/ниже щели коленного сустава), а также на вид шунта (аутовенозный или искусственный) в группе БПШ позволило выявить интересные результаты. Так, на 2-годичном периоде наблюдения в подгруппе пациентов выше щели коленного сустава при сопоставимой первичной проходимости в группе эндоваскулярного лечения оказалась значимо лучшая вторичная проходимость (90,9 vs 77,5%, p = 0,048). А в подгруппе пациентов ниже щели коленного сустава искусственный шунт показал значимо худшую первичную и первично-асси-стированную проходимость (42,4 vs 66,7%, p = 0,046 и 45,5 vs 76,7%, p = 0,011 соответственно). При этом даже в крупных рандомизированных исследованиях подобный субанализ не проводился в связи с малым количеством пациентов в выборке [15].
Заключение
Российские рекомендации и рекомендации Европейского общества кардиологов по заболеваниям перифери- ческих артерий [3, 4] предлагают выбор эндоваскулярной стратегии для всех бедренно-подколенных поражений короче 25 см. При этом там же рекомендуется шунтирование при пролонгированных поражениях артерий бедренно-подколенного сегмента. Понятно, что открытое вмешательство более травматично, оно с большими рисками и потенциальным временем нахождения в больнице, что может не привести к лучшему общему результату по сравнению с эндоваскулярными вмешательствами. Неселективная эндоваскулярная стратегия может показаться логическим следствием наших результатов при регулярном успешном лечении бедренно-подколенных поражений длиной более 25 см. Тем не менее, особенно в случае критической ишемии конечности, угрожающей ишемии, клиническая эффективность эндоваскулярных вмешательств остается дискуссионной, особенно при неполной реваскуляризации, может привести к незначительному уменьшению симптомов ишемии, более медленному заживлению ран.
Все вышесказанное говорит о том, что наши результаты требуют дополнительной оценки, а также проведения крупных рандомизированных исследований в будущем.
Ограничения исследования
Наше исследование имеет некоторые ограничения, которые заслуживают упоминания. Это было ретроспективное нерандомизированное исследование, и выбор технических аспектов операции оставался за лечащим хирургом, пациенты различались по периоду наблюдения после оперативного вмешательства. Однако проспективно собранные данные о результатах оперативного вмешательства, а также проведение псевдорандомизации методом Propensity score matching позволили получить достоверную информацию о проходимости оперированного сегмента и клиническом состоянии пациента.
Список литературы Сравнительный ретроспективный анализ результатов бедренно-подколенного шунтирования и стентирования плетеным биомиметическим стентом у пациентов с пролонгированными окклюзиями артерий бедренно-подколенного сегмента
- Norgren L., Hiatt W.R., Dormandy J.A., Nehler M.R., Harris K.A., Fow-kes F.G.et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). J. Vase. Surg. 2007;45(S):S5-67. DOI: 10.1016/jjvs.2006.12.037.
- Jaff M.R., White C.J., Hiatt W.R., Fowkes G.R., Dormandy J., Razavi M. et al. An update on methods for revascularization and expansion of the TASC lesion classification to include below-the-knee arteries: A supplement to the Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II): The TASC steering committee. Catheter Cardiovase. Interv. 2015;86(4):611-625. DOI: 10.1002/ccd.26122.
- Национальные рекомендации по диагностике и лечению заболеваний артерий нижних конечностей. М.; 2019:110. National guidelines on the diagnosis and treatment of diseases of the arteries of the lower extremities. Moscow; 2019:110 (In Russ.).
- Aboyans V., Ricco J.B., Bartelink M.E.L., Björck M., Brodmann M., Cohnert T. et al. 2017 ESC guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries. Endorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur. Heart J. 2018;39(9):763-816. DOI: 10.1093/eurheartj/ehx095.
- Lin Y., Tang X., Fu W., Kovach R., George J.C., Guo D. Stent fractures after superficial femoral artery stenting: Risk factors and impact on patency. J. Endovasc. Ther. 2015;22(3):319-326. DOI: 10.1177/1526602815580783.
- Duda S.H., Bosiers M., Lammer J., Scheinert D., Zeller T., Oliva V. et al. Drug-eluting and bare nitinol stents for the treatment of atherosclerotic lesions in the superficial femoral artery: Long-term results from the SIROCCO trial. J. Endovasc. Ther. 2006;13(6):701-710. DOI: 10.1583/051704.1.
- Laird J.R., Katzen B.T., Scheinert D., Lammer J., Carpenter J., Buchbinder M. et al. Nitinol stent implantation vs. balloon angioplasty for lesions in the superficial femoral and proximal popliteal arteries of patients with claudication: Three-year follow-up from the RESILIENT randomized trial. J. Endovasc. Ther. 2012;19(1):1-9. DOI: 10.1583/113627.1.
- Werner M., Paetzold A., Banning-Eichenseer U., Scheinert S., Piorkow-ski M., Ulrich M. et al. Treatment of complex atherosclerotic femoropop-liteal artery disease with a self-expanding interwoven nitinol stent: midterm results from the Leipzig SUPERA 500 registry. EuroIntervention. 2014;10(7):861-868. DOI: 10.4244/EIJV10I7A147.
- Garcia L., Jaff M.R., Metzger C., Sedillo G., Pershad A., Zidar F. et al. Wire-interwoven nitinol stent outcome in the superficial femoral and proximal popliteal arteries: Twelve-month results of the SUPERB trial. Circ. Cardiovasc. Interv. 2015;8(5):e000014. DOI: 10.1161/CIRCINTER-VENTIONS.113.000937.
- Conte M.S., Bradbury A.W., Kolh P., White J.V., Dick F., Fitridge R. et al. Global vascular guidelines on the management of chronic limb-threatening ischemia. Eur. J. Vasc. Endovasc. Surg. 2019;58(1S):S1-S109.e33. DOI: 10.1016/j.ejvs.2019.05.006.
- Ruzankin P.S. A fast algorithm for maximal propensity score matching. Methodol. Comput. Appl. Probab. 2020;(22):477-495. DOI: 10.1007/ s11009-019-09718-4.
- Okuno S., Iida O., Iida T., Yamaoka T., Kitano I., Asai M. et al. Comparison of clinical outcomes between endovascular therapy with self-expandable nitinol stent and femoral-popliteal bypass for trans-atlantic inter-society consensus II C and D femoropopliteal lesions. Ann. Vasc. Surg. 2019;57:137-143. DOI: 10.1016/j.avsg.2018.09.024.
- Siracuse J.J., Giles K.A., Pomposelli F.B., Hamdan A.D., Wyers M.C., Chaikof E.L. et al. Results for primary bypass versus primary angioplasty/stent for intermittent claudication due to superficial femoral artery occlusive disease. J. Vasc. Surg. 2012;55(4):1001-1007. DOI: 10.1016/j. jvs.2011.10.128.
- ihara H., Soga Y., Mii S., Okazaki J., Yamaoka T., Kamoi D. et al. Comparison of long-term outcome after endovascular therapy versus bypass surgery in claudication patients with Trans-Atlantic Inter-Society Con-sensus-II C and D femoropopliteal disease. Circ. J. 2014;78(2):457-464. DOI: 10.1253/circj.cj-13-1147.
- Enzmann F.K., Nierlich P., Aspalter M., Hitzl W., Dabernig W., Hölzen-bein T. et al. Nitinol stent versus bypass in long femoropopliteal lesions: 2-year results of a randomized controlled trial. JACC Cardiovasc. Interv. 2019;12(24):2541-2549. DOI: 10.1016/j.jcin.2019.09.006.
- Lammer J., Zeller T., Hausegger K.A., Schaefer P.J., Gschwendtner M., Mueller-Huelsbeck S. et al. Sustained benefit at 2 years for covered stents versus bare-metal stents in long SFA lesions: The VIASTAR trial. Cardiovasc. Intervent. Radiol. 2015;38(1):25-32. DOI: 10.1007/s00270-014-1024-9.
- Reijnen M.M.P.J., van Walraven L.A., Fritschy W.M., Lensvelt M.M.A., Zeebregts C.J., Lemson M.S. et al. 1-year results of a multicenter randomized controlled trial comparing heparin-bonded endoluminal to femoropopliteal bypass. JACC Cardiovasc. Interv. 2017;10(22):2320-2331. DOI: 10.1016/j.jcin.2017.09.013.


