Среднеотдаленные результаты реконструктивных операций на митральном клапане при дисплазии соединительной ткани с помощью опорных колец D ring и C flex
Автор: Железнев Сергей Иванович, Богачев-Прокофьев Александр Владимирович, Афанасьев Александр Владимирович, Назаров Владимир Михайлович, Демин Игорь Иванович, Караськов Александр Михайлович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Цель Сравнить результаты реконструкции митрального клапана при дисплазии соединительной ткани с использованием полужестких и гибких опорных колец. Материал С сентября 2011 г. по сентябрь 2014 г. в исследование включили 171 пациента с изолированной митральной и методы недостаточностью и разделили на две группы. Средний возраст пациентов в группе I (D ring) и группе II (C flex) составил 57 (42-65) и 54 (41-63) года (р = 0,092). Более половины пациентов каждой группы были мужского пола (69 и 67%). Результаты Случаев ранней летальности (90 дней) в обеих группах не было. Частота транзиторных ишемических атак в группе D ring составила 4 случая (р = 0,042). В средние сроки наблюдения 24 мес. в группах D ring и C flex выживаемость пациентов составила 96,0±2,3% (95% ДИ 88,6-98,7%) и 94,3±2,8% (95% ДИ 85,5-97,9%) (лог ранговый критерий = 0,899); свобода от реоперации - 97,0±2,1% (95% ДИ 88,4-99,3%) и 100% соответственно (лог-ранговый критерий = 0,044); свобода от МН >2-й степени - 80,8±6,5% (95% ДИ 64,0-90,3%) и 92,8±3,1% (95% ДИ 83,4-97,0%) (лог-ранговый критерий = 0,002). Заключение Применение гибких C flex колец снижает частоту послеоперационных осложнений и позволяет получить лучшие клинические и функциональные результаты в среднеотдаленном послеоперационном периоде по сравнению с использованием полужестких замкнутых опорных колец у пациентов с выраженной митральной недостаточностью вследствие дисплазии соединительной ткани
Митральная недостаточность, митральная регургитация, пластика митрального клапана, дисплазия соединительной ткани
Короткий адрес: https://sciup.org/142140684
IDR: 142140684 | УДК: 616.126.4-089
Текст научной статьи Среднеотдаленные результаты реконструктивных операций на митральном клапане при дисплазии соединительной ткани с помощью опорных колец D ring и C flex
В 1957 г. Lillehei C.W., Gott V.L., Dewall R.A. и со-авт. [1] внедрили аннулопластику – новый подход в сердечно-сосудистой хирургии. Аннулопластика на опорном кольце при коррекции митральной недостаточности (МН) любой этиологии – золотой стандарт реконструкции митрального клапана [2].
Идеальное устройство для аннулопластики должно обеспечивать стабильность реконструированного клапана в течение длительного периода, уменьшать напряжение и натяжение створок, подклапанных хорд, папиллярных мышц, поддерживать низкий трансклапанный градиент давления, сохранять такие компоненты физиологичной динамики митрального клапана (МК), как восстановление переднезаднего соотношения 3:4, сохранение трехмерной пространственной конфигурации МК без препятствия динамике фиброзного кольца в течение сердечного цикла [3–5].
Использование полужестких замкнутых опорных колец и гибких разомкнутых полуколец («бэндов»)
Таблица 1 Характеристика пациентов
Выбор опорного кольца для укрепления МК у пациентов с выраженной митральной недостаточностью при дисплазии соединительной ткани – тема исследования.
Статистический анализ
Анализ данных хирургического лечения проводился с помощью программы Statistica for Windows 10.0 (Statsoft, Inc., США). Для определения достоверности различий межгрупповых сравнений применялся: в группах номинальных данных – критерий хи-квадрат, в группах порядковых данных – непараметрический U-критерий Манна – Уитни, в группах непрерывных данных – критерий Стьюдента (при нормальном распределении признака) или непараметрический U-критерий Манна – Уитни (при распределении, отличном от нормального). Сравнительный анализ кривых выживаемости, свободы от возврата значимой митральной регургитации, реоперации проводился с помощью лог-рангового критерия (log-rank test), что графически выражалось по методу Каплана – Майера. Регрессионный анализ предикторных переменных производился с помощью пакета прикладных программ Stata/SE for MAC 10.0 (StataCorp LP, США). Предикторные переменные резидуальной МН выявляли простой и множественной логистической регрессией. Предикторы возврата митральной недостаточности, реоперации и отдаленной летальности определяли регрессией пропорциональных рисков Кокса. Уровень значимости для всех методов установлен как p≤0,05.
Материал и методы
Клиническое исследование одобрено локальным этическим комитетом института. Клиническая часть
Таблица 2 Интраоперационные данные
|
Характеристика |
I группа, n = 85 |
II группа, n = 86 |
р |
|
Пролапс, n (%) |
|||
|
9 (10,6) |
11 (12,8) |
0,654 |
|
|
А1 сегмента |
|||
|
А2 сегмента |
23 (27,1) |
33 (38,4) |
0,115 |
|
А3 сегмента |
13 (15,3) |
19 (22,1) |
0,254 |
|
P1 сегмента |
6 (7,1) |
12 (13,9) |
0,142 |
|
P2 сегмента |
59 (69,4) |
68 (79,1) |
0,119 |
|
P3 сегмента |
17 (20,0) |
27 (31,4) |
0,088 |
|
ПСМК |
31 (36,5) |
40 (46,5) |
0,183 |
|
ЗСМК |
73 (85,9) |
74 (86,1) |
0,975 |
|
Изолированный пролапс, n (%) ПСМК |
12 (14,1) |
12 (14,0) |
0,694 |
|
ЗСМК |
54 (63,5) |
46 (53,5) |
0,240 |
|
Пролапс обеих створок, n (%) |
19 (22,4) |
28 (32,5) |
0,135 |
|
Отрыв хорд, n (%) |
64 (75,3) |
53 (61,6) |
0,055 |
|
Резекция, n (%) |
1 (1,2) |
4 (4,7) |
0,178 |
|
ПСМК |
|||
|
ЗСМК |
37 (43,5) |
49 (56,9) |
0,079 |
|
Протезирование хорд, n (%) ПСМК |
22 (25,9) |
29 (33,7) |
0,263 |
|
ЗСМК |
30 (35,3) |
27 (31,4) |
0,589 |
|
Размер опорного кольца, мм |
32 (30; 32) |
34 (30; 34) |
0,456 |
|
Процедура MAZE IV, n (%) |
18 (21,2) |
14 (16,3) |
0,412 |
|
АКШ, n (%) |
10 (11,8) |
4 (4,7) |
0,090 |
|
Пластика ТК, n (%) |
32 (37,6) |
24 (27,9) |
0,175 |
|
SAM-синдром, n (%) |
0 |
1 (1,2) |
0,319 |
|
Доступ, n (%) |
|||
|
Стандартно |
60 (70,6) |
50 (58,1) |
0,089 |
|
Миниинвазивно |
25 (29,4) |
27 (31,4) |
0,778 |
|
Робот-ассистент |
0 |
9 (10,5) |
0,002 |
|
ИК, мин |
140 (110; 179,5) |
160 (122; 206) |
0,091 |
|
ОА, мин |
|||
|
92 (73; 117) |
101 (78,5; 124,5) |
0,230 |
|
|
срединный стернотомный доступ |
|||
|
боковая миниторакотомия, не включая робота-ассистента |
116 (101; 128,5) |
122,5 (105,5; 156) |
0,171 |
|
в подгруппе робота-ассистента |
– |
151 (124; 182) |
<0,001* |
|
Глубина кооптации, мм |
9 (7; 11) |
6 (5; 8) |
0,006 |
|
Градиент на МК, мм рт. ст. |
|||
|
8,0 (6,7; 10,9) |
6,4 (4; 9) |
<0,001 |
|
|
пиковый |
|||
|
средний |
3 (2,4; 4) |
2 (2; 3,9) |
<0,001 |
ПСМК – передняя створка митрального клапана; ЗСМК – задняя створка митрального клапана; АКШ – аортокоронарное шунтирование; ТК – трикуспидальный клапан; SAM-синдром – переднесистолическое движение передней створки митрального клапана; ИК – искусственное кровообращение; ОА – окклюзия аорты. * в сравнении с ОА в группе I подгруппы боковой миниторакотомии исследования включает анализ взрослых пациентов, оперированных по поводу выраженной изолированной МН вследствие дисплазии соединительной ткани за период с сентября 2011 г. по сентябрь 2014 г. Все пациенты были рандомизированы на две группы. В первой группе для аннулопластики МК применяли полужесткое замкнутое опорное коль- цо D ring (ЗАО НПП «МедИнж», Пенза, Россия), во второй – гибкое полукольцо C flex (ЗАО НПП «МедИнж»).
Критерии исключения: отказ пациента от участия в любом из этапов исследования; другое имплантированное опорное кольцо, отличное от группы рандомизации; поражение митрального клапана инфек-
Таблица 3 Послеоперационное течение
|
Характеристика |
Группа I, n = 85 |
Группа II, n = 86 |
р |
|
Госпитальная летальность, n (%) |
1 (1,2) |
0 |
0,313 |
|
АНО, дней |
2 (2; 3) |
2 (2; 2) |
0,453 |
|
ИВЛ, ч |
7 (4; 11) |
5 (3; 9) |
0,068 |
|
Инотропная поддержка, ч |
10 (2; 20) |
14 (2; 20) |
0,591 |
|
СН, требующая продленной инотропной поддержки, n (%) |
23 (27,1) |
19 (22,1) |
0,451 |
|
ДН, требующая длительной ИВЛ, n (%) |
14 (16,5) |
15 (17,4) |
0,866 |
|
ЭКМО, n (%) |
2 (2,4) |
2 (2,3) |
0,991 |
|
Ранние преходящие пароксизмы ФП, n (%) |
39 (45,9) |
30 (34,9) |
0,143 |
|
потребовавшие ЭДС |
7 (8,2) |
3 (3,5) |
0,186 |
|
Клапан-связанные осложнения, n (%) |
|||
|
ОИМ |
5 (5,9) |
3 (3,5) |
0,459 |
|
ТИА |
4 (4,7) |
0 |
0,042 |
|
ОНМК |
0 |
1 (1,2) |
0,319 |
|
ОПН |
5 (5,9) |
4 (4,7) |
0,719 |
|
ИЭ |
1 (1,2) |
1 (1,2) |
0,993 |
|
Отрыв опорного кольца |
1 (1,2) |
0 |
0,313 |
|
Эндолики |
0 |
0 |
– |
|
Тромбоз |
0 |
0 |
– |
|
Эмболия |
0 |
0 |
– |
|
Структурная дисфункция |
0 |
0 |
– |
|
Повышенный темп отделяемого по дренажам, n (%) |
9 (10,6) |
6 (7,0) |
0,404 |
|
потребовавшее реоперации |
4 (4,7) |
1 (1,2) |
0,169 |
|
Лимфоррея, n (%) |
0 |
1 (1,2) |
0,319 |
|
Имплантация ЭКС, n (%) |
9 (10,6) |
6 (7,0) |
0,404 |
|
Плевральные пункции, n (%) |
14 (16,5) |
20 (23,2) |
0,266 |
|
Субфебрилитет, n (%) |
13 (15,3) |
15 (17,4) |
0,704 |
|
Инфекционные осложнения п/о раны, n (%) |
1 (1,2) |
1 (1,2) |
0,993 |
|
к/д, дней |
17 (14; 21) |
17 (15; 24) |
0,455 |
АНО – отделение анестезиологии-реанимации после операции; ИВЛ – искусственная вентиляция легких; СН – сердечная недостаточность; ДН – дыхательная недостаточность; ЭКМО – экстракорпоральная мембранная оксигенация; ЭДС – электрическая кардиоверсия сердца; ОИМ – острый инфаркт миокарда; ТИА – транзиторная ишемическая атака; ОНМК – острое нарушение мозгового кровообращения; ОПН – острая почечная недостаточность; ИЭ – инфекционный эндокардит; ЭКС – электрокардиостимулятор; к/д – койко-день ционным эндокардитом, ревматическим процессом, выявленное во время операции; протезирование митрального клапана вследствие неуспешной клапаносохраняющей операции с использованием опорного кольца.
Первичной конечной точкой являлась свобода от значимой (умеренной и тяжелой) возвратной митральной регургитации в отдаленном послеоперационном периоде.
Всего в анализ включили 171 пациента с изолированной МН II типа по классификации A. Carpentier. Этиологией митральной недостаточности у всех пациентов была дисплазия соединительной ткани.
Средний возраст пациентов в I и II группах составил 57 (42–65) и 54 (41–63) года соответственно; р =
0,092. Более половины пациентов в каждой из групп были мужского пола (69 и 67%). По остальным антропометрическим характеристикам также не выявлено межгрупповых различий (табл. 1).
Посегментарный анализ при ревизии МК применялся рутинно у всех пациентов. В зависимости от выявленных анатомических особенностей поражения отдельных сегментов передней или задней створок выполняли резекционные методики, протезирование хорд отдельными нитями либо группой петель или сочетание методов. Сводные данные представлены в табл. 2. Группы не различались по основным операционным характеристикам, включая длительность окклюзии аорты и искусственного кровообращения. Аннулопластику МК выполняли имплантаци-
Таблица 4 Показатели ЭхоКГ в группах до и после операции
I группа II группа Межгруп- Межгруп-
|
Показатель |
Исходно |
После операции |
р |
Исходно |
После операции |
р |
повое р исходно |
повое р после операции |
|
ПП, ось, см |
||||||||
|
короткая |
4,5 (4,1; 5,0) |
4,2 (3,9; 4,4) |
<0,001 |
4,3 (4; 4,8) |
4,1 (3,8; 4,5) |
<0,001 |
0,097 |
0,319 |
|
длинная |
5,4 (4,8; 6,1) |
4,9 (4,6; 5,3) |
<0,001 |
5,3 (4,6; 5,9) |
4,8 (4,4; 5,2) |
<0,001 |
0,155 |
0,187 |
|
ЛП, ось, см |
||||||||
|
короткая |
5,4 (5,0; 5,9) |
4,5 (4,3; 4,9) |
<0,001 |
5,4 (4,8; 5,8) |
4,5 (4,3; 4,9) |
<0,001 |
0,680 |
0,614 |
|
длинная |
6,1 (5,6; 6,9) |
5,2 (4,9; 5,8) |
<0,001 |
5,7 (5,4; 6,7) |
5,1 (4,8; 5,5) |
<0,001 |
0,070 |
0,067 |
|
ТрН, степень, n (%) |
1 (1; 2) |
1 (1; 1) |
<0,001 |
1 (1; 2) |
1 (0; 1) |
<0,001 |
0,113 |
0,475 |
|
≥ 2 |
30 (35,3) |
3 (3,5) |
<0,001 |
22 (25,6) |
2 (2,3) |
<0,001 |
0,168 |
0,640 |
|
КДР ПЖ, см |
2,6 (2,1; 3,0) |
2,5 (2,3; 2,8) |
0,594 |
2,5 (2,3; 2,7) |
2,5 (2,3; 2,7) |
0,367 |
0,480 |
0,484 |
|
S МО по Допплеру, см2 |
3,8 (3,4; 4,0) |
3,3 (3,1; 3,5) |
<0,001 |
4,1 (3,5; 4,7) |
3,34(3,1; 3,7) |
<0,001 |
0,062 |
0,202 |
|
S МО планиметрически, см2 |
6,2 (5,3; 8,0) |
3,2 (3,1; 4,5) |
0,028 |
7,4 (6,8; 8,8) |
3,43(3,3; 3,9) |
<0,001 |
0,208 |
0,183 |
|
МН, степень, n (%) |
3 (3; 4) |
1 (0;1) |
<0,001 |
4 (4; 4) |
1 (0;1) |
<0,001 |
0,829 |
0,125 |
|
≥ 2 |
85 (100) |
5 (5,9) |
<0,001 |
86 (100) |
4 (4,7) |
<0,001 |
0,168 |
0,719 |
|
≥ 3 |
85 (100) |
1 (1,2) |
<0,001 |
86 (100) |
0 |
<0,001 |
0,168 |
0,313 |
|
Градиент на МК, мм рт. ст. |
||||||||
|
пиковый |
8,7 (5; 11) |
8,8(6,9; 11,0) |
0,684 |
7,9(5,2; 11,3) |
7,0 (4,9; 9,0) |
0,027 |
0,680 |
<0,001 |
|
средний |
2,8 (2; 3,6) |
3,0 (2,6; 4,1) |
0,236 |
2,6 (2; 3,8) |
2,7 (2; 4) |
0,872 |
0,985 |
0,002 |
|
КДР ЛЖ, см |
5,78±0,59 |
5,03±0,53 |
<0,001 |
5,78±0,74 |
5,04±0,52 |
<0,001 |
0,962 |
0,874 |
|
КСР ЛЖ, см |
3,49±0,55 |
3,36±0,49 |
0,055 |
3,51±0,71 |
3,35±0,58 |
0,783 |
0,815 |
0,891 |
|
КДО ЛЖ, мл |
172,5±42,0 |
120,9±32,6 |
<0,001 |
169,0±50,0 |
123,4±32,3 |
<0,001 |
0,624 |
0,618 |
|
КСО ЛЖ, мл |
53,0 (43; 74) |
44,5(34; 58) |
<0,001 |
50,5 (37; 65) |
45 (36; 63) |
0,165 |
0,127 |
0,360 |
|
УО ЛЖ, мл |
113,4±34,1 |
73,1±20,2 |
<0,001 |
114,9±34,9 |
72,8±19,9 |
<0,001 |
0,777 |
0,918 |
|
ФВ ЛЖ, % |
65,5 (58; 74) |
61 (55; 65) |
<0,001 |
67,0 (62; 73) |
59 (53; 64) |
<0,001 |
0,212 |
0,247 |
|
ФУ ЛЖ, % |
38,4±7,3 |
32,7±5,8 |
<0,001 |
39,6±6,3 |
32,5±6,0 |
<0,001 |
0,356 |
0,785 |
|
ЗСЛЖ, см |
1,2 (1; 1,36) |
1,1 (1; 1,2) |
0,136 |
1,1 (1; 1,3) |
1,1 (1; 1,3) |
0,745 |
0,061 |
0,371 |
|
МЖП, см |
1,3 (1; 1,6) |
1,1(1; 1,3) |
0,036 |
1,2 (1,1; 1,4) |
1,1 (1; 1,3) |
0,326 |
0,233 |
0,684 |
|
сДЛА, мм рт. ст. |
48,5 (42; 56) |
36 (33; 40) |
0,003 |
45 (39; 54,5) |
36,5 (33; 37) |
<0,001 |
0,053 |
0,416 |
Табл. 4, 5: S МО – площадь митрального отверстия; УО – ударный объем; ФУ – фракция укорочения; ЗСЛЖ – задняя стенка левого желудочка; МЖП – межжелудочковая перегородка ей опорного кольца D-ring или C-flex в зависимости от группы рандомизации.
Модифицированную процедуру MAZE, или «лабиринт», проводили пациентам с пароксизмальной, персистирующей и длительно персистирующей формами фибрилляции предсердий. Подавляющему большинству пациентов применяли биполярную радиочастотную аблацию левого предсердия с использованием коммерческой системы AtriCure (AtriCure Inc., Cincinnati, OH, США). Результаты хирургического лечения ФП при пороках МК в различных модификациях представлены ранее [7–10].
Коррекция функциональной трикуспидальной недостаточности (ТрН) во всех случаях выполнялась путем имплантации опорного кольца Standart (ЗАО НПП «МедИнж»).
Мы рекомендуем использовать ЧПЭхоКГ всем пациентам с пластикой МК для контроля выполненного вмешательства. По данным контрольной ЧПЭхоКГ выявлено, что с использованием опорного кольца D ring создается большая площадь кооптации, в то время как при имплантации C flex сохраняются более низкие трансклапанные градиенты давления.
Результаты
Непосредственные результаты . На госпитальном этапе умер 1 пациент (0,6%) из группы D ring через 6 мес. после операции вследствие прогрессирования полиорганной недостаточности.
Течение послеоперационного периода представлено в табл. 3. Не выявлено статистически значимых различий групп в длительности инотропной поддержки в раннем послеоперационном периоде – 10 (2– 20) и 14 (2–20) ч соответственно, частоте развития сердечной недостаточности – 27,1 и 22,1%, а также поддержки с помощью экстракорпоральной мембранной оксигенации – по 2 случая в каждой группе (р = 0,991).
У четырех пациентов из группы имплантации опорного кольца D ring и у одного пациента из группы имплантации гибкого полукольца в первые сутки после операции выполняли рестернотомию с целью гемостаза (р = 0,169).
При анализе клапан-зависимых осложнений (табл. 3) не выявлено различий в частоте развития в раннем послеоперационном периоде острого инфаркта миокарда (5 и 3 случая соответственно), острого нарушения мозгового кровообращения (0 и 1 случай), острого нарушения функций почек, потребовавшего проведения почечно-заместительной терапии (5 и 4 случая) и инфекционного эндокардита митрального клапана (по 1 случаю в каждой группе); р = 0,05. Инфекционный эндокардит оперированного клапана в обоих случаях эффективно пролечили антибактериальной терапией. Случаев структурной дисфункции (поломки) опорного кольца, тромбоза МК, эмболических осложнений, фистул (эндоликов) не отмечено. Относительно большая частота инциденсов транзиторных ишемических атак (4 случая) выявлена в первой группе (р = 0,042).
У одного пациента первой группы на госпитальном этапе произошли прорезывание швов и частичный отрыв опорного кольца D ring с развитием выраженной митральной регургитации. У пациента в раннем послеоперационном периоде развился острый инфаркт миокарда, поэтому оперативное лечение значимой возвратной митральной регургитации отсрочили. После стабилизации состояния пациента перевели на амбулаторное лечение и наблюдение с последующей госпитализацией на плановое хирургическое лечение. Через 7 мес. после операции в плановом порядке пациенту выполнили протезирование митрального клапана механическим протезом.
Анализ эхокардиографических параметров представлен в виде динамики показателей относительно дооперационного состояния и межгруппового сравнения в раннем послеоперационном периоде (табл. 4). Исходно группы были сопоставимы по всем признакам. В обеих группах уже на госпитальном этапе показано уменьшение левого (ЛП) и правого предсердий (ПП) как по длинной, так и короткой оси (р<0,001). Отмечено значимое сокращение линейных и объемных показателей левого желудочка (ЛЖ): конечного диастолического размера (КДР), конечного диастолического объема (КДО), в первой группе еще и конечного систолического объема (КСО) относительно исходных данных (р<0,001). Таким образом, пластика МК с имплантацией опорных колец D ring и C flex положительно влияет на процессы обратного ремоделирования ЛЖ, левого и правого предсердий.
Показано достоверное снижение медиан расчетного систолического давления в покое с 48,5 до 36 мм рт. ст. в первой группе и с 45 до 36,5 мм рт. ст. во второй (р<0,001). Результаты подтверждают влияние выраженной МН на развитие гиперволемии малого круга кровообращения как механизма посткапиллярной легочной гипертензии, ассоциированной с заболеваниями левых отделов сердца, по международной классификации легочной гипертензии Dana Point 2008 г. Однако более 10% пациентов в каждой группе имели остаточную легочную гипертензию, несмотря на эффективную коррекцию митральной недостаточности.
При межгрупповом анализе ЭхоКГ-параметров к моменту выписки (табл. 4) разницы между показателями ремоделирования левых и правых отделов сердца не выявлено. В группах продемонстрировали сопоставимую эффективность коррекции МН, частоты резидуальной МН ≥ 2-й степени (5,9 и 4,7%, р = 0,719), МН ≥ 3-й степени (1,2 и 0% соответственно, р = 0,313).
Различиями групп, по данным ЭхоКГ на момент выписки, являются более высокие при использовании опорного кольца D ring пиковый градиент давления на МК – 8,8 (6,9–11,0) против 7,0 (4,9–9,0) мм рт. ст. (р<0,001) и средний градиент давления – 3,0 (2,6–4,1) против 2,7 (2–4) мм рт. ст. (р = 0,002).
При проведении однофакторного логистического регрессионного анализа среди 171 пациента с отсутствием или наличием резидуальной МН значимыми переменными являлись: линейные размеры ПП по короткой (ОШ 3,1; 95% ДИ 1,3–7,4; χ2df=1 = 6,6; р = 0,010) и длинной (ОШ 2,3; 95% ДИ 1,3–3,9; χ2df=1 = 7,3; р = 0,007) осям; ТрН (ОШ 2,9; χ2df=1 = 3,8; р = 0,049); средний градиент на МК (ОШ 1,3; 95% ДИ 1,1–1,5; χ2df=1 = 4,4, р = 0,035), а также КДО ЛЖ (ОШ 1,01; 95% ДИ 1,009–1,03; χ2df=1 = 5,6; р = 0,020). При построении многофакторной логит-регрессии выявлено отсутствие статистически значимой связи между предполагаемыми предикторами и резидуальной митральной недостаточностью.
0,8
0,7
0,6
0,5
0,4
о <
0,3
0,2
I 0,1
0,0

р = 0,899
5 10 15 20 25 30 35 40 45 50
о Заверш.
4- Цензурир.
Время, мес.
Выжившие пациенты, подверженные риску
|
Группа |
3 |
9 |
12 |
18 |
24 |
30 |
36 |
42 |
46 |
|
d ring |
84 |
80 |
70 |
57 |
39 |
20 |
10 |
6 |
3 |
|
c flex |
81 |
80 |
69 |
61 |
51 |
40 |
26 |
11 |
2 |
Рис. 1. Кривая выживаемости пациентов в двух группах (Каплан – Майер)
Отдаленные результаты. Средний срок клинических наблюдений составил 24,7 мес. с 95% ДИ 23,5–27,0 мес. Для первой группы полнота клинического наблюдения составила 100%, для C flex – 94,2%
Значения оценок Каплана – Майера частоты выживания пациентов первой группе в течение 1 года после пластики МК оказались равными 97,6±1,7% (95% ДИ 90,8–99,4%); 2 лет – 96,0±2,3% (95% ДИ 88,6–98,7%); 3 лет – 88,0±7,9% (95% ДИ % 60,0– 96,7%).
Значения оценок Каплана – Майера частоты выживания пациентов второй группы в течение 1 года составили 97,4±1,8% (95% ДИ 90,3–99,4%); 2 лет – 94,3±2,8% (95% ДИ 85,5–97,9%); 3 лет – 94,3±2,8% (95% ДИ 85,5–97,9%).
Лог-ранговый критерий не выявил статистически значимых различий частоты выживания с течением времени (р = 0,899) (рис. 1).
Большинство пациентов находились в I–II ФК по NYHA. Выраженные ограничения физической активности испытывали 18,5 и 11,7% пациентов первой и второй групп соответственно. Функциональное состояние пациентов (р = 0,279) при межгрупповом сравнении не различалось.
При анализе клапан-связанных осложнений не выявлено межгрупповых различий в частоте встречаемости острого инфаркта миокарда, нарушений мозгового кровообращения, инфекционного эндокардита, эндоликов, частичного или полного отрыва опорного кольца. Случаев механической дисфункции опорного кольца, геморрагических и тромбоэмболических осложнений не обнаружено.
Причиной реоперации во всех случаях в первой группе стал частичный отрыв опорного кольца вследствие прорезывания швов на фиброзном кольце митрального клапана.
Значения оценок Каплана-Мейера свободы от повторных протезирований МК в первой группе составили: 98,8±1,2% в течение 1 года (95% ДИ 91,6– 99,8%); 97,0±2,1% через 2 года (95% ДИ 88,4–99,3%) и 90,3±6,8% через 3 года после операции (95% ДИ 65,1–97,6%); во второй группе не отмечено случаев реоперации за весь период. Лог-ранговый критерий выявил статистически значимые различия по частоте реопераций с течением времени (р = 0,044) (рис. 2). Дальнейшее исследование с помощью регрессионного анализа пропорциональных рисков Кокса не выявило независимых предикторов реоперации в отдаленном послеоперационном периоде.
1,0
0,9
0,8
0,7
0,6
I 0,5
0,4
0,3
0,2
S' 0,1
0,0

d ring c flex
р = 0,044
0 5 10 15 20 25 30 35 40 45 50
Время, мес.
Выжившие пациенты, подверженные риску реоперации
|
Группа |
0 |
6 |
12 |
18 |
24 |
30 |
36 |
42 |
46 |
|
d ring |
85 |
84 |
69 |
57 |
39 |
20 |
10 |
6 |
3 |
|
c flex |
86 |
80 |
69 |
6` |
51 |
40 |
37 |
9 |
2 |
Рис. 2. Свобода от реоперации в двух группах (Каплан – Майер)
Актуальный охват пациентов эхокардиографией в отдаленные сроки наблюдений в первой группе составил 94,0%, во второй – 90,7% (p = 0,411). Результаты отдаленного обследования представлены в табл. 5.
При оценке линейных размеров правого и левого предсердий, линейных и объемных характеристик левого желудочка пациентов первой группы сохраняется достигнутый к моменту выписки эффект гемодинамической коррекции митрального порока в виде обратного ремоделирования полостей и камер сердца. В отдаленном периоде при оценке критерием хи-квадрат МакНемара не наблюдается прироста абсолютного риска трикуспидальной недостаточности ≥2-й степени: 3,5% в раннем послеоперационном и 8,9% в отдаленном периодах наблюдения (р = 0,343). Также не отмечено динамики медианы (Q1; Q3) расчетного систолического давления с момента выписки из стационара (34,5 и 36 мм рт. ст., р = 0,080) у пациентов первой группы. Площадь митрального отверстия достоверно меньше исходных значений (р = 0,003), но не происходит уменьшение его размеров (р = 0,806) относительно послеоперационных измерений. При анализе градиентов давления на МК сохраняется достоверно больший средний градиент 3,7 против 2,8 мм рт. ст. исходного показателя (р = 0,002). В первой группе повысился абсолютный риск МН ≥2-й степени с 5,9 случаев с момента выписки до 20,3% случаев в отдаленные сроки (хи-квадрат МакНемара, р = 0,029).
Во второй группе увеличились размеры правого предсердия по короткой оси до промежуточного между дооперационным и ранним послеоперационным (р = 0,152 и р = 0,467 соответственно), что нивелировало различия, показанные в табл. 4. В остальном процессы ремоделирования ЛП и ПП описываются сходным образом с первой группой. Однако процессы ремоделирования ЛЖ в отдаленном послеоперационном периоде пациентов с имплантированным гибким полукольцом C flex, в отличие от пациентов с D ring, продолжаются. Так показаны процессы дальнейшего уменьшения КДР (р = 0,017), устойчивого к изменениям КСР (р<0,001), объемных показателей (р ≤ 0,001) и ФУ ЛЖ (р<0,001). Кроме того, зафиксирован прирост ФВ ЛЖ с 59 до 65% (р<0,001). При анализе рецидивов трикуспидальной недостаточности в отдаленном послеоперационном периоде с применением хи-квадрата МакНемара не выявлено повышения частоты развития трикуспидальной недостаточнос-
Таблица 5 Динамика ЭхоКГ параметров двух группах в отдаленном послеоперационном периоде
|
Показатель |
I группа |
II группа |
Межгрупповое р отдаленное |
||||
|
После операции, n = 85 |
Отдаленный период, n = 79 |
р |
После операции, n = 86 |
Отдаленный период, n = 78 |
р |
||
|
ПП, ось, см |
|||||||
|
короткая |
4,2 (3,9; 4,4) |
4,1 (3,7; 4,5) |
0,604 |
4,1 (3,8; 4,5) |
4,2 (3,7; 4,6) |
0,467 |
0,708 |
|
длинная |
4,9 (4,6; 5,3) |
4,8 (4,5; 5,4) |
0,499 |
4,8 (4,4; 5,2) |
4,8 (4,3; 5,2) |
0,805 |
0,204 |
|
ЛП, ось, см |
|||||||
|
короткая |
4,5 (4,3; 4,9) |
4,5 (4,1; 5,1) |
0,707 |
4,5 (4,3; 4,9) |
4,4 (4; 4,9) |
0,242 |
0,481 |
|
длинная |
5,2 (4,9; 5,8) |
5,1 (4,6; 5,7) |
0,460 |
5,1 (4,8; 5,5) |
4,9 (4,5; 5,6) |
0,070 |
0,291 |
|
ТрН, степень, n (%) |
1 (1; 1) |
1 (1; 1) |
<0,001 |
1 (0; 1) |
1 (1; 1) |
0,132 |
0,649 |
|
≥ 2 |
3 (3,5) |
7 (8,9) |
0,343 |
2 (2,3) |
3 (3,8) |
1,000 |
0,191 |
|
КДР ПЖ, см |
2,5 (2,3; 2,8) |
2,6 (2,4; 2,8) |
0,055 |
2,5 (2,3; 2,7) |
2,5 (2,3; 2,7) |
0,275 |
0,174 |
|
S МО по Допплеру, см2 |
3,3 (3,1; 3,5) |
3,2 (3; 3,5) |
0,806 |
3,34 (3,1; 3,7) |
3,3 (3,1; 3,5) |
0,054 |
0,699 |
|
МН, степень, n (%) |
1 (0; 1) |
1 (1;1) |
<0,001 |
1 (0; 1) |
1 (1; 1) |
<0,001 |
0,262 |
|
≥ 2 |
5 (5,9) |
16 (20,3) |
0,029 |
5 (5,8) |
9 (11,5) |
0,428 |
0,136 |
|
≥ 3 |
– |
7 (9,7) |
– |
– |
1 (1,3) |
– |
0,031 |
|
Градиент на МК, мм рт. ст. |
|||||||
|
пиковый |
8,0 (6,7; 11) |
8,5 (6,9; 11) |
0,206 |
7 (5; 9,5) |
6 (4,4; 8,3) |
0,212 |
<0,001 |
|
средний |
3 (2,4; 4) |
3,7 (2,5; 4,1) |
0,288 |
2,8 (2;4) |
2,8 (1,9; 3,5) |
0,232 |
0,001 |
|
КДР ЛЖ, см |
5,03±0,53 |
4,82±0,67 |
0,135 |
5,04±0,52 |
4,83±0,47 |
0,017 |
0,908 |
|
КСР ЛЖ, см |
3,36±0,49 |
3,3±0,7 |
0,731 |
3,35±0,58 |
3,15±0,46 |
<0,001 |
0,263 |
|
КДО ЛЖ, мл |
120,9±32,6 |
111,2±42,7 |
0,487 |
123,4±32,3 |
105±23,1 |
0,001 |
0,375 |
|
КСО ЛЖ, мл |
44,5 (33,5; 58) |
35 (29; 46) |
0,130 |
45 (36; 63) |
38 (30; 43) |
<0,001 |
0,808 |
|
УО ЛЖ, мл |
73,1±20,2 |
67,6±21,1 |
0,317 |
72,8±19,9 |
67,1±18,3 |
0,107 |
0,907 |
|
ФВ ЛЖ, % |
61 (55; 65) |
61 (57; 66) |
0,518 |
59 (53; 64) |
65 (60; 69) |
<0,001 |
0,043 |
|
ФУ ЛЖ, % |
32,7±5,8 |
36,2±9,1 |
0,244 |
32,5±6,0 |
35,3±6,7 |
0,004 |
0,653 |
|
ЗСЛЖ, см |
1,1 (1; 1,2) |
1,1 (1; 1,3) |
0,477 |
1,1 (1; 1,3) |
1 (0,9; 1) |
0,551 |
0,006 |
|
МЖП, см |
1,1(1; 1,3) |
1,2 (1; 1,4) |
0,155 |
1,1 (1; 1,3) |
1 (1; 1,3) |
0,422 |
0,072 |
|
сДЛА, мм рт. ст. |
36 (33; 40) |
34,5 (28; 41) |
0,080 |
36,5 (33; 37) |
29,5 (23; 33) |
0,833 |
<0,001 |
ти ≥ 2-й степени (р = 1,000). В отличие от первой, во второй группе не было роста абсолютного риска МН ≥ 2-й степени в отдаленном периоде наблюдений – хи-квадрат МакНемара (р = 0,428). Учитывая цензурированность наблюдений, данные внутригрупповые различия оценены с помощью метода множественных оценок Каплана – Мейера.
Вторая группа по-прежнему характеризуется сравнительно меньшими пиковым и средним трансклапанными градиентами давления (р ≤ 0,001). Медианы (Q1; Q3) расчетного систолического давления составили 34,5 (28–41) в первой и 29,5 (23–33) мм рт. ст. во второй группе, р<0,001.
Свобода от МН ≥ 2-й степени в первой группе через 1 год после операции составила 92,6±3,2% (95% ДИ 83,0–96,8%); через 2 года – 80,8±6,5% (95% ДИ 64,0–90,3%); через 3 года – 44,0±15,1% (95% ДИ 15,5– 69,7%).
Свобода от МН ≥ 2-й степени во второй группе в течение 1 года после операции составила 94,6±2,6% (95% ДИ 86,3–97,9%); после 2 лет – 92,8±3,1% (95% ДИ 83,4– 97,0%); после 3 лет – 78,4±7,5% (95% ДИ 59,1–89,3%).
Анализ кривых свободы от возврата умеренной и выраженной митральной регургитации, проведенный с помощью лог-рангового критерия, выявил статистически значимые различия на уровне р = 0,002, что графически выражено по методу Каплана – Мейера на рис. 3.
Свобода от МН ≥ 3-й степени в первой группе в течение 1 года составила 95,8±2,4% (95% ДИ 87,4–98,6%); после 2 лет – 84,8±6,8% (95% ДИ 65,1–93,8%); после 3 лет – 63,6±19,1 (95% ДИ 19,1–88,3%).
Свобода от МН ≥ 3-й степени во второй группе через 1 год после операции составила 98,7±1,3% (95% ДИ 90,8–99,8%), через 2 и 3 года оставалась на прежнем уровне – 98,7±1,3% (95% ДИ 90,8–99,8%).
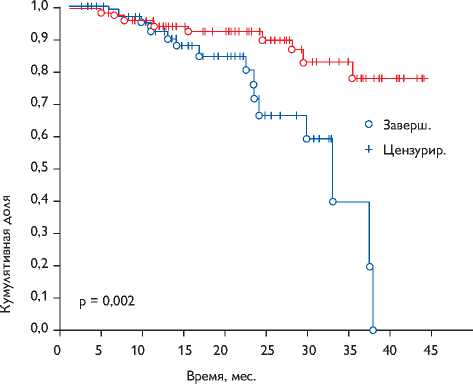
Живые пациенты, подверженные риску
|
Группа |
3 |
6 |
9 |
12 |
18 |
24 |
30 |
36 |
42 |
|
D RING |
79 |
75 |
71 |
57 |
32 |
18 |
9 |
2 |
0 |
|
C FLEX |
78 |
77 |
72 |
66 |
50 |
39 |
27 |
16 |
4 |
Рис. 3. Свобода от возвратной митральной регургитации в отдаленном послеоперационном периоде (Каплан – Майер)
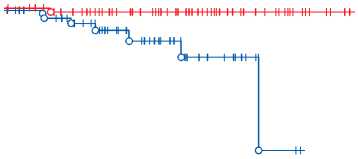
Анализ кривых свободы от возврата выраженной митральной регургитации, проведенный с помощью лог-рангового критерия, выявил статистически значимые различия на уровне р = 0,006 (рис. 4).
Предикторами возврата митральной регургитации при проведении однофакторного регрессионного анализа стали резидуальная МН (ОР 5,0; 95% ДИ 2,0– 12,5; р = 0,001), ишемическая болезнь сердца (ОР 1,9; 95% ДИ 1,1–3,2; р = 0,010) и расчетное систолическое давление (ОШ 1,03; 95% ДИ 1,01–1,06; р = 0,041). Дальнейшее исследование, проведенное с помощью многофакторного регрессионного анализа пропорциональных рисков Кокса (хи-квадрат – 12,0; сс = 3, р = 0,008), показало, что риск возврата значимой МН ( ≥ 2 степени) к следующему моменту времени в отдаленном послеоперационном периоде у пациентов с развившейся резидуальной МН в раннем послеоперационном периоде в 3,1 раза больше (95% ДИ 1,1–9,8; р = 0,035).
Обсуждение
Создание достаточной зоны кооптации является неотъемлемой задачей реконструкции МК и достигается не только вмешательством на створках и под- клапанных структурах, но и тщательным подбором опорного кольца [11, 12]. Оптимальной для достижения положительных долгосрочных результатов считается глубина кооптации 5–8 мм [11], в то же время глубина кооптации более 10–12 мм может способствовать развитию SAM-синдрома [13]. В среднем частота развития SAM-синдрома колеблется от 2–4 до 10–16% [13–17]. В нашем исследовании в случаях протезирования митрального клапана SAM-синдром развился у 5 пациентов (5,3%) в первой группе и ни у одного во второй (р = 0,025). При таком рассмотрении большая глубина кооптации в первой группе (7– 11 мм) как преимущество перед второй группой (5–8 мм) сомнительно. Так, мы рекомендуем имплантацию опорного кольца D ring при условии, что глубина кооптации противостоящих сегментов менее или равна 5 мм при удовлетворительной гидравлической пробе, при выборе смежных размеров предпочтительнее имплантация большего по диаметру опорного кольца. У пациентов с выраженной избыточностью тканей створок и дилатацией фиброзного кольца, требующей имплантации опорного кольца 34–36 мм и более, методом выбора должно быть использование гибкого полукольца C flex.
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
D RING
0,2
C FLEX
0,1
р = 0,006
0,0 Ч----------------1----------------1----------------1----------------1----------------1----------------1----------------1----------------1----------------1----------------1
0 5 10 15 20 25 30 35 40 45 50
Время, месяцы
Живые пациенты, подверженные риску
|
Группа |
3 |
6 |
9 |
12 |
18 |
24 |
30 |
36 |
42 |
|
D RING |
79 |
75 |
71 |
57 |
32 |
18 |
9 |
2 |
0 |
|
C FLEX |
78 |
77 |
72 |
66 |
50 |
39 |
27 |
16 |
4 |
Рис. 4. Свобода от выраженной возвратной митральной регургитации в отдаленном послеоперационном периоде (Каплан – Майер)
В раннем послеоперационном периоде опорное кольцо C flex демонстрирует показатели ремоделирования левых и правых отделов сердца, сопоставимые с D ring, но в отдаленном послеоперационном периоде, в отличие от него, процессы ремоделирования продолжаются. Отмечено значимое уменьшение КДР, КСР, КДО и КСО ЛЖ при неизмененном УО ЛЖ, а также достоверный прирост ФВ и ФУ ЛЖ, что согласуется с данными T. David [18], получившим такие результаты на меньшей выборке (13 и 12 пациентов) уже на госпитальном этапе.
Отрыв опорного кольца зафиксирован у 4 пациентов первой группы, и во всех случаях повторных операций причиной частичного отрыва опорного кольца стало прорезывание швов на створке. Это наблюдение подтверждается экспериментальными работами M. Jenses [19], J. Jimenz [20] L. Ryan [21], I.Salgo [22], показавшими, что жесткие опорные кольца ограничивают подвижность задней створки МК, вызывают развитие функционально «моностворчатого» клапана, увеличивают напряжение створок, натяжение подклапанных хорд и стресс между фиброзным и имплантированным жестким (в нашем случаев полужестким) опорным кольцом. Совокупность указан- ных факторов, возможно, привела к прорезыванию швов у наших пациентов и большой частоте реопераций в первой группе.
В более крупном рандомизированном исследовании группы из Кореи под руководством B. Chang [23] независимыми предикторами возвратной митральной регургитации при регрессионном анализе стали предшествующая выраженная ТрН ( ≥ 3-й степени) и резидуальная митральная регургитация ( ≥ 2-й степени) на 5–7-й день после операции. В нашем исследовании независимым предиктором возврата МН ≥ 2-й и ≥ 3-й степени стала резидуальная МН в раннем послеоперационном периоде с ОР 3,1 и 5,6 соответственно; предиктором резидуальной МН помимо прочего стала исходная ТрН с ОР 2,9, что согласуется с результатами авторов из Кореи.
В нашем исследовании болезнь Барлоу, а также пролапс передней створки, обеих створок или какого-либо отдельного сегмента не стали факторами риска неудач в отдаленном послеоперационном периоде, в отличие от более ранних работ [4, 24–26]. Миниинвазивные операции не привели к послеоперационным и клапан-связанным осложнениям и неструктурным дисфункциям МК. Размер импланти- руемого опорного кольца и использованные хирургические технологии (резекционные и протезирование хорд) не были факторами риска неудач в раннем и отдаленном послеоперационных периодах, в отличие от работ других авторов, где некоторые способы коррекции оказались предикторными [25, 27–30].
Резидуальную легочную гипертензию обнаружили более чем у 10% пациентов в каждой группе, несмотря на эффективную гемодинамическую коррекцию МН. Известно, что выраженная МН способствует гиперволемии малого круга кровообращения и посткапиллярной легочной гипертензии. Легочная гипертензия является предиктором неблагоприятных событий в послеоперационном периоде. Единственным методом лечения легочной гипертензии II типа (по международной классификации легочной гипертензии Dana Point 2008 г.), ассоциированной с пороками МК, является хирургическая коррекция порока. Возможным объяснением наличия легочной гипертензии у части пациентов в послеоперационном периоде при отсутствии МН и других причин может быть наличие прекапиллярного компонента, ответственного за патогенез легочной гипертензии у части больных.
Заключение
Использованный алгоритм хирургической коррекции пролапса передней и задней створок МК при болезни Барлоу и фиброэластическом дефиците позволил выполнить коррекцию МН с вероятностью сохранения МК более 90%, с нулевой операционной и ранней (90-дневной) летальностью. Имплантация опорного кольца D ring позволила достичь большей глубины кооптации створок, но была сопряжена с большим риском развития SAM-синдрома, в то время как кольцо C flex проводило более низкие трансмитральные градиенты давления. Частота развития ранних послеоперационных клапан-связанных осложнений после реконструкции МК на опорном кольце D ring и C flex при дисплазии соединительной ткани не превышала 6% и не зависила от типа имплантируемого опорного кольца, за исключением тран-зиторной ишемической атаки, которая наблюдалась чаще после имплантации D ring. Аннулопластика МК на опорных кольцах D ring и С flex при коррекции МН привела к улучшению функционального состояния, а также обратному ремоделированию камер сердца, что регистрировалось в раннем послеоперационном периоде и сохранялось в отдаленные сроки наблюдений. Частота развития резидуальной МН сопоставима в обеих группах и не превышала 6%. Ее предикторами были увеличение размеров правого предсердия, значимая трикуспидальная недостаточность, средний градиент на МК и конечный диастолический объем левого желудочка. Независимых предикторов резидуальной МН не выявлено. Выживаемость пациентов и функциональный класс в отдаленном периоде наблюдений не зависели от типа имплантированного опорного кольца. Свобода от реоперации и значимой возвратной МН в отдаленном периоде наблюдений достоверно выше при использовании опорного кольца C flex. Независимым предиктором возвратной МН является резидуальная митральная регургитация в раннем послеоперационном периоде.
Основное ограничение исследования – относительно небольшой срок наблюдений, составивший в среднем 2 и максимум 4 года, поэтому сформулированные выводы и рекомендации обоснованы для срока наблюдений до 2–3 лет. В перспективе требуется оценка отдаленных результатов в средние сроки наблюдений 5 и более лет.
Исследование выполнено при поддержке гранта Президента Российской Федерации МД-5046.2015.7. Авторы заявляют об отсутствии конфликтов интересов, связанных со статьей.
Список литературы Среднеотдаленные результаты реконструктивных операций на митральном клапане при дисплазии соединительной ткани с помощью опорных колец D ring и C flex
- Lillehei C.W., Gott V.L., Dewall R.A., Varco R.L. Surgical correction of pure mitral insufficiency by annuloplasty under direct vision//Lancet. 1957. Vol. 77. P. 446-449.
- Filsoufi F., Carpentier A. Principles of reconstructive surgery in degenerative mitral valve disease//Sem. Thorac. Cardiovasc. Surg. 2007. Vol. 19. № 2. P. 103-10. doi:10.1053/j. semtcvs.2007.04.003
- Brown M.L., Schaff H.V., Li Z., Suri R.M., et al. Results of mitral valve annuloplasty with a standard-sized posterior band: Is measuring important?//J. Thorac. Cardiovasc. Surg. 2009. Vol. 138. P. 886-91.
- Cosgrove D.M., Arcidi J.M., Rodriguez L., Stewart W.J., Powell K., Thomas J.D. Initial experience with the Cosgrove-Edwards annuloplasty system//Ann. Thorac. Surg. 1995. Vol. 60. P. 499-503.
- Lange R., Guenther T., Kiefer B., Noebauer C., Goetz W. et al. Mitral valve repair with the new semirigid partial Colvin-Galloway Future annuloplasty band//J. Thorac. Cardiovasc. Surg. 2008. Vol. 135. P. 1087-93.
- Назаров В.М., Железнев С.И., Желтовский Ю.В. и др. Коррекция митральной недостаточности с помощью опорных колец при дисплазии соединительной ткани//Сибирский медициинский журнал. 2013. № 8. С. 31-38.
- Богачев-Прокофьев А.В., Железнев С.И., Пивкин А.Н. и др. Сравнение биатриальной и левопредсердной процедуры радиочастотной аблации при коррекции клапанных пороков//Патология кровообращения и кардиохирургия. 2013. № 2. С. 12-16.
- Богачев-Прокофьев А.В., Железнев С.И., Пивкин А.Н. и др. Сравнение результатов конкомитантной процедуры MAZE III и радиочастотной аблации предсердий у пациентов с клапанными пороками сердца//Патология кровообращения и кардиохирургия. 2012. № 4. С. 9-14.
- Богачев-Прокофьев А.В., Железнев С.И., Пивкин А.Н. и др. Влияет ли тип аблационного устройства на результаты лечения фибрилляции предсердий при операциях на открытом сердце?//Патология кровообращения и кардиохирургия. 2013. № 2. С. 17-21.
- Железнев С.И., Богачев-Прокофьев А.В., Назаров В.М. и др. Отдаленные результаты хирургической процедуры maze у пациентов с клапанной патологией и фибрилляцией предсердий//Патология кровообращения и кардиохирургия. 2011. № 3. C. 17-21.
- Adams D.H., Rosenhek R., Falk V. Degenerative mitral valve regurgitation: best practice revolution//Eur. Heart J. 2010. Vol. 31. P. 1958-1967.
- Carpentier A. Cardiac valve surgery -the ‘‘French correction.’’//J. Thorac. Cardiovasc. Surg. 1983. Vol. 863. P. 23-37.
- Varghese R., Anyanwu A.C., Itagaki S., Milla F., Castillo J., Adams D.H. Management of systolic anterior motion after mitral valve repair: An algorithm//J. Thorac. Cardiovasc. Surg. 2012. Vol. 143. № 4. P. S2-S7 DOI: 10.1016/j.jtcvs.2012.01.063
- Brown M.L., Abel M.D., Click R.L., Morford R.G., Dearani J.A., Sundt T.M., et al. Systolic anterior motion after mitral valve repair: is surgical intervention necessary?//J. Thorac. Cardiovasc. Surg. 2007. Vol. 133. P. 136-43.
- Filsoufi F., Carpentier A. Systolic anterior motion of the mitral valve//J. Thorac. Cardiovasc. Surg. 2007. Vol. 134. № 1. P. 265-266.
- Quigley R.L. Prevention of systolic anterior motion after repair of the severely myxomatous mitral valve with an anterior leaflet valvuloplasty//Ann. Thorac. Surg. 2005. Vol. 80. № 1. P. 179-182.
- Zegi R., Carpentier A., Doguet F., et al. Systolic anterior motion after mitral valve repair: an exceptional cause of late failure//J. Thorac. Cardiovasc. Surg. 2005. Vol. 130. № 5. P. 1453-1454.
- David T.E., Komeda M., Pollick C. et al. Mitral valve annuloplasty: the effect of the type on left ventricular function//Ann. Thorac. Surg. 1989. Vol. 47. P. 524-527.
- Jensen M.O., Jensen H., Smerup M., Levine R.A., Yoganathan A.P., Nygaard H. et al. Saddle-shaped mitral valve annuloplasty rings experience lower forces compared with flat rings//Circulation. 2008. Vol. 118. P. s250-s255.
- Jimenez J.H., Liou S.W., Padala M., He Z., Sacks M., Gorman R.C. et al. A saddle-shaped annulus reduces systolic strain on the central region of the mitral anterior leaflet//J. Thorac. Cardiovasc. Surg. 2007. Vol. 134. P. 1562-8
- Ryan L.P., Jackson B.M., Hamamoto H., Eperjesi T.J., Plappert T.J., St.John M. et al. The influence of a annuloplasty geometry on mitral leaflet curvature//Ann. Thorac. Surg. 2008. Vol. 86. P. 749-60.
- Salgo I.S., Gorman J.H.III, Gorman R.C., Jackson B.M., Bowen F.M., Plappert T. et all. Effect of annular shape on leaflet curvature in reducing mitral leaflet stress//Circulation. 2002. Vol. 107. P. 711-7.
- Chang B.C., Youn Y.N., Ha J.W. et al. Long-term clinical results of mitral valvuloplasty using flexible and rigid rings: a prospective and randomized study//J. Thorac. Cardiovasc. Surg. 2007. Vol. 133. P. 995-1003.
- Carpentier A., Chauvaud S., Fabiani J.N., Deloche A., Relland J., Lessana A., et al. Reconstructive surgery of mitral valve incompetence: ten-year appraisal//J. Thorac. Cardiovasc. Surg. 1980. Vol. 79. P. 338-348.
- Flameng W., Meuris B., Herijgers P., Herregods M. Durability of mitral valve repair in Barlow disease versus fibroelastic deficiency//J. Thorac. Cardiovasc. Surg. 2008. Vol. 135. P. 274-282.
- Gillinov A.M., Cosgrove D.M. Mitral valve repair for degenerative disease//J. Heart Valve Dis. 2002. Vol. 11 (Suppl 1). P. S15-20.
- Gillinov A.M., Cosgrove D.M., Blackstone E.H. et al. Durability of mitral valve repair for degenerative disease//J. Thorac. Cardiovasc. Surg. 1998. Vol. 116. P. 737-743.
- Marwick T.H., Stewart W.J., Currie P.J., Cosgrove D.M. Mechanism of failure of mitral valve repair: an echocardiographic study//Am. Heart J. 1991. Vol. 122. P. 149-156.
- Mothy D., Orszulak T.A., Schaff H.V. Very long-term survival and durability of mitral valve repair for mitral valve prolapse//Circulation. 2001. Vol. 104 (Suppl 1). P. 1-7.
- Tesler U.F., Lanzillo G., Cerin G. Feasibility of mitral valve repair for degenerative insufficiency involving both leaflets//Int. Cardiol. Vasc. Thorac. Surg. 2006. Vol. 5 (Suppl 2). P. 220.


