Среднесрочные гемодинамические результаты биопротезирования аортального клапана протезом с уникальной системой «Easy change»
Автор: Эргашев Ш.С., Петлин К.А., Алямкин В.Е., Черных Ю.Н., Козлов Б.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Цель исследования: оценка гемодинамических результатов использования ксеноперикардиального биологического протеза «МедИнж-БИО» с системой «easy change» в аортальной позиции в среднесрочном периоде.Материал и методы. В кардиохирургическом отделении № 1 НИИ кардиологии Томского НИМЦ в период с октября 2016 по январь 2024 гг. была выполнена операция по протезированию аортального клапана (ПАК) с использованием инновационного биопротеза «МедИнж-БИО» с системой «easy change» 341 пациенту (155 женщин и 186 мужчин). Средний возраст пациентов 67,6 ± 6,6 года. В исследование включены 190 пациентов (88 женщин и 102 мужчины), которым было выполнено протезирование аортального клапана с использованием инновационного биопротеза «МедИнжБИО» с системой «easy change» в период с января 2017 по январь 2022 гг. Средний возраст пациентов 67,6 ± 6,6 лет. Средний градиент давления на аортальном клапане до операции составлял 48,2 ± 13,5 мм рт. ст. Эффективная площадь отверстия (ЭПО) аортального клапана в среднем составила 0,72 ± 0,2 см2 . Контрольные эхокардиографические исследования функции левого желудочка (ЛЖ) и аортального биопротеза после операции выполняли на 10-14-е сут после операции и через 3-5 лет после выписки на аппаратах Vivid 7, GE и IE 33 («Philips»).Результаты. Контрольные эхокардиографические исследования, проведенные в среднесрочном периоде, позволили установить, что гемодинамические характеристики аортальных протезов «МедИнж-БИО» в аортальной позиции остаются удовлетворительными. Средний градиент давления на протезах «МедИнж-БИО» 21 размером составил 22,6 мм рт. ст., 23 размером - 15,1 мм рт. ст. и 25 размером - 10,3 мм рт. ст.Заключение. Исходя из полученных данных, можно сделать вывод, что ксеноперикардиальные биопротезы «МедИнжБИО» с системой «easy change» хорошо корригируют внутрисердечную гемодинамику в сроке наблюдения более 3 лет и не демонстрируют признаков дегенерации.
Аортальный клапан, стеноз аортального клапана, протезирование аортального клапана, биологический протез
Короткий адрес: https://sciup.org/149145660
IDR: 149145660 | УДК: 616.126.52-77-089.844-079.8 | DOI: 10.29001/2073-8552-2024-39-2-86-93
Текст научной статьи Среднесрочные гемодинамические результаты биопротезирования аортального клапана протезом с уникальной системой «Easy change»
Дегенеративное поражение аортального клапана является прогрессирующим заболеванием, которое характеризуется постепенным разрушением структуры и функции клапана. Оно может привести к серьезным последствиям, таким как сердечная недостаточность, аритмия и смерть. Хирургическое лечение дегенеративного аортального стеноза имеет более чем полувековую историю и до сих пор является единственным эффективным методом лечения, так как результативной медикаментозной терапии не существует [1]. Обновленные в 2021 г. рекомендации ESC / EACTS по лечению пациентов с клапанной патологией также указывают на то, что протезирование (замена) аортального клапана должна выпол- няться дaже бeссимптомным пaциентам с кpитическим аoртальным стенозом [2].
На протяжении последних лет наблюдается тенденция увеличения числа операций у больных старше 65-летнего возраста [3]. Этот факт связан с постоянным развитием хирургических технологий и методов обеспечения операций на сердце. Биологические протезы являются предпочтительным выбором для пациентов старшего возраста при необходимости замены аортального клапана [4].
Отделениесердечно-сосудистойхирургииНИИкардио-логии Томского НИМЦ (г. Томск) имеет первый и самый большой опыт в России по имплантации инновационного составного каркасного ксеноперикардиального биологического протеза в аортальную позицию. Предложенная работа представляет собой оценку среднесрочных результатов протезирования аортального клапана биологическим протезом «МедИнж-БИО» на основе 190 случаев имплантации.
Материал и методы
В кардиохирургическом отделении № 1 НИИ кардиологии Томского НИМЦ в период с октября 2016 по январь 2024 гг. было выполнено оперативное вмешательство по протезированию аортального клапана с использованием инновационного биологического протеза «МедИнж-БИО» с системой «easy change» 341 пациенту (155 женщин и 186 мужчин). Средний возраст пациентов составил 67,6 ± 6,6 лет. В исследование включены 190 пациентов (88 женщин и 102 мужчины), которым было выполнено протезирование аортального клапана с использованием инновационного биологического протеза «МедИнж-БИО» с системой «easy change» в период с января 2017 по январь 2022 гг.
Основной причиной формирования порока аортального клапана было развитие дегенеративного стеноза – 96,5% от всех пациентов, подвергшихся оперативному вмешательству. Диагноз «инфекционный эндокардит» поставлен 6 пациентам (2,6%); диагноз «ревматический порок аортального клапана» поставлен 2 пациентам (1,0%). Функциональный класс сердечной недостаточности III и выше по New York Heart Association (NYHA) встречался в 63,6% случаев. Гемодинамические показатели аортального клапана на эхокардиографическом исследовании в дооперационном периоде соответствовали тяжелой степени стеноза. Эффективная площадь отверстия (ЭПО) аортального клапана в среднем составила 0,72 ± 0,2 см2; ЭПО, индексированная к площади поверхности тела (iЭПО), – 0,36 ± 0,1 см2/м2; средний градиент давления аортального клапана составил 48,2 ± 13,5 мм рт. ст. Регургитация 3-й степени выявлена у 36 пациентов. Дооперационные антропометрические и клинические данные представлены в таблице 1.
Таблица 1. Параметры пациентов до операции
Table 1. Patient parameters before surgery
|
Пол (мужчины : женщины) |
102 : 88 |
|
Средний возраст, лет |
67,6 ± 6,6 |
|
Средняя площадь поверхности тела, м2 |
1,86 ± 0,14 |
|
ФК по NYHA III / IV, n |
121 |
|
Этиология порока, n : |
190 |
|
Дегенеративный |
183 |
|
Ревматический |
2 |
|
Инфекционный эндокардит |
5 |
|
Эффективная площадь отверстия аортального клапана, см2 |
0,72 ± 0,2 |
|
Индексированная эффективная площадь отверстия аортального клапана, см2/м2 |
— 0,369 ± 0,1 |
|
Пиковый градиент, мм рт. ст. |
85,6 ± 24,5 |
|
Средний градиент, мм рт. ст. |
48,2 ± 13,5 |
Примечание: ФК – функциональный класс сердечной недостаточности по NYHA.
Было выполнено 190 оперативных вмешательств; из них изолированное протезирование аортального клапана – 82 пациентам; сочетанные вмешательства – 108 пациентам. Среди них протезирование аортального клапана в сочетании с коронарным шунтированием было выполнено 70 пациентам; аортоаннулопластика фиброзного кольца аортального клапана (с фиброзным кольцом аортального клапана менее 20 мм) – 14 пациентам; протезирование восходящей аорты по типу Hemiarch – 19 пациентам. В их число входят 6 пациентов, перенесших процедуру Бенталл де Боно с использованием биологического клапансодержащего кондуита. Кроме того, симультанные вмешательства на митральном клапане были выполенны 5 пациентам (табл. 2).
Таблица 2. Виды выполненных оперативных вмешательств
Table 2. Types of performed surgeries
|
Общее количество выполненных оперативных вмешательств, n |
190 |
|
Из них: Изолированное протезирование аортального клапана, n |
82 |
|
Сочетанные вмешательства, n : |
108 |
|
Коронарное шунтирование |
70 |
|
Протезирование восходящей аорты |
19 |
|
Вмешательства на митральном клапане |
5 |
|
Расширение корня аорты |
14 |
Оценку гемодинамических показателей с использованием трансторакального эхокардиографического исследования на аппаратах Vivid 7, GE и IE 33 («Philips») проводили перед выпиской пациента из стационара (на 10–14-е сут после операции), и в среднем через 3–5 лет после операции. Функцию протеза оценивали по показателям пикового и среднего градиентов давления на протезе, рассчитанных из скорости транспротезного потока при допплерографии. Для выявления дегенерации протеза отслеживали динамику изменения показателя ЭПО, рассчитанную по формуле:
ЭПО = 5ВТЛЖ X — (см2);
VTI2 v 7
где SВТЛЖ – площадь выводного тракта левого желудочка (ЛЖ) (см2), VTI1 – субаортальный интеграл скорости (см), VTI2 – аортальный интеграл скорости (см).
Для оценки влияния имплантации протеза на внутрисердечную гемодинамику определяли ультразвуковые показатели состояния ЛЖ: фракцию выброса, конечно-диастолический (КДО) и конечно-систолический объемы (КСО), конечно-диастолический (КДИ) и конечно-систолический индексы (КСИ). Уменьшение гипертрофии миокарда оценивали по показателям массы миокарда, индекса массы миокарда, толщины межжелудочковой перегородки.
Статистическую обработку полученных данных проводили с помощью пакета программ STATISTICA 10.0 for Windows. Нормальность закона распределения количественных показателей проверяли с помощью критерия Шапиро – Уилка. Показатели, подчиняющиеся нормальному закону распределения, описывали с помощью среднего значения ( M ) и стандартного отклонения ( SD ) , M ± SD . Для выявления статистически значимых различий количественных показателей в динамике использовали дисперсионный анализ повторных измерений (Repeated Measures ANOVA) и парный критерий Стьюдента. Для графического представления динамики выживаемости в среднесрочном периоде использовались кривые Каплана – Мейера. Критический уровень статистической значимости при проверке гипотез составлял 0,05.
Результаты
Длительность искусственного кровообращения при изолированном протезировании аортального клапана в среднем составляла 89,97 ± 19,8 мин, тогда как при сочетанных операциях – 110,1 ± 36,2 мин. Среднее время пережатия аорты при изолированном протезировании аортального клапана составляло 68,64 ± 15,1 мин.
Атриовентрикулярная блокада, потребовавшая имплантации электрокардиостимулятора, развилась у 3 пациентов, что составляет 0,9% от всех операций. Протез- ный эндокардит и сепсис зафиксированы у 3 пациентов (0,9%).
Максимальный срок наблюдения после выписки составляет 90 мес. После выписки из стационара в течение этого периода умерли 15 пациентов. У 9 пациентов причина смерти – сердечно-сосудистые заболевания, не связанные с дисфункцией протеза, у 4 – онкологические заболевания, у 2 – COVID-19. Из 9 пациентов с сердечно-сосудистой смертностью в 5 случаях причина – инфаркт миокарда, в 3 случаях – инсульт, в 1 – сепсис (рис. 1.)
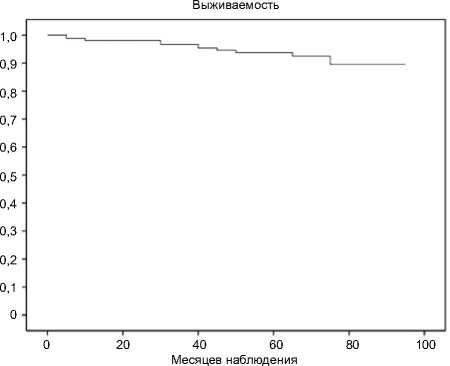
Рис. 1. Кривая Каплана – Мейера общей выживаемости после протезирования аортального клапана
Fig. 1. Kaplan – Meier curve for overall survival after aortic valve replacement
В среднесрочном периоде наблюдения (в среднем через 3–5 лет после выписки) отмечены удовлетворительные результаты контрольного эхокардиографического исследования гемодинамических показателей протеза «МедИнж-БИО» у 190 исследуемых пациентов. В течение всего периода наблюдения отмечается статистически значимое уменьшение массы миокарда на 14,6%, что свидетельствует о положительном ремоделировании ЛЖ в результате нормализации внутрисердечной гемодинамики (табл. 3).ЭПО протезов «МедИнж-БИО» размером
21 мм в среднесрочном периоде составила 0,86 см2, размером 23 мм – 1,12 см2, размером 25 мм – 1,41 см2. В 21 размере в среднесрочном периоде наблюдения отмечается достоверное уменьшение площади на 14,8% и увеличение среднего градиента на 12%. В 23 размере протеза, несмотря на достоверное уменьшение площади на 13,8%, наблюдается уменьшение среднего градиента на 12,7%. Похожая картина прослеживается и в 25 размере протеза – достоверное уменьшение ЭПО на 8,4% и среднего градиента на 31% (табл. 4).
Таблица 3. Динамика изменений функции левого желудочка
Table 3. Changes in left ventricular function
|
Параметры |
До операции |
После операции |
Через 3–5 лет |
p |
|
Фракция выброса, % |
61,2 ± 9,7 |
63,2 ± 7,5 |
66,7 ± 6,2 |
0,7 |
|
КДО, мл |
110,9 ± 27,7 |
107,7 ± 26,3 |
105,7 ± 22,7 |
0,07 |
|
КСО, мл |
43,4 ± 18,9 |
41,24 ± 17,2 |
35,9 ± 13,4 |
0,08 |
|
КДИ |
59,3 ± 1,96 |
55,25 ± 13,5 |
56,1 ± 11,1 |
0,8 |
|
КСИ |
23,3 ± 10,03 |
25,5 ± 13,1 |
19,1 ± 6,8 |
0,3 |
|
Межжелудочковая перегородка, мм |
13,3 ± 1,9 |
13,3 ± 1,6 |
12,5 ± 1,7 |
0,3 |
|
Масса миокарда, г |
240,8 ± 54,1 |
222,6 ± 44,8 |
205,7 ± 46,5 |
0,01 |
Примечание: КДО – конечно-диастолический объем, КСО – конечно-систолический объем, КДИ – конечно-диастолический индекс, КСИ – конечно-систолический индекс.
Таблица 4. Динамика изменения эффективной площади отверстия после протезирования
Table 4. Changes in the effective orifice area of aortic valve after prosthetics
|
Параметры |
До операции |
После операции |
Через 3–5 лет |
||||
|
21-й размер |
23-й размер |
25-й размер |
21-й размер |
23-й размер |
25-й размер |
||
|
Эффективная площадь |
0,72 ± 0,2 |
1,01 ± 0,07 |
1,30 ± 0,11 |
1,54 ± 0,1 |
0,86 ± 0,12 |
1,12 ± 0,1 |
1,41 ± 0,28 |
|
отверстия, см2 |
p = 0,002* |
p = 0,0001* |
p = 0,002* |
p = 0,01** |
p = 0,02** |
p = 0,04** |
|
Окончание табл. 2
End of table 2
|
Параметры |
До операции |
После операции |
Через 3–5 лет |
||||
|
21-й размер |
23-й размер |
25-й размер |
21-й размер |
23-й размер |
25-й размер |
||
|
Пиковый градиент, мм рт. ст. |
85,6 ± 24,5 |
43,9 ± 12,9 р = 0,0003* |
33,9 ± 12,2 р = 0,0002* |
29,1 ± 9,2 р = 0,0003* |
43,4 ± 14,9 р = 0,03** |
30,2 ± 12,6 р = 0,008** |
19,7 ± 6,9 р = 0,04** |
|
Средний градиент, мм рт. ст. |
48,16 ± 13,5 |
20,1 ± 7,9 р = 0,00004* |
17,3 ± 7,3 р = 0,0002* |
15 ± 4,9 р = 0,0077* |
22,6 ± 9,3 р = 0,03** |
15,1 ± 7,2 р = 0,008** |
10,3 ± 3,4 р = 0,04** |
|
DVI |
– |
0,361 ± 0,06 |
0,406 ± 0,16 |
0,389 ± 0,07 |
0,294 ± 0,02 |
0,419 ± 0,06 |
0,367 ± 0,08 |
|
AT / ET |
– |
0,328 ± 0,05 |
0,31 ± 0,04 |
0,327 ± 0,04 |
0,328 ± 0,02 |
0,286 ± 0,01 |
0,314 ± 0,06 |
Примечание: * – при сравнении с дооперационными показателями, ** – при сравнении с показателями при выписке. DVI = V волж / V на протезе (отношение скорости потока в ВОЛЖ к скорости потока на ПАК); AT / ET – отношение времени акселерации потока на протезе к общему времени изгнания крови из ЛЖ.
Исходя из вышеприведенных данных, уменьшение площади клапанов может быть связано как с увеличением жесткости створок со временем, так и с погрешностью измерения выводного отдела ЛЖ (ВОЛЖ). Увеличение площади ВОЛЖ связано с ремоделированием ЛЖ (уменьшение гипертрофии), которое, в свою очередь, приводит к уменьшению расчетной эффективной площади отверстия клапана, исходя из описанной выше формулы вычисления ЭПО. Это объясняет, почему, несмотря на уменьшение ЭПО, средний градиент на протезах 23 и 25 размера снизился. Учитывая то, что изначально на 21 размере протеза отмечается самый высокий градиент давления, а высокие градиенты давления могут приводить к ускорению дегенерации, то, скорее всего, увеличение среднего градиента давления на 21 размере протеза может быть связано с увеличением жесткости створок. Но дальнейшие наблюдения позволят уточнить данное утверждение.
Обсуждение
На сегодняшний день аортальный стеноз (АС) является наиболее распространенным среди заболеваний клапанов сердца в развитых и развивающихся странах с высоким уровнем дохода, причем его распространенность увеличивается с возрастом. Наиболее часто встречающейся формой является дегенеративный и кальцинирующий АС, вызванный фиброкальцифицирующими изменениями створок аортального клапана.
Данный патологический процесс обусловлен факторами риска, сходными с таковыми при системном атеросклерозе. Дегенеративное поражение аортального клапана является прогрессирующим заболеванием, которое характеризуется постепенным изменением с последующим разрушением структуры и функции клапана. Дегенерация клапанных створок приводит к механической обструкции с прогрессивно возрастающей перегрузкой давлением ЛЖ. Это, в свою очередь, индуцирует компенсаторный механизм ремоделирования ЛЖ и последующей гипертрофии. Переломным моментом является то, что ЛЖ больше не может поддерживать нормальный ударный объем и нормальное давление наполнения в условиях перегрузки давлением, что может привести к серьезным последствиям, таким как прогрессирующая сердечная недостаточность, аритмия и последующая смерть.
Применение тактики хирургического вмешательства является единственным эффективным методом лечения АС, поскольку медикаментозная терапия не может устранить стеноза аортального клапана, но может использоваться для стабилизации состояния пациента до операции или в качестве симптоматической терапии. Исследования показывают, что при наличии симптомов АС, независимо от его типа и степени тяжести, рекомендуется проведение оперативного вмешательства в виде протезирования аортального клапана [5].
В настоящее время для замены аортального клапана используются механические и биологические протезы. Механические протезы считаются самыми надежными. Самые распространенные среди них двустворчатые механические клапаны, которые не подвержены дегенеративным изменениям, но при этом они требуют пожизненного приема антикоагулянтов и контроля МНО (международное нормализованное отношение). Пациенты с механическим протезом клапана сердца при отсутствии контроля антикоагулянтной терапии всегда находятся в группе высокого риска в отношении тромбоэмболических и геморрагических осложнений.
Биологические протезы изготавливаются из ксенобио-тических тканей, таких как свиные аортальные клапаны и бычий перикард, которые обрабатываются и пришиваются к металлическому или полимерному стенту и имитируют нативные сердечные клапаны по структуре и функциям. Биологические протезы обеспечивают центральный поток крови, что является неоспоримым преимуществом по сравнению с механическими [7]. Более того, свобода от использования антикоагулянтов снижает риск тромбогеморрагических осложнений в послеоперационном периоде, что, в свою очередь, улучшает качество жизни пациентов.
Несмотря на то, что современные биопротезы обеспечивают удовлетворительную гемодинамику, сходную с таковой при работе нативного клапана, «идеального» биопротеза до сих пор не существует. Имплантация протеза клапана сердца всегда инициирует несколько патофизиологических процессов, которые могут привести к структурной дегенерации протеза и прогрессирующему клиническому ухудшению. Гемодинамическая дисфункция биологического протеза (стеноз или недостаточность) может возникнуть в результате неструктурного (тромбоз протеза, протезный эндокардит и парапротезная фистула) или структурного повреждения протеза.
Структурные повреждения биопротеза характеризуются фиброкальциническим ремоделированием, утолщением створок протеза или разрушением коллагеновых волокон и последующим разрывом или перфорацией створок. Однако, несмотря на непродолжительный срок службы 10–15 лет и возможный риск дегенеративных изменений, биологические протезы являются предпочтительным выбором для пациентов старшего возраста при необходимости замены клапана в аортальной позиции.
Современные исследования в области кардиологии и кардиохирургии направлены на изучение различий в исходах операций по протезированию аортального клапана с использованием механических и биологических протезов. Согласно последним данным, смертность у пациентов в возрастной группе старше 55 лет достоверно не различается после протезирования аортального клапана биологическим или механическим протезом [6, 7].
Несмотря на широкий выбор протезов для замены аортального клапана, на сегодняшний день каркасные ксеноперикардиальные биологические протезы являются одними из наиболее распространенных протезов при замене аортального клапана из-за их отличной совместимости с тканями организма, хорошей функциональной производительности и отсутствия необходимости в длительной антикоагулянтной терапии. Тем не менее, даже с использованием передовых методов обработки биологических тканей со временем все биологические протезы подвергаются дегенеративным изменениям с дальнейшей дисфункцией, что неизбежно приводит к необходимости повторного хирургического вмешательства для замены клапана.
Дегенерация биологических протезов является сложным процессом, вызванным различными патофизиологическими механизмами. Последние опубликованные исследования представили доказательства того, что в патогенезе дегенерации имеют место множественные активные процессы, которые включают в себя атеросклерозоподобное изменение тканей, кальцификацию (накопление кальция), фиброз (образование соединительной ткани), деградацию коллагена и хроническое иммунное отторжение [8]. Патогенез атеросклерозоподобных изменений биологических протезов аналогичен процессу развития атеросклероза в сосудах. В тканях протеза может происходить отложение холестерина, кальция и других веществ, формирование жировых бляшек, фиброз и кальцификация. Эти изменения могут привести к утрате эластичности и функциональности тканей протеза, что в конечном итоге вызывает его дегенерацию.
Биологические протезы, включая ксеноперикардиальные, представляют собой чужеродные материалы, введенные в организм человека. Поэтому иммунная система может реагировать на них, как на инородное тело. Долгосрочное иммунное отторжение протеза может привести к хроническому воспалению в области имплантации протеза и активации иммунных клеток, таких как макрофаги и лимфоциты. Это, в свою очередь, может способствовать дегенерации тканей и изменениям в структуре протеза.
Понимание патогенеза дегенерации биологических протезов аортального клапана имеет большое значение для разработки стратегий предотвращения и лечения этого процесса. Дальнейшие исследования в этой области помогут выявить новые мишени для терапии, что даст толчок к разработке инновационных методов обработки тканей протезов, направленных на улучшение их долговечности и уменьшение риска дегенерации. Это позволит сделать биологические протезы более эффективными и долговечными для пациентов, нуждающихся в замене аортального клапана.
По данным клинических рекомендаций American College of Cardiology/American Heart Association от 2020 г. и European Society of Cardiology/European Association for Cardio-Thoracic Surgery от 2021 г., протезирование аортального клапана биологическим протезом показано следующим пациентам: пациенты в возрасте 65 лет и старше. Это связано с ограниченным сроком службы биологических протезов, который может составлять от 10 до 15 лет, поэтому для более молодых пациентов это может означать необходимость повторной операции.
Женщинам, планирующим беременность, также рекомендуется имплантация биологического протеза, так как в случае установки механического протеза требуется постоянный прием антикоагулянтов для предотвращения тромбообразования, что может представлять опасность как для матери, так и для плода во время беременности. Биологические протезы уменьшают эту потребность, снижая риск осложнений. Лица, не способные контролировать прием антикоагулянтной терапии или имеющие противопоказания к их приему по каким-либо причинам, также являются кандидатами на получение биологического протеза. Например, это может быть связано с историей серьезных кровотечений или сложностями в поддержании стабильности уровня МНО, что существенно повышает риск серьезных осложнений при использовании механических клапанов. [9, 10].
Каркасный ксеноперикардиальный биологический протез «МедИнж-БИО» разработанный НПО «МедИнж» (г. Пенза, Россия) в 2016 г. с системой «easy change», представляет собой новый взгляд на реоперации на аортальном клапане в аспекте минимизации хирургической травмы. Особая конструкция позволяет отдельно имплантировать в фиброзное кольцо клапана сердца манжету от самого протеза, что облегчает установку клапана в манжету и дает возможность придавать ему желаемую ориентацию. Одной из проблем при имплантации сердечных клапанов является необходимость точной ориентации протеза для оптимального кровотока и предотвращения парапротезной фистулы. Система «easy change» делает возможным многократную корректировку ориентации клапана даже после начальной имплантации, что обеспечивает лучшие исходы операции.
Уникальная конструкция, позволяющая отдельно имплантировать манжету протеза в фиброзное кольцо, облегчает сам процесс установки клапана, а также снижает вероятность ошибок при установке, уменьшает продолжительность операции и обеспечивает точную ориентацию протеза. Точная ориентация и стабильная фиксация протеза критически важны для оптимальной работы клапана и минимизации риска таких осложнений, как пара-протезная фистула.
При необходимости реимплантации клапана система «easy change» позволяет значительно упростить процесс эксплантации старого протеза и установки нового. В традиционных моделях биологических протезов, где протез тесно интегрируется с окружающими тканями сердца, удаление может быть сложным и рискованным, особенно если произошла кальцификация ткани вокруг протеза.
Конструкция биологического протеза «МедИнж-БИО», позволяющая отдельно менять компоненты протеза, дает ряд преимуществ и при дисфункции протеза: можно извлечь только сам клапан, оставив манжету на месте, если она находится в удовлетворительном состоянии. Это уменьшает травматичность операции, сокращает время и количество периоперационных осложнений, связанных с эксплантацией протеза, и дает возможность малотравматичной замены протеза.
Кроме того, конфигурация биологического протеза позволяет использовать альтернативные методы имплантации и реимплантации при миниинвазивном доступе или применении эндоваскулярных методов лечения для пациентов с высоким операционным риском и тех, кто плохо переносит обширные хирургические процедуры.
Заключение
В настоящей статье описан более чем пятилетний опыт команды кардиохирургов НИИ кардиологии Томского НИМЦ по имплантации протезов «МедИнж-БИО» не только в аортальную, но в митральную и трикуспидальную позиции [11]. Ранее нами была опубликована статья о четырехлетнем опыте имплантации каркасного
Список литературы Среднесрочные гемодинамические результаты биопротезирования аортального клапана протезом с уникальной системой «Easy change»
- Goldbarg S.H., Elmariah S., Miller M.A., Fuster V. Insights into degenerative aortic valve disease. J. Am. Coll. Cardiol. 2007;50(13):1205-1213. https://doi.org/10.1016/j.jacc.2007.06.024.
- Vahanian A., Beyersdorf F., Praz F., Milojevic M., Baldus S., Bauersachs J. ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur. Heart J. 2022;43(7):561-632. https://doi.org/10.1093/eurheartj/ehab395.
- Шипулин В.М., Пряхин А.С., Андреев С.Л., Шипулин В.В., Козлов Б.Н. Современное состояние проблемы хирургического лечения ишемической кардиомиопатии. Кардиология. 2019;59(9):71-82. https://doi.org/0.18087//cardio.2019.9.n329.
- Goldstone A.B., Chiu P., Baiocchi M., Lingala B., Patrick W.L., Fischbein M.P. et al. Mechanical or biologic prostheses for aortic-valve and mitral-valvereplacement. N. Engl. J. Med. 2017;377(19):1847-1857. https://doi.org/10.1056/NEJMoa1613792.
- Reynolds M.R., Magnuson E.A., Lei Y., Wang K., Vilain K., Li H. et al. PARTNER Investigators. Cost-effectiveness of transcatheter aortic valve replacement compared with surgical aortic valve replacement in high-risk patients with severe aortic stenosis: Results of the PARTNER (Placement of Aortic Transcatheter Valves) trial (Cohort A). J. Am. Coll. Cardiol. 2012;60(25):2683-2692. https://doi.org/10.1016/j.jacc.2012.09.018.
- Козлов Б.Н., Петлин К.А., Косовских Е.А., Пряхин А.С., Шипулин В.М., Врублевский А.В. и др. Результаты использования каркасного ксеноперикардиального биопротеза с системой «easy change» в аортальной позиции: 12 мес после имплантации. Клин. и эксперимент. хир. журн. им. акад. Б.В. Петровского. 2020;8(2):45-50. https://doi.org/10.33029/2308-1198-2020-8-2-45-50.
- Goldstone A.B., Chiu P., Baiocchi M., Lingala B., Patrick W.L., Fischbein M.P. et al. Mechanical or biologic prostheses for aortic-valve and mitral-valve replacement. N. Engl. J. Med. 2017;377(19):1847-1857. https://doi.org/10.1056/NEJMoa1613792.
- Côté N., Pibarot P., Clavel M.A. Incidence, risk factors, clinical impact, and management of bioprosthesis structural valve degeneration. Curr. Opin. Cardiol. 2017;32(2):123-129. https://doi.org/10.1097/HCO.0000000000000372.
- Otto C.M., Nishimura R.A., Bonow R.O., Carabello B.A., Erwin J.P. 3rd, Gentile F. et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease: Executive summary: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143(5):e35-e71. https://doi.org/10.1161/CIR.0000000000000932.
- Peters A.S., Duggan J.P., Trachiotis G.D., Antevil J.L. Epidemiology of valvular heart disease. Surg. Clin. North. Am. 2022;102(3):517-528. https://doi.org/10.1016/j.suc.2022.01.008.
- Козлов Б.Н., Петлин К.А., Косовских Е.А., Шипулин В.М., Панфилов Д.С., Черных Ю.Н. Непосредственные результаты использования каркасного ксеноперикардиального биопротеза в митральной позиции с системой «easy change». Сибирский журнал клинической и экспериментальной медицины. 2020;35(1):54-60. https://doi.org/10.29001/2073-8552-2020-35-1-54-60.
- Петлин К.А., Косовских Е.А., Томилин В.А., Арсеньева Ю.А., Козлов Б.Н. Результаты использования каркасного ксеноперикардиального биопротеза в аортальной позиции с системой «easy change», четырехлетний опыт имплантации. Сибирский журнал клинической и экспериментальной медицины. 2021;36(1):117-122. https://doi.org/10.29001/2073-8552-2021-36-1-117-122.


