Стабильная трансфекция нескольких плазмидных векторов посредством транспозонной системы "Sleeping beauty"
Автор: Набережнов Д.С.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Биологические науки
Статья в выпуске: 11-1 (74), 2022 года.
Бесплатный доступ
Транспозонная система «Sleeping Beauty» широко используется в молекулярной биологии, как система невирусной доставки плазмидной ДНК для получения клеточных линий стабильно экспрессирующих белок гена интереса. Для различных приложений молекулярной биологии требуется экспрессия нескольких белков в одной клетке. Нами было продемонстрированно, что транспозонная система «Sleeping Beauty» может быть использована для получения стабильных клеточных линий, экспрессирующих несколько трансгенных белков.
Экспрессия трансгенов, транспозонная система sleeping beauty, множественная трансфекция, стабильная трансфекция клеток
Короткий адрес: https://sciup.org/170197255
IDR: 170197255 | DOI: 10.24412/2500-1000-2022-11-1-25-28
Текст научной статьи Стабильная трансфекция нескольких плазмидных векторов посредством транспозонной системы "Sleeping beauty"
Трансфекция. За 5 часов до трансфекции клеточную среду меняли. Клетки трансфицировали с использованием TurboFect (Thermo Fisher Scientific, США) в соответствии с протоколом производителя. Плазмиды были смешаны в отношении 1:1:6 соответственно pSB-IR-CAG-BleoR-T2A-eGFP : pSB-IR-CAG-BleoR-T2A-mCherry : pCMV(CAT)T7-SB100. Плаз- мидную ДНК для трансфекции выделяли при помощи набора Наборы Plasmid Miniprep (Evrogen, Россия) получали, в соответствии с протоколом производителя. Через двое суток среду меняли и добавляли среду с антибиотиком зеоцин для селекции в концентрации 100 мкг/мл.
Проточная цитометрия. Клетки отделяли от поверхности 24-луночного планшета при помощи раствора 0,25% трипсина (Панэко, Россия) и раствора Версена (Панэко, Россия), промывали и ресуспен-дировали в растворе Дюльбекко (Панэко, Россия). Образцы анализировали с использованием проточного цитометра FACSCalibur (BD, США), используя канал FL1 и FL2. Данные анализировали с помощью программного обеспечения Flowing Software 2. Статистический анализ проводили с использованием t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Для множественной стабильной трансфекции нами было использовано две плазмиды с генами флуоресцентных белков eGFP и mCherry и геном устойчивости к антибиотику Zeocin (рис. 1).
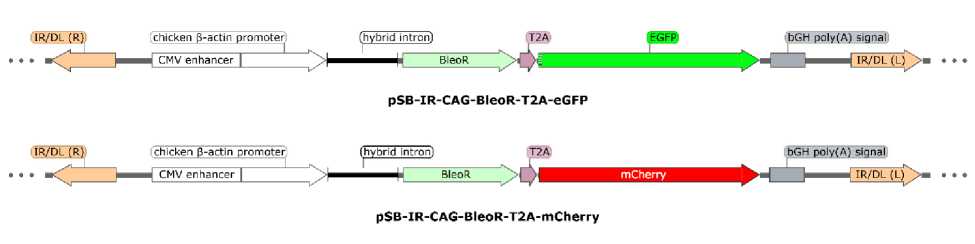
Рис. 1. Генетические карты плазмид, используемых для стабильной трансфекции
Флуоресцентные белки позволяют легко идентифицировать клетки со стабильной трансформацией, а ген устойчивости к антибиотику позволяет провести селекцию клетки, в которых произошла стабильная интеграция. Плазмида, содержащая белок eGFP (pSB-IR-CAG-BleoR-T2A-eGFP) и плазмида, содержащая белок mCherry (pSB-IR-CAG-BleoR-T2A-mCherry) были трансфицированы в клетки HEK293T вме- сте с плазмидой, содержащей транспозон (pCMV(CAT)T7-SB100), после чего клетки, селектировались на стабильную трансформацию антибиотиком Zeocin. В качестве контроля использовалась смесь плазмид без SB100X. Полученные клеточные линии анализировались при помощи проточной цитометрии, результаты которой представлены на рисунке 2.
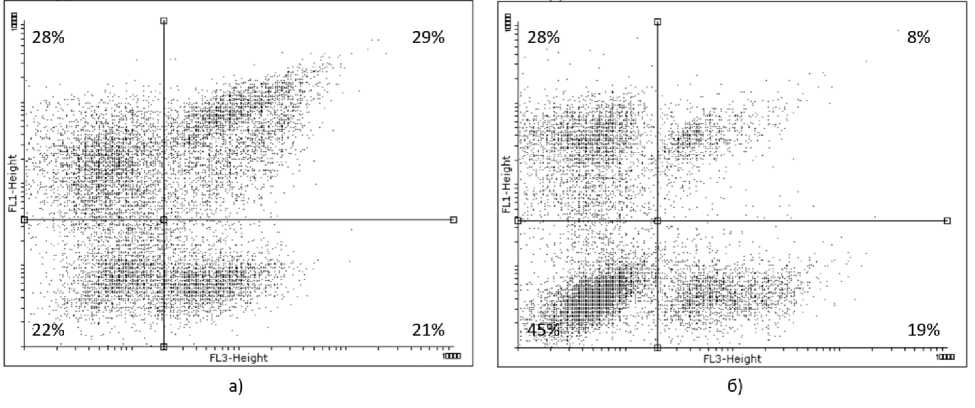
Рис. 2. Дот-плот распределения клеток по уровню флуоресценции зеленого цвета (FL1) и красного цвета (FL3), а) популяция клеток с использованием SB100X, б) популяция клеток без использования SB100X
Из рисунка видно, что в случае использования SB100X 29% всей популяции клеток флуоресцировали и зеленым и красным цветом, 50% популяции клеток – флуоресцировали только одним цветом и 22% не флуоресцировали. Если же SB100X не использовалась, то только около 8% популяции клеток флуоресцировали обеими цветами, 47% клеток флуоресцировали один цветом и 45% не флуоресцировали. Отсутствие флуоресценции в части популяции клеток, по-видимому, связано с тем, что уровень флуоресценции в данных клетках низкий и не может быть детектирован при помощи проточной цитометрии, либо экспрессия флуоресцентных белков прекратилась из-за эпигенетического сайленсинга. Флуоресценция клеток обоими цветами свидетельствует о том, что в геном данных клеток интегрировались обе плазмиды. Поэтому в случае использования SB100X 29% клеток подвергается множественной стабильной трансфекции, в то время как без использования SB100X только 8% клеток подвергается множественной стабильной трансфекции. Эти данные позволяет утверждать, что трансфекция с использованием SB100X позволяет получать стабильные клеточные линии содержащие вставки в геном из нескольких источников.
Таким образом, транспозон SB100X значительно увеличивает одновременную интеграцию обоих плазмид в геном, поэтому транспозонная система «Sleeping Beauty» может быть использована для тех случаев, когда требуется получение клеточной содержащей несколько трансгенных белков.
Список литературы Стабильная трансфекция нескольких плазмидных векторов посредством транспозонной системы "Sleeping beauty"
- Nobel Prize to Barbara McClintock: 5935 // Nature. Nature Publishing Group. 1983. Vol. 305, № 5935. P. 575-575.
- Cordaux R., Batzer M.A. The impact of retrotransposons on human genome evolution: 10 // Nat Rev Genet. Nature Publishing Group, 2009. Vol. 10, № 10. P. 691-703.
- Initial sequencing and analysis of the human genome // Nature. - [Electronic resource]. URL: https://www.nature.com/articles/35057062 (accessed: 23.11.2022).
- Ivics Z. et al. Molecular Reconstruction of Sleeping Beauty, a Tc1-like Transposon from Fish, and Its Transposition in Human Cells // Cell. 1997. Vol. 91, № 4. P. 501-510.
- Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates // Nature Genetics. - [Electronic resource]. URL: https://www.nature.com/articles/ng.343 (accessed: 23.11.2022).
- Kowarz E., Löscher D., Marschalek R. Optimized Sleeping Beauty transposons rapidly generate stable transgenic cell lines // Biotechnol J. 2015. Vol. 10, № 4. P. 647-653.
- Staunstrup N.H. et al. A Sleeping Beauty DNA transposon-based genetic sensor for functional screening of vitamin D3 analogues // BMC Biotechnol. 2011. Vol. 11. P. 33.
- Grabundzija I. et al. Sleeping Beauty transposon-based system for cellular reprogramming and targeted gene insertion in induced pluripotent stem cells // Nucleic Acids Res. 2013. Vol. 41, № 3. P.1829-1847.
- Petrakis S. et al. Gateway-compatible transposon vector to genetically modify human embryonic kidney and adipose-derived stromal cells // Biotechnol J. 2012. Vol. 7, № 7. P. 891-897.
- Grabundzija I. et al. Sleeping Beauty transposon-based system for cellular reprogramming and targeted gene insertion in induced pluripotent stem cells // Nucleic Acids Res. 2013. Vol. 41, № 3. P.1829-1847.
- Balasubramanian S. et al. Comparison of three transposons for the generation of highly productive recombinant CHO cell pools and cell lines // Biotechnol Bioeng. 2016. Vol. 113, № 6. P.1234-1243.


