Стандартизация сырья и препаратов женьшеня
Автор: Акушская Алина Сергеевна, Куркин Владимир Александрович, Шнытко Мария Викторовна, Клейн Людмила Алексеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Коррекция экологического неблагополучия
Статья в выпуске: 5-3 т.14, 2012 года.
Бесплатный доступ
Предложены методики качественного и количественного анализа действующих веществ (сапонинов) в сырье и препаратах женьшеня настоящего ( Panax ginseng C.A.Meyer). С использованием разработанных методик оценки подлинности и качества сырья определены оптимальные условия заготовки корней женьшеня. На основании полученных данных обоснована целесообразность культивирования женьшеня в условиях Среднего Поволжья, а также использования корней женьшеня для производства новых лекарственных препаратов, в частности, сиропа и таблеток женьшеня. Для стандартизации по содержанию сапонинов сырья и препаратов предложен метод прямой спектрофотометрии с использованием удельного показателя поглощения гинзенозида Rg 1, выделенного из корней данного растения.
Корни, сапонины, стандартизация, сироп, таблетки
Короткий адрес: https://sciup.org/148201580
IDR: 148201580 | УДК: 615.322:
Текст научной статьи Стандартизация сырья и препаратов женьшеня
Клейн Людмила Алексеевна, заместитель руководителя колхозно-фермерского хозяйства «Питомник «Женьшень»
сапонины, стандартизация, сироп, таблетки полиацетиленами [4, 7]. Ведущая группа биологически активных веществ (БАВ) женьшеня представлена сапонинами – тритерпеноидами стероидного происхождения [4] (рис. 1).
На фармацевтическом рынке РФ доминирующими являются дорогостоящие препараты женьшеня зарубежного производства (Гинсана, Доппельгерц женьшень, Гербион женьшень, Теравит антистресс, Геримакс женьшень) и БАДы (Геримакс энерджи, Витамакс). Отечественные препараты представлены лишь настойкой женьшеня, производителями которой являются фармацевтические фабрики (Тверская, Ивановская, Тульская), ВИФИТЕХ ЗАО, Камелия НПП и др. [9]. Преобладание импортных препаратов женьшеня в значительной степени может быть обусловлено отсутствием природных ресурсов женьшеня на территории РФ (женьшень занесен в Красную Книгу СССР и не подлежит неконтролируемому сбору), сложности культивирования растения в искусственно созданных условиях, медленным нарастанием биомассы корней (растение заготавливается лишь на 5-6-ой год жизни), а также несовершенством стандартизации исходного сырья. В РФ в ГФ СССР XI издания существует фармакопейная статья (ФС) на корни женьшеня [1],однако и в ней отражены не все показатели качества, предъявляемые в соответствии с ОСТ 91500.05.001-00 «Стандарты качества лекарственных средств. Основные положения» к ФС на лекарственное растительное сырье [6]. В частности, не нормируется содержание действующих веществ, а качественный анализ представлен пробирочными реакциями и методом тонкослойной хроматографии (ТСХ), однако условия проведения хроматографирования не обеспечивают четкого разделения детектируемых веществ.
Цель работы: исследование по обоснованию новых подходов к стандартизации сырья и созданию препаратов женьшеня настоящего.
Материалы и методы. В исследовании использовали ТСХ, адсорбционную жидкостную колоночную хроматографию и метод спектро- скопии в УФ- и видимой области спектра. В методе ТСХ разделение проводили на пластинках «Сорбфил ПТСХ-АФ-А-УФ». Регистрацию спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena) в диапазоне длин волн 190-700 нм. Разработка технологии новых препаратов проводилась в соответствии с классическими методами получения настоек (модифицированная мацерации с термическим фактором), сиропов (получение сиропов, в состав которых входят извлечения из ЛРС) и таблеток (метод прямого прессования) [10].
|
R1-O ^ /X X ■ p XXх R<) ^^^^^ |
Сапонины |
R |
R 1 |
|
|
20S-протопана-ксадиол |
Н |
Н |
||
|
Гинзенозид а 1 |
β-D-Glc-1 → 2-β-Glc |
Xyl-1→4-Ar(pyr)1→ 6-β-D-Glc |
||
|
Гинзенозид а 2 |
β-D-Glc-1→ 2-β-D-Glc |
Xyl-1→4-Ar(fur)1→ 6-β-Glc |
||
|
Гинзенозид Rb 1 |
β-D-Glc-1→ 2-β-D-Glc |
β-D-Glc-1→ 6-β-Glc |
||
|
Гинзенозид Rb 2 |
β-D-Glc-1→ 2-β-D-Glc |
α-L-Ar-1→ 6-β-Glc |
||
|
Гинзенозид Rb 3 |
β-D-Glc-1→ 2-β-D-Glc |
Xyl-1→ 6-β-Glc |
||
|
Гинзенозид Rb c |
β-D-Glc-1→ 2-β-D-Glc |
α-L-Ar(fur)-1→ 6-β-Glc |
||
|
Гинзенозид Rb d |
β-D-Glc-1→ 2-β-D-Glc |
β-Glc |
||
|
Производные 20S-протопанаксадиола |
||||
|
/" \ 0~R |
Сапонины |
R |
R 1 |
|
|
20S-прото-панаксатриола |
Н |
Н |
||
|
Гинзенозид Re |
α-L-Rha-1→ 2-β-D-Glc |
β-D-Glc |
||
|
Гинзенозид Rf |
β-D-Glc-1→ 2-β-Glc |
Н |
||
|
Гинзенозид Rg 1 |
β-D-Glc |
β-D-Glc |
||
|
Гинзенозид Rg 2 |
α-L-Rha-1→ 2-β-D-Glc |
Н |
||
|
Производные 20S-протопанаксатриола |
||||
Рис. 1. Cапонины (гинзенозиды, панаксозиды) корней женьшеня настоящего
Результаты и их обсуждение. В ходе предварительного изучения химического состава корней женьшеня настоящего методом адсорбционной жидкостной колоночной хроматографии нами было выделено вещество, которое по физико-химическим константам, данным УФ-, ЯМР- и масс-спектрам охарактеризовано как гинзенозид Rg 1 (6,20-Бис-(β-D-глюкопиранозил)-(3β,6α,12β,20 S )-3,6,12,20-тетрагидроксидаммар-24-ен). Были измерены электронные спектры поглощения этого соединения в УФ- и видимой области спектра, рассчитан удельный показатель поглощения при аналитической длине волны 526 ± 2 нм в 96% этиловом спирте, содержащем
70% серную кислоту, который составил 25. Метод электронной спектроскопии может быть использован для определения подлинности сырья благодаря наличию максимумов поглощения в УФ- и видимой области спектра, характерных для растворов индивидуальных веществ и извлечений из сырья. В ходе исследования нами было выявлено, что кривая поглощения в УФ- и видимой области спектра раствора очищенного водно-спиртового извлечения из воздушносухих корней после проведения реакции с 70% серной кислотой имеет максимумы поглощения при длинах волн 320±2 нм, 390±2 нм и 526±2 нм (рис. 2). В длинноволновой области спектра комплекс, полученный при взаимодействии спиртового раствора гинзенозида Rg1 с серной кислотой, так же наблюдается четкий максимум поглощения при 526±2 нм (рис. 2). Следовательно, за аналитическую длину волны можно принять значение 526 нм, а стандартным образцом может служить сапонин – гинзенозида Rg1. В случае отсутствия стандарта в расчетной формуле может быть использовано теоретическое значение удельного показателя поглощения (Е1см1%) – 25.
Для качественного анализа корней нами предложено проводить разделение в системе хлороформ – метанол – вода (26:14:3), проявление 20% спиртовым раствором фосфорновольфрамовой кислоты (ФВК) с детекцией в видимой области спектра. На хроматограмме извлечения из корней женьшеня обыкновенной обнаруживаются 6 пятен пурпурно-красного цвета с величиной R f от 0,10 и 0,50 (гинзенози-ды) (рис. 2). Результаты данных исследований свидетельствуют о целесообразности использования спектрофотометрии в УФ и видимой области спектра и ТСХ для идентификации корней женьшеня. С использованием разработанной методики был проанализирован ряд образцов сырья, в числе которых корни женьшеня, выращенные в Самарской и Брянской областях, а также в Китае и Корее. Содержание суммы сапонинов в исследуемых образцах варьирует от 2,78% до 6,11%.

Рис. 2. ТСХ-анализ:
1 – извлечение из корней женьшеня; 2 – настойка женьшеня; 3 – ацетоновое извлечение из сиропа; 4 – рабочий стандартный образец (РСО) гинзенозида Rg 1
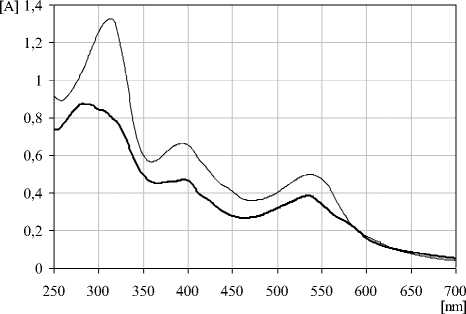
Рис. 3. Электронные спектры окрашенного продукта взаимодействия водно-спиртового извлечения из корня женьшеня, очищенного на полиамиде, с 70% серной кислотой (1) и продукта реакции гинзенозида Rb 1 с 70% серной кислотой (2)
20-летний опыт внедрения и культивирования женьшеня к условиях Среднего Поволжья [11], а также разработанные методики оценки подлинности и качества сырья позволили определить оптимальные условия заготовки корней женьшеня в рамках данной местности: надлежащее время сбора – середина-конец сентября, температура сушки измельченных корней – 50-55ºС. Проведенные ранее фармакологические исследования [2] позволили выявить наличие близкой тонизирующей, анксиолитической и ноотропной активности извлечений из корней женьшеня на 40% и 70% спирте. Данный факт делает возможным использование разработанных настоек в качестве исходной субстанции для получения сиропа и таблеток женьшеня. В качестве основы для получения сиропа нами использованы различные корригенты – сахароза, фруктоза и сорбит – в концентрации 60-64%. Фруктоза и сорбит имеют ряд преимуществ: сироп на их основе может применяться при лечении и профилактике астенических состояний у диабетических больных, при комплексной терапии сахарного диабета. Для обоснования концентрации настойки в сиропе и лечебной разовой дозы учтено, что рекомендуемая лечебная доза настойки – 20 капель 2 раза в день. Проведенные расчеты показали, что необходимое количество гинзено-зидов содержится в 1 чайной ложке сиропа с 10% настойки.
Для того, чтобы при замене растворителя избежать выпадения в осадок действующих веществ, содержащихся в настойке, необходимо вводить в сироп настойку с минимальным содержанием этилового спирта. Поэтому в качестве экстрагента при получении настойки целесообразно использовать 40% этиловый спирт. Полученные сиропы на всех основах стабильны, хорошо высвобождают действующие вещества, корригенты не влияют на результаты качественного и количественного анализа. Технологическая схема получения сиропа женьшеня включает следующие стадии: получение настойки (экстрагирование лекарственного растительного сырья, его очистка и стандартизация), приготовление вкусового сиропа (варка, фильтрование, стандартизация), смешивание промежуточных продуктов, стандартизация готового продукта.
В соответствии с требованиями для стандартизации сиропа проведена оценка органолептических свойств, физико-химических и микробиологических показателей качества [1]. Современные требования, предъявляемые к методикам анализа сырья и препаратов на основе ЛРС, предполагают универсальный подход к определению ведущей группы БАВ [8]. Таким образом, по аналогии с разработанными методиками определения суммы сапонинов в корнях женьшеня и настойке женьшеня, апробированы и метрологически аттестованы методики качественного и количественного определения суммы сапонинов в сиропе женьшеня (рис. 2, 4, 5).
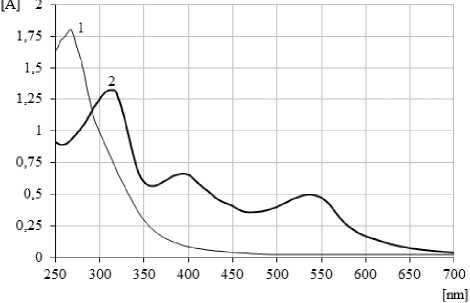
Рис. 4. Спектры поглощения настойки женьшеня на 40% этиловом спирте (1) и суммы сапонинов, полученной путем очистки настойки на полиамиде и взаимодействия с серной кислотой 70% (2)
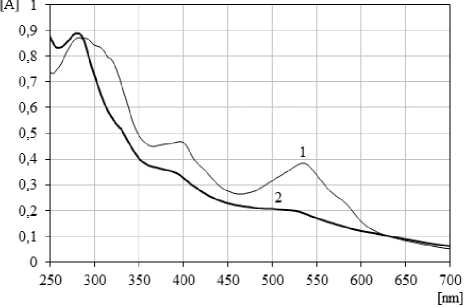
Рис. 5. Спектры поглощения комплексов гинзе-нозида Rg 1 с серной кислотой 70% (1) и упаренного очищенного ацетонового извлечения из сиропа с серной кислотой 70% (2)
При разработке состава и технологии таблеток в качестве основы для получения таблеток женьшеня использовали такие вспомогательные вещества, как лактоза (наполнитель) и микрокристаллическая целлюлоза (связующее вещество) в соотношении 2:3. После измельчения и смешивания порошков к смеси добавляли экстракт женьшеня жидкий (1:1) из расчета 7 капель на 1 таблетку, что соответствует лечебной суточной дозе таблеток – 1 таблетка в день. Полученную таблеточную массу опудривали стеаратом кальция, добавляя его в количестве 1% от смеси, и прессовали на кривошипной таблеточной машине. Качество полученной серии таблеток соответствовало стандартным фармакопейным показателям (ГФ СССР XI издания) [1]. Таким образом, в ходе исследования обоснована целесообразность выращивания женьшеня настоящего в промышленных масштабах в условиях Самарской области, разработаны методы стандартизации корней женьшеня. Обоснованы состав и технология получения сиропа и таблеток женьшеня и методики контроля их качества. Разработанные методики могут быть включены в фармакопейную статью корни женьшеня воздушно-сухие, а также в нормативную документацию на препараты.
Выводы:
-
1. Определены оптимальные условия культивирования и заготовки корней женьшеня, произрастающих в колхозно-фермерском хозяйстве «Питомник «Женьшень».
-
2. Предложены рациональные подходы к составу и технологии лекарственных препаратов для улучшения процессов адаптации и лечения астенических состояний – сиропа и таблеток женьшеня.
-
3. Разработаны методики качественного анализа (тонкослойная хроматография, электронная спектроскопия), позволяющие идентифицировать корни и подтвердить их подлинность, а также методики количественного определения сапонинов методом прямой спектрофотометрии, которые позволят унифицировать стандартизацию сырья и препаратов по содержанию действующих веществ.
Список литературы Стандартизация сырья и препаратов женьшеня
- Государственная фармакопея СССР: Вып. 2. Общие методы анализа. Лекарственное растительное сырье/МЗ СССР. 11-е изд., доп. -М.: Медицина, 1990. 400 с.
- Корчагина, Д.В. Нейротропные эффекты препаратов женьшеня/Д.В. Корчагина, А.В. Дубищев, В.А. Куркин, А.С. Акушская//Материалы V международной конференции «Фармация и общественное здоровье». -Екатеринбург, 2012. С. 174-176.
- Куркин, В.А. Основы фитотерапии: Учебное пособие для студентов фармацевтических вузов. -Самара: ООО «Офорт», ГОУ ВПО «СамГМУ Росздрава», 2009. 963 с.
- Куркин, В.А. Фармакогнозия: Учебник для студентов фармацевтических вузов (факультетов.)/2-е изд., перераб. и доп. -Самара: ООО «Офорт», ГОУ ВПО «СамГМУ Росздрава», 2007. 1239 с.
- Куркин, В.А. Определение сапонинов в корнях женьшеня/В.А. Куркин, А.С. Акушская//Фармация. 2012. Т. 60, № 3. С. 18-20.
- ОСТ 91500.05.001-00. Отраслевой стандарт. Стандарты качества лекарственных средств. Основные положения.
- Растительные ресурсы России: Дикорастущие цветковые растения, их компонентный состав и биологическая активность. Т. 3.Семейства Fabaceae -Apiaceae/Отв. ред. А.Л. Буданцев. -СПб.; М.: Товарищество научных изданий КМК, 2010. 601 с.
- Самылина, И.А. Пути использования лекарственного растительного сырья и его стандартизация/И.А. Самылина, И.А. Баландина//Фармация. 2004. Т. 52, № 2. С. 39-41.
- Справочник РЛС: лекарственные средства и препараты. Инструкция, применение, описание. Режим доступа: http://www.rlsnet.ru
- Чуешов, В.И. Промышленная технология лекарств: учебник для вузов: в 2-х т. Том 2./В.И. Чуешов, М.Ю. Чернов, Л.М. Хохлова. -Харьков. МТК-Книга; издательство НФАУ, 2002. 716 с.
- Шнытко, М.В. Инновационные разработки в области выращивания женьшеня в условиях Среднего Поволжья/М.В. Шнытко, Л.А. Клейн//Сборник материалов Всероссийской научно-практической конференции «Современная фармацевтическая наука и практика: традиции, инновации, приоритеты». -Самара: ООО «Офорт», ГОУ ВПО «СамГМУ Росздрава», 2011. С. 154.


