Стехиометрия и свойства фенилфлуороната германия в смешанных растворителях
Автор: Руденко Элеонора Иосифовна, Белканова Марина Юрьевна, Набокова Наталья Валерьевна
Рубрика: Химия
Статья в выпуске: 22 (122), 2008 года.
Бесплатный доступ
Спектрофотометрическими методами установлена обобщенная формула фенилфлуороната германия (сверхстехиометрического молекулярного хелата), состав которого в значительной степени зависит от природы и концентрации органического растворителя. Установлено, что с увеличением доли спирта в водно-спиртовой смеси изменяются оптические и кинетические характеристики хелата, происходит его структурная перестройка с образованием более мелких частиц растворенных веществ и достижением максимальных значений их сольватных чисел и молярных коэффициентов погашения.
Германий, фенилфлуоронат, смешение, стехиометрия
Короткий адрес: https://sciup.org/147158577
IDR: 147158577 | УДК: 543.422.3
Текст научной статьи Стехиометрия и свойства фенилфлуороната германия в смешанных растворителях
Эффект растворителя оказывает влияние не только на структуру и состав образующихся в растворе частиц, но и отражается на кинетике и механизме реакций комплексообразования [1–3]. Особенно сложным является изучение влияния смешанных растворителей типа вода – органический растворитель вследствие явления селективной сольватации. Приготовление такого рода смесей приводит к сдвигу в равновесиях ассоциации – диссоциации за счет нарушения структуры воды, возникновения новых равновесий сольватации и других причин [1].
Цель данной работы – изучение стехиометрии реакций образования фенилфлуоронатов германия в бинарных смесях вода – органический растворитель и выявление спектральных и кинетических характеристик продуктов реакций. В качестве органических растворителей использовали спирты и диполярные апротонные растворители, в которых хорошо растворяется и сам реагент, и его хелаты с германием. Для изучения растворимости и сольватации хелатов использовали также смеси полярного и неполярного органических растворителей.
В ранее опубликованных работах [4, 5] приведены результаты изучения состава хелатов германия с триоксифлуоронами, отделенных от избытка реагента методами флотационной экстракции и центрифугирования с использованием минимальной концентрации органического растворителя в водной фазе. В данной работе приводятся результаты изучения комплексообразования в широком интервале концентраций полярных органических растворителей в их смесях с водой.
Реактивы
Стандартный раствор германия (4,4 - 10-3 М) готовили из тетрахлорида германия растворением в воде с добавлением концентрированной соляной кислоты и последующей стандартизацией.
Раствор фенилфлуорона (0,09 % ) готовили из препарата марки «ч. д. а.» растворением в соответствующем полярном органическом растворителе после предварительного растирания навески с концентрированной соляной кислотой и нагревания на водяной бане.
Более разбавленные растворы германия и реагента готовили соответствующим разбавлением водой или органическим растворителем исходных в день использования.
Методика проведения эксперимента состояла в следующем: к раствору германия добавляли воду, органический растворитель или смешанный растворитель, соляную кислоту и раствор реагента. Полученные растворы в объеме 5 или 10 мл после необходимой выдержки фотометрирова-ли относительно раствора реагента при аналитической длине волны на спектрофотометре СФ-26.
Результаты и их обсуждение
Изучение влияния концентрации соляной кислоты показало, что интервалы максимального выхода хелатов уменьшаются с увеличением концентрации спирта и составляют приблизительно (0,12^0,90) М и (0,12^0,37) М для 20 %-ной и 80 %-ной концентрации пропанола. Конкурирующей реакцией при концентрации кислоты ниже 0,12 М является переход протонированной формы реагента (H4R+) в молекулярную (H3R). Полоса поглощения молекулярной формы смещена батохромно относительно протонированной формы и более широкая. Уменьшение верхней границы кислотности связано с тем, что рост доли органического растворителя в смешанных рас- творителях уменьшает диэлектрическую проницаемость среды и затрудняет образование координирующей формы реагента (H2R–).
Таблица 1
Спектральные и кинетические характеристики фенилфлуоронатов германия ( С Ge = 8,0 ⋅ 10–6 М, С R = 1,9 ⋅ 10–4 М)
|
С S , % об. |
С HCl, М |
£ - 10 5 . Л . .. . нм) |
А Л 1 / 2, нм |
А , % отн. * |
|
Органический растворитель - этанол |
||||
|
24 |
0,6 |
1,0 (515) |
70 |
–7,4 |
|
48 |
0,6 |
0,7 (500) |
58 |
–10,8 |
|
75 и 94 |
0,6 |
1,8 (505) |
36 |
0 |
|
Органический растворитель – 2-пропанол |
||||
|
20 |
0,6 |
1,0 (515) |
68 |
–9,1 |
|
48 |
0,6 |
0,4 (505) |
42 |
|
|
80 |
0,25 |
1,8 (510) |
32 |
0 |
|
Органический |
растворитель - диметилформамид |
|||
|
80 |
0,12 |
1,7 (510) |
34 |
0 |
|
Органический растворитель - диметилсульфоксид |
||||
|
80 |
0,12 |
1,8 (510) |
41 |
|
* A , % отн. - относительное изменение АА спустя 30 мин после достижения максимальных значений.
При увеличении концентрации органических растворителей в их смесях с водой происходят значительные изменения спектров поглощения и кинетических характеристик хелатов. Как следует из данных табл. 1, процесс комплексообразования в водно-этанольных растворах с увеличением концентрации спирта можно разбить на несколько этапов. На первом этапе в интервале концентраций спирта от 17-18 % до 24-25 % происходит образование хелата с £ 515 = 1,1 - 10 5 и полушириной полосы поглощения А Л 1/2, равной 70 нм. При дальнейшем увеличении концентрации спирта приблизительно до 48 % происходит разрушение первоначально образованного хелата, что сопровождается изменением длины волны максимума светопоглощения, величины А Л 1/2 и £ max. Кроме того, для достижения максимальных значений аналитического сигнала ( А А ) требуется увеличение концентрации реагента почти в 2 раза по сравнению с использованием 24 % -ной концентрации спирта; заметно ухудшается кинетическая устойчивость хелата.
При использовании 48 % -ной концентрации этанола, по-видимому, начинается пересольва-тация компонентов реакции и структурная перестройка хелата. Можно предполагать, что добавление к водному раствору реагента или хелата небольших количеств спирта или другого полярного органического растворителя не нарушает заметно структуры воды, однако при несколько более высоких концентрациях органического растворителя происходит разрушение первоначальной структуры воды и создаются условия для образования новых структур смешанного растворителя и новых форм растворенных веществ [5, 6]. И, наконец, при увеличении концентрации этанола до 48-75 % , образуется хелат с новыми спектральными характеристиками ( £ 505 = 2 - 10 5 , А Л 1/2 = 36 нм). Близкие спектральные характеристики имеют хелаты, образованные в бинарных растворителях, содержащих ~ 80 % -ные концентрации пропанола, диметилформамида и диметилсульфоксида. Увеличение значений ε max в этих условиях приблизительно в 2 раза по сравнению с использованием 20-24 % -ных концентраций спирта сопровождается, как и следовало ожидать, уменьшением ширины полос поглощения ( А Л 1/2 уменьшается также в два раза).
Кинетические характеристики хелатов, полученных при высоких концентрациях органического растворителя, зависят от природы этого растворителя. Так, в среде 75-80 % -ных спиртов или 80 % -ного диметилформамида время развития окраски хелатов составляет 5-10 мин или 2030 мин соответственно, а устойчивость сохраняется до 1-1,5 ч, в то время как в среде 80 % -ного диметилсульфоксида окраска развивается в течение 1 ч (причиной является, вероятно, высокая вязкость фотометрируемых растворов).
Значительные изменения спектральных характеристик хелатов (см. табл. 1) свидетельствуют о заметных сольватохромных эффектах в системе под влиянием органических растворителей. На основании кривых, представленных на рис. 1, можно сделать вывод о том, что в вводноорганических растворах происходит сольватация хелата и для реагента при использовании смесей вода-этанол значительно выше, чем при использовании смесей вода-пропанол, поэтому можно предполагать различия в значениях сольватных чисел по этанолу и пропанолу.
На рис. 2 представлены кривые зависимости оптической плотности растворов хелата в смесях спирт-толуол от концентрации спирта (этанола, пропанола и гексанола). Осадки хелатов выделяли из водных растворов, содержащих 17–18 % -ную концентрацию соответствующего спирта, центрифугированием при угловой скорости вращения 9 тыс. об/мин в течение 10 мин. После отделения фильтрата осадки растворяли в смешанных растворителях при той же скорости вращения в течение 2 мин. Из данных рис. 2 следует, что полное растворение осадков хелатов происходит не только в индивидуальных спиртах, но и при определенной минимальной концентрации
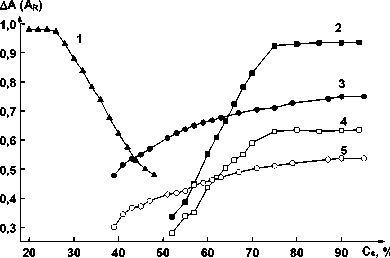
Рис. 1. Зависимость оптической плотности водноорганических растворов хелата германия (1, 2, 3) и реагента (4, 5) от концентрации этанола (1, 2, 4) и 2-пропанола (3, 5): 1 – С Ge = 8,8 ⋅ 10–6 М, С R = = 1,6 ⋅ 10–4 М, λ = 515 нм, l = 1 см; 2 – С Ge = 8,8 ⋅ 10–6 М,
С R = 1,6 ⋅ 10–4 М, λ = 505 нм, l = 0,5 см; 3 – С Ge =
= 7,2 ⋅ 10–6 М, С R = 2,0 ⋅ 10–4 М, λ = 510 нм, l = 0,5 см; 4 – С R = 1,6 ⋅ 10–4 М, λ = 505 нм, l = 0,5 см;
5 – С R = 2,0 ⋅ 10–4 М, λ = 510 нм, l = 0,5 см
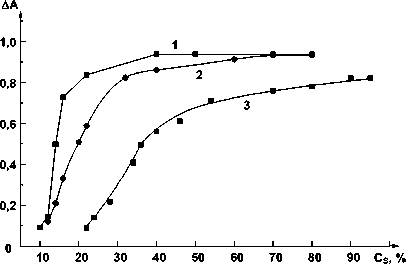
Рис. 2. Зависимость оптической плотности растворов хелата германия в смесях спирт – толуол от концентрации спирта. С Ge = 5,5 ⋅ 10–6 М, b = 1 см. 1 – этанол, λ = 510 нм; 2 – 2-пропанол, λ = 505 нм; 3 – гексанол, λ = 505 нм
спирта в толуоле: для этанола – 40 % , для 2-пропанола – 60 % и для гексанола-1 – 80 % . Таким образом, растворимость хелата ухудшается с увеличением липофильных свойств спирта.
При использовании смесей вода-спирт для достижения предельных значений оптической плотности растворов хелатов требуются более высокие концентрации спиртов, чем при использовании смесей спирт-толуол – 80 % -ная для этанола и 90 % -ная для пропанола, т.к. в смесях типа вода-спирт в процессе сольватации конкурентно участвуют оба растворителя, а в смесях типа спирт-толуол последний выполняет роль инертного разбавителя.
На основании результатов, представленных на рис. 1 и 2, методом сдвига равновесия были вычислены сольватные числа реагента и хелатов по полярным органическим растворителям (табл. 2).
Таблица 2
Результаты расчетов сольватных чисел ( b ) хелата и реагента по полярным органическим растворителям ( S )
|
Cреда |
Метод разделения |
С S , % |
b ±Δ b (n) |
|
Хелат ( С Ge = 8,8 ⋅ 10–6 M, C R = 1,6 ⋅ 10–6 M) |
|||
|
этанол – вода |
без разделения |
24 – 48 |
7,7 ± 0,3 (7) |
|
этанол – вода |
без разделения |
48 – 75 |
8,0 ± 0,1 (9) |
|
2-пропанол – вода |
без разделения |
39 – 75 |
3,6 ± 0,1 (15) |
|
2-пропанол – толуол |
центрифугирование |
12 – 32 |
4,1 ± 0,2 (6) |
|
гексанол-1 – толуол |
центрифугирование |
22 – 54 |
4,2 ± 0,5 (8) |
|
Реагент (C R = 1,6 ⋅ 10–6 M) |
|||
|
этанол – вода |
без разделения |
48 – 70 |
7,1 ± 0,5 (7) |
|
2-пропанол – вода |
без разделения |
39 – 67 |
3,6 ± 0,2 (11) |
Анализ данных табл. 2 позволяет сделать следующие выводы. Во-первых, сольватное число реагента по этанолу в 2 раза превышает эту величину по пропанолу, что позволяет предполагать в водно-этанольных смесях образование двумерной сетки водородных связей. При этом каждая OH-группа реагента взаимодействует двумя молекулами этанола, а в водно-пропанольных смесях – только с одной молекулой спирта в виду стерических затруднений. Та же закономерность проявляется и при сравнении сольватных чисел хелатов, полученных при использовании смесей вода – этанол, вода – пропанол, толуол – пропанол и толуол – гексанол.
Во-вторых, сольватные числа реагента соизмеримы по величине с сольватными числами хелатов при использовании одинаковых условий, что позволяет судить о внешнесферном механизме сольватации.
В табл. 3 представлены результаты вычисления стехиометрических коэффициентов хелата по фенилфлуорону, из которых следует, что при С Et = 24 % и C HCl = 0,6 М в отсутствие других стабилизаторов образуется хелат со стехиометрическим коэффициентом, близким к пяти, в то время как в смесях, содержащих высокие концентрации органического растворителя ( > 70 % ) и более низкие концентрации соляной кислоты (0,1 – 0,25) М образуется хелат типа Ge(ФФ)3.
На основании представленных в работе результатов обобщенную формулу фенилфлуороната германия можно выразить следующим образом:
[Ge(H2R^2 A2]- H3R.• Sу , где [Ge(H2R)2A2 ] - стехиометрический нейтральный хелат, малорастворимый в воде [7], в котором А– – гидроксидный или хлоридный ион; S – полярный органический растворитель, взаимодействующий с хелатом по свободным OH-группам реагента; x – число молекул реагента во внешней сфере, которое может быть равно 0, 1, 2 и 3; y – сольватное число хелата по органическому растворителю, которое принимает значения 4 (чаще всего) или 8 (при использовании этанола).
Таблица 3
Результаты расчетов стехиометрических коэффициентов хелата по реагенту ( b )
|
С S , % |
C HCl , М |
Метод сдвига равновесия ( b ±А b ( n )) |
Метод относительного выхода ( b ) |
|
S - этанол (СGe = 8,8 - 10-6 M) |
|||
|
24 |
0,6 |
3,0 ± 0,1 (9) 5,3 ± 0,5 (6) |
3 5,5 |
|
48 |
0,6 |
2,8 ± 0,2 (7) 5,3 ± 0,4 (6) |
2,5 5,0 |
|
93,7 |
0,1 |
1,6 ± 0,1 (5) 3,5 ± 0,7 (5) |
1,5 3,0 |
|
S - 2-пропанол (СGe = 7,2 - 10 6 M) |
|||
|
70 |
0,25 |
2,8 ± 0,2 (8) |
3,0 |
|
S - диметилформамид (СGe = 7,2 - 10-6 M) |
|||
|
80 |
0,12 |
3,2 ± 0,3 (7) |
3,0 |
Изучение зависимости относительного выхода хелата А А С Ge от соотношения А А А А пр (рис. 3), показало, что при высоких концентрациях органического растворителя (80-90 % ) фе-нилфлуоронат германия является моноядерным хелатом, а при низкой концентрации (35 % этанола) – ассоциированным соединением.
Таким образом, уменьшение доли воды в водно-органических смесях приводит к увеличению растворимости и устойчивости хелатов и сопровождается образованием более мелких частиц светопоглощающих соединений – уменьшаются числа координированных молекул реагента во внешней сфере и вероятность образования гомополиядерных комплексов. В итоге достигаются максимальные значения молярных коэффициентов погашения, что имеет большое практическое значение при спектрофотометрическом определении микроколичеств германия в природных и технологических объектах.
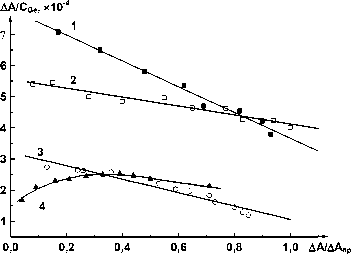
Рис. 3. Зависимость относительного выхода хелата Д A СGe от соотношения Д А / Д А пр , l = 0,3 см: 1 - С r = 0,98 - 10" 4 М, С изп = 90 %, X = 510 нм; 3 - С r = 0,98 - 10- 4 М, С дмф = 80 %, X = 510 нм; 2 - С r = 1,62 - 10- 4 М,
С Et = 93,7 %, X = 505 нм; 4 - С r = 1,62 - 10" 4 М, С Et = 35 %, X = 519 нм
Список литературы Стехиометрия и свойства фенилфлуороната германия в смешанных растворителях
- Бургер, К. Сольватация, ионные реакции и комплексообразование в неводных средах/К. Бургер. М.: Мир, 1984. 192 с.
- Гутман, В. Химия координационных соединений в неводных растворах/В. Гутман. М.: Мир, 1984. 220 с.
- Кукушкин, В.Ю. Теория и практика синтеза координационных соединений/В.Ю. Кукушкин, Ю.Н. Кукушкин. Л.: Наука, 1990. 264 с.
- Балыкин, В. П./В.П. Балыкин, Э.И. Руденко, В.В. Рогулин и др.//Тез. докл. 5-й международной конференции по аналит. химии М., Россия. 25-28 сентября 1995. С. 3.
- Балыкин, В.П./В.П. Балыкин, Э.И. Руденко, Л.О. Иванова и др.//Вестник Челяб. ун-та, Серия 4 «Химия». 1996. № 1. С. 3-13.
- Руденко, Э. И./Э.И. Руденко, Т.А. Иванинова, В.П. Балыкин и др.//Вестник Челяб. ун-та. Серия 4 «Химия». 2001. № 1. С. 109-122.
- Назаренко В.А. Триоксифлуороны/В.А. Назаренко, В.П. Антонович. М.: Наука, 1973. 182 с.


