Стентирование перешейка аорты в качестве метода коррекции коарктационного синдрома, вызванного окклюдером открытого артериального протока: клинический случай
Автор: Р.С. Тарасов, А.Ю. Колесников, И.Е. Верещагин
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 4 т.26, 2022 года.
Бесплатный доступ
Представлен клинический случай стентирования перешейка аорты с целью устранения редкого осложнения — стеноза, вызванного окклюдером, который был имплантирован в открытый артериальный проток ребенку в возрасте 7 мес. Через 7 лет пациент повторно поступил в кардиологический центр с клиникой коарктации аорты, по данным эхокардиографии выявили пиковый градиент давления в зоне имплантации окклюдера 40 мм рт. ст., градиент давления между верхними и нижними конечностями 25–30 мм рт. ст. В возрасте 8 лет компрометацию кровотока в аорте полностью устранили стентированием перешейка аорты с армированием имплантированного окклюдера открытого артериального протока. Имплантировали стент Andrastent XL (Andramed GmbH, Ройтлинген, Германия), который можно раскрыть до 14 мм. При контрольной тензиометрии градиент давления на перешейке аорты полностью устранен. Через 7 мес. эффективность вмешательства подтвердили данными эхокардиографии. Тактика стентирования аорты устройством с потенциалом расширения по мере роста ребенка является обоснованной в силу эффективности, малоинвазивности и радикальности.
Аорта, клинический случай, открытый артериальный проток, стентирование перешейка аорты
Короткий адрес: https://sciup.org/142235623
IDR: 142235623 | DOI: 10.21688/1681-3472-2022-4-60-66
Текст научной статьи Стентирование перешейка аорты в качестве метода коррекции коарктационного синдрома, вызванного окклюдером открытого артериального протока: клинический случай
Р.С. Тарасов, А.Ю. Колесников, И.Е. Верещагин,
Рентгенэндоваскулярное закрытие открытого артериального протока (ОАП) — эффективный и намного менее инвазивный метод по сравнению с хирургическим вмешательством. При лечении детей с изолированным ОАП это доминирующая стратегия коррекции [1]. Несмотря на безопасность и положительные результаты, в редких случаях вмешательство может сопровождаться серьезными осложнениями из-за неоптимально соответствующего анатомии ОАП устройства, приводящего к резидуальному шунту, компрометации окружающих анатомических структур или дислокации окклюде-ра в системный кровоток [2; 3].
Осложнения при установке окклюдера в ОАП наиболее вероятны в группе маловесных новорожденных детей с массой тела менее 2 кг. В литературе выделяют такие виды осложнений, как эмболизация устройством (0–8,3 %), обструкция аорты (0–2 %), обструкция левой ветви легочной артерии (0–4,1 %), трикуспидальная регургитация (0–5 %), повреждение сердца и сосудов (0–8,3 %), летальность (0–8,3 %) [4]. Информация по обструкции аорты представлена в отечественных и зарубежных исследованиях весьма ограниченно.
В данной публикации описан клинический случай редкого осложнения рентгенэндоваскуляр-ного закрытия ОАП: коарктационного синдрома, вызванного компрометацией кровотока на уровне перешейка аорты имплантированным в ОАП ок-клюдером у ребенка 7 мес. В возрасте 8 лет компрометацию кровотока в аорте полностью устранили стентированием перешейка аорты в зоне окклюде-ра открытого артериального протока.
Клинический случай
В апреле 2014 г. в клинику Научно-исследовательского института комплексных проблем сердечнососудистых заболеваний поступил ребенок 7 мес. весом 7,5 кг с жалобами на частые респираторные заболевания, снижение аппетита. При эхокардиографии (ЭхоКГ) в стволе легочной артерии выявили систоло-диастолический кровоток, диаметр ОАП 0,6 см (градиент давления на ОАП 36 мм рт. ст.).
Выполнили рентгенэндоваскулярное закрытие гемодинамически значимого ОАП окклюдером Amplatzer Duct Occluder (Abbott, Эббот-Парк, США) размером 8 × 10 мм через билатеральный бедренный сосудистый доступ справа (общая бедренная артерия и общая бедренная вена). Провели аортографию с визуализацией ОАП диаметром 6 мм. Через общую бедренную вену в легочную артерию завели проводник, установили в аорту. По этому проводнику завели в аорту систему доставки ок-клюдера диаметром 7 Fr. Под контролем аортографии выполнили раскрытие проксимального диска окклюдера в ампуле протока со стороны аорты, а дистальной части — в самом протоке и легочной артерии. Положение окклюдера расценили корректным, для исключения компрометации аорты выполнили прямую тензиометрию (пиковый градиент давления 5 мм рт. ст.), отсоединили окклюдер от системы доставки, выполнили финальную аортографию и завершили процедуру. Результат аортографии удовлетворительный (рис. 1). Предположили, что по мере роста ребенка даже незначительный градиент давления в области имплантации окклю-дера исчезнет. Провели гемостаз, на области пункции общей бедренной артерии и общей бедренной вены справа наложили давящую повязку с сохранением кровообращения в конечности. Послеоперационный период протекал штатно. На следующий день удалили давящую повязку с места пункции общей бедренной артерии и общей бедренной вены, по результатам ультразвукового исследования зон сосудистых доступов патологии не выявили. При ЭхоКГ отметили ламинарный кровоток в легочной артерии, окклюдер в позиции ОАП, отсутствие резидуального лево-правого сброса и признаков обструкции аорты. Спустя два дня после рентгенэндо-васкулярного закрытия ОАП окклюдером ребенка выписали с рекомендациями под наблюдение кардиолога по месту жительства.
После выписки из стационара ребенок регулярно наблюдался в поликлинике. В 2017 г., через 3 года после транскатетерного вмешательства, его стали беспокоить повышенная потливость и одышка при физической нагрузке, частые простудные заболевания, снижение аппетита. При ЭхоКГ компрометации кровотока в аорте на уровне перешейка не описывали.
В июле 2021 г., через 7 лет после рентгенэндова-скулярного закрытия ОАП, ребенок в возрасте 7 лет 10 мес. весом 24 кг поступил в клинику НИИ КПССЗ с жалобами на одышку при физической нагрузке, потливость, цефалгии лобно-височной локализации, не связанные с физической нагрузкой, сниженный аппетит, носовые кровотечения. Со слов матери, клинические проявления возникли с зимы 2020 г. Тогда же при ЭхоКГ впервые документировали компрометацию кровотока в аорте на уровне перешейка окклюдером ОАП. При обследовании в кардиохирургическом отделении клиники по данным ЭхоКГ выявили пиковый градиент давления на перешейке аорты (зона имплантации окклюдера в ОАП) 40 мм рт. ст. с сужением просвета аорты до 0,5 см. В клинике доминирует синдром артериальной гипертензии, при офисном измерении артериальное давление на руках 115–130/65–75 мм рт. ст., на ногах 90–100/60–65 мм рт. ст., параклинически данных о текущем воспалительном процессе нет. С целью уточнения морфологии заболевания выполнили мультиспиральную компьютерную томографию сердца и аорты (рис. 2), установили, что окклюдер, имплантированный в ОАП, выступает диском в просвет аорты в зоне перешейка на 3 мм, что создает значимый градиент давления и клинику коарктации аорты. Диаметр аорты при морфометрии составляет на уровне брахиоцефального ствола 15,8 × 18,1 мм; на уровне левой подключичной артерии 13,6 × 14,7 мм; на уровне перешейка
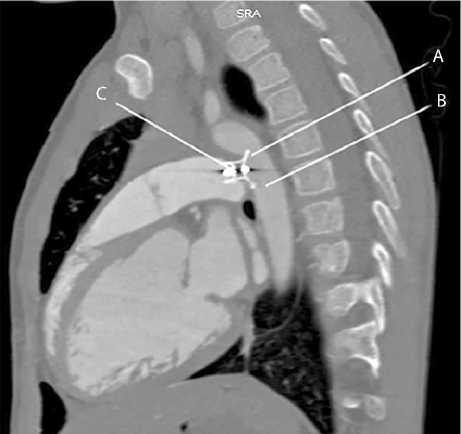
Рис. 2. Мультиспиральная компьютерная томография сердца и аорты: A — стеноз аорты на уровне перешейка; B — аорта; С — окклюдер Amplatzer Duct Occluder, выступающий в просвет аорты
8,8 × 10,0 мм; в проксимальном отделе нисходящей аорты 11,5 × 12,7 мм; в дистальном отделе нисходящей аорты 10,4 × 10,5 мм.
Мультидисциплинарная команда в составе кардиохирурга, рентгенэндоваскулярного хирурга и детского кардиолога при выборе тактики лечения рассматривала кардиохирургическую операцию с пережатием аорты и эксплантацией окклюдера и транскатетерный метод лечения с имплантацией стента, который имеет потенциал дальнейшего расширения до 25 мм по мере роста ребенка, в зону перешейка аорты для устранения градиента давления. Решили выполнить рентгенэндоваскулярное вмешательство со стентированием аорты — малоинвазивный метод, не требующий искусственной вентиляции легких, стерно- или торакотомии, пережатия аорты.
Вмешательство осуществляли в катетеризаци-онной лаборатории под местной и внутривенной анестезией с седацией и сохраненным спонтанным дыханием. Через правый бедренный доступ (общая бедренная артерия) выполнили аортографию с визуализацией перешейка и имплантированного в ОАП окклюдера, провели прямую тензиометрию отделов аорты: давление в восходящем отделе 99/47 мм рт. ст. (среднее 69 мм рт. ст.), в нисходящем 67/47 мм рт. ст. (среднее 58 мм рт. ст.). Таким образом, пиковый градиент давления в зоне окклюдера на фоне седации и анальгезии составил 32 мм рт. ст., что требовало коррекции. Для оценки
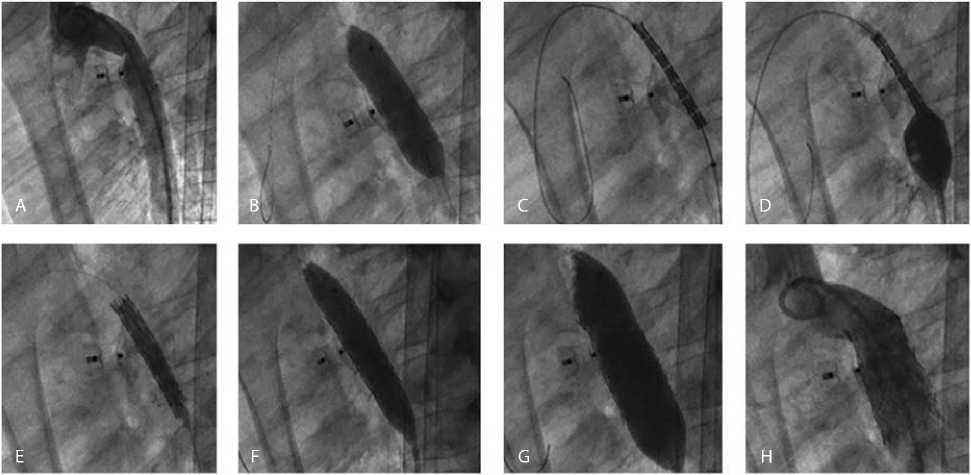
Рис. 3. Этапы стентирования перешейка аорты: аортография (визуализируется коарктация аорты, связанная с окклюдером Amplatzer) (A); придилатация баллоном 10 × 40 мм (B); позиционирование стента (С);
разрыв баллона (D); дилатация баллоном 4 × 30 мм (E); дилатация баллоном 10 × 40 мм (F);
дилатация баллоном 14 × 40 мм (G); аортография (сужение аорты устранено) (H)
потенциала ремоделирования зоны имплантированного в ОАП окклюдера стентом предварительно провели предилатацию данной области баллоном диаметром 10 мм, длиной 40 мм. Отметили возможность смещения диска окклюдера в зону ампулы протока стентом. Кобальт-хромовый стент AndraStent XL (Andramed GmbH, Ройтлинген, Германия) длиной 30 мм вручную монтировали на баллон системы доставки диаметром 14 мм, длиной 40 мм. Для доставки использовали длинный ин-тродьюсер Performer Guiding Sheath (Cook Medical LLC, Блумингтон, США), дизайна Mullins, диаметром 3 мм, длиной 85 см с гемостатическим клапаном 9 Fr. Кремпированный стент на баллоне Tyshak II (PFM Medical AG, Кельн, Германия) системы доставки через интродьюсер в общей бедренной артерии позиционировали в зоне окклюдера. При дилатации баллона системы доставки для имплантации стента смесью рентгеноконтрастного вещества и физиологического раствора в соотношении 1:5 произошел разрыв баллона без смещения стента. Вероятнее всего, баллонный катетер был поврежден стентом при его ручном монтировании. Поврежденный баллон удалили из стента, который остался в целевом сегменте на проводнике 0,035 дюйма. С использованием катетера этот проводник заменили на тонкий коронарный 0,014 дюйма. По нему внутрь стента завели коронарный баллонный катетер диаметром
4 мм, длиной 30 мм. Провели последовательную дилатацию стента баллонами 4 × 30 мм давлением 16 атм., 10 × 40 мм давлением 5 атм. и 14 × 40 мм давлением 5 атм. При контрольном контрастировании аорты паравазации не отметили, стент имплантировали в целевой сегмент аорты в зону имплантированного ранее в ОАП окклюдера. Основные этапы операции представлены на рис. 3.
При контрольной прямой тензиометрии давление в восходящем отделе аорты 117/71 мм рт. ст. (среднее 93 мм рт. ст.), в нисходящем отделе 117/72 мм рт. ст. (среднее 93 мм рт. ст.). Градиент давления на перешейке аорты отсутствовал. Выполнили гемостаз с наложением давящей повязки на область пункции общей бедренной артерии с сохранением кровотока по конечности, непосредственно после выполнения гемостаза пациент проснулся, после полного восстановления сознания и моторных реакций и наблюдения анестезиологом его перевели в реанимационное отделение для динамического наблюдения.
В раннем послеоперационном периоде состояние удовлетворительное, жалобы отсутствовали, место пункции (правая общая бедренная артерия) без признаков гематомы, нога телесного цвета, теплая, чувствительность сохранена. При ультразвуковом контроле кровоток в общей бедренной артерии магистральный, пульсирующих образований не выявили. По данным ЭхоКГ, градиент в аорте на уровне имплантации стента 15 мм рт. ст., при офисном измерении артериального давления на верхних и нижних конечностях градиент 5–10 мм рт. ст. Через 3 дня после вмешательства пациента выписали на амбулаторный этап под наблюдение детского кардиолога.
Спустя 7 мес. после стентирования аорты провели телефонный опрос матери пациента. Состояние в течение периода наблюдения удовлетворительное, носовые кровотечения прекратились. По результатам ЭхоКГ, пиковый градиент давления на перешейке аорты 16 мм рт. ст., что соответствует послеоперационным данным и свидетельствует об удовлетворительном ближайшем результате операции.
Обсуждение
Согласно данным литературы, легкая протрузия окклюдера в аорту хорошо переносится большинством детей, включая младенцев с массой тела более 1 кг, а в течение года наблюдения обструкция обычно проходит без какого-либо вмешательства по мере роста ребенка [5]. Однако в некоторых случаях, чаще у детей с массой тела не более 2 кг, стеноз перешейка аорты может стать клинически значимым и сопровождаться симптомами, требующими вмешательства [6]. Данный вариант осложнения имел место и в представленном клиническом случае, когда в зоне протрузии окклюдера в аорту возник гемодинамически значимый градиент давления, появились симптомы артериальной гипертензии с частыми носовыми кровотечениями. Действительно, при клинически яркой манифестации обструкции перешейка аорты наиболее значимыми симптомами являются разница в артериальном давлении между верхними и нижними конечностями (средний доплеровский градиент ≥ 20 мм рт. ст. на перешейке аорты), снижение пульса на нижних конечностях, в более тяжелых случаях снижение функции почек, некротизирующий энтероколит, ишемия кишечника, ухудшение респираторного статуса и ацидоз в зависимости от степени обструкции. В то же время острая декомпенсация вследствие обструкции аорты окклюдером чаще наблюдается у новорожденных с массой тела менее 1 кг [4].
Вероятнее всего, причиной поздней диагностики коарктационного синдрома через 7 лет после закрытия ОАП является отсутствие должной настороженности докторов по поводу градиента давления на перешейке аорты в зоне имплантированного ок- клюдера при ЭхоКГ. Одной из причин данного состояния может быть протрузия окклюдера в сторону аорты в среднеотдаленном послеоперационном периоде, вызванная неполным анатомическим соответствием окклюдера ОАП или спазмом последнего.
В литературе выделяют следующие механизмы протрузии окклюдера ОАП в аорту: имплантация устройства слишком большого размера, его избыточное натяжение системой доставки, что препятствует коаксиальному расположению, неадекватная визуализация, констрикция ОАП с выдавливанием окклюдера в аорту, неправильное позиционирование окклюдера с мальпозицией, ошибки хирурга, острое отхождение ОАП по отношению к нисходящей аорте [4]. В представленном клиническом случае наиболее вероятными причинами протрузии окклюдера в аорту были имплантация большого ок-клюдера при неоптимальной анатомии ОАП и частичное выдавливание окклюдера в аорту на фоне констрикции протока.
При возникновении симптомов умеренной обструкции аорты имплантированным в ОАП окклю-дером предлагается выжидательная тактика с мониторингом и динамическим наблюдением за пациентом. При выраженной компрометации аорты рекомендуют прибегнуть к одному из способов транскатетерного или хирургического извлечения окклюдера. Также в качестве метода коррекции рассматривают стентирование аорты [7]. Именно такой нестандартный и мало описанный в литературе способ коррекции выбрали при лечении ребенка в представленном клиническом случае. Выбор обоснован длительным нахождением окклюдера в ОАП (около 7 лет), умеренно выраженной обструкцией аорты и технической возможностью имплантации стента с потенциалом дальнейшего расширения по мере роста ребенка. В то же время следует признать факт поздней диагностики осложнения.
Тактика при разрыве баллона системы доставки стента может быть различной: извлечь поврежденный баллон и имплантировать стент с использованием нового баллона; убрать поврежденный баллонный катетер и попытаться извлечь стент с помощью различных приемов и инструментов (провести новый баллон через стент, раздуть его и извлечь стент, обвить стент двумя проводниками, извлечь его с помощью ловушки, петли, ретривера, щипцов). Каждый способ сопряжен с риском смещения стента с баллонного катетера при попытке его удаления [8]. В представленном случае тактика извлечения поврежденного баллонного катетера с заменой проводника на коронарный и поэтапной дилатаци- ей стента баллонами от 4 до 14 мм была эффективной. В то же время следует соблюдать осторожность при ручном кремпировании стента на баллонный катетер системы доставки, когда элементы стента могут проткнуть баллон, что сделает невозможной имплантацию.
Заключение
Протрузия окклюдера ОАП в аорту с возникновением симптомов обструкции аорты — редкое осложнение, в большей степени характерное для вмешательств у новорожденных детей с дефицитом массы тела. Тактика стентирования перешейка аорты устройством с потенциалом расширения по мере роста ребенка является обоснованной в силу эффективности, малоинвазивности и радикальности, показана у детей старшей возрастной группы и подростков. Между тем сложно сделать однозначный вывод из-за малого объема данных в источниках литературы, которые ограничиваются описанием единичных случаев или серий пациентов с небольшой выборкой.
Список литературы Стентирование перешейка аорты в качестве метода коррекции коарктационного синдрома, вызванного окклюдером открытого артериального протока: клинический случай
- Рентгенэндоваскулярная хирургия: национальное руководство. В 4 т. / Под ред. Б.Г. Алекяна. М.: Литтерра, 2017. Т. 1: Врожденные пороки сердца. 2017. 573 с. Alekyan B.G., editor. Endovascular surgery: national guidelines. In 4 vol. Moscow: Litterra Publ.; 2017. Vol. 1: Congenital heart disease. 2017. 573 p. (In Russ.)
- Haponiuk I., Paczkowski K., Chojnicki M., Jaworski R. Iatrogenic obstruction of the aorta — a sequence of delayed, fatal complications after 'off-label' interventional persistent ductus arteriosus closure. Wideochir Inne Tech Maloinwazyjne. 2016;11(1):44-48. PMID: 28133500; PMCID: PMC4840184. http://dx.doi.org/10.5114/wiitm.2016.57620
- Backes C.H., Rivera B.K., Bridge J.A., Armstrong A.K., Boe B.A., Berman D.P., Fick T., Holzer R.J., Hijazi Z.M., Abadir S., Justino H., Bergersen L., Smith C.V., Kirpalani H. Percutaneous Patent Ductus Arteriosus (PDA) closure during infancy: a meta-analysis. Pediatrics. 2017;139(2):e20162927. PMID: 28087683. http://dx.doi.org/10.1542/peds.2016-2927
- Sathanandam S., Gutfinger D., Morray B., Berman D., Gillespie M., Forbes T., Johnson J.N., Garg R., Malekzadeh-Milani S., Fraisse A., Baspinar O., Zahn E.M. Consensus Guidelines for the Prevention and Management of Periprocedural Complications of Transcatheter Patent Ductus Arteriosus Closure with the Amplatzer Piccolo Occluder in Extremely Low Birth Weight Infants. Pediatr Cardiol. 2021;42(6):1258-1274. PMID: 34195869; PMCID: PMC8292293. http://dx.doi.org/10.1007/s00246-021-02665-3
- Alkhouli M., Sievert H., Rihal C.S. Device embolization in structural heart interventions: incidence, outcomes, and retrieval techniques. JACC Cardiovasc Interv. 2019;12(2):113-126. PMID: 30678792. http://dx.doi.org/10.1016/j.jcin.2018.08.033
- Chien Y.-H., Wang H.-H., Lin M.-T., Lin H.-C., Lu C.-W., Chiu S.-N., Wu M.-H., Wang J.-K., Chen C.-A. Device deformation and left pulmonary artery obstruction after transcatheter patent ductus arteriosus closure in preterm infants. Int J Cardiol. 2020;312:50-55. PMID: 32143922. http://dx.doi.org/10.1016/j.ijcard.2020.02.065
- Dimas V.V., Leonard S.R., Guleserian K.J., Forbess J.M., Zellers T.M. Stent implantation for coarctation of the aorta in a premature infant through carotid cutdown as a bridge to surgical correction. J Thorac Cardiovasc Surg. 2010;139(4):1070-1071. PMID: 19660357. http://dx.doi.org/10.1016/j.jtcvs.2008.10.055
- Keelan E.T., Nunez B.D., Berger P.B., Holmes D.R. Jr, Garratt K.N. Management of balloon rupture during rigid stent deployment. Cathet Cardiovasc Diagn. 1995;35(3):211-215. PMID: 7553825. ttps://dx.doi.org/10.1002/ccd.1810350310


