Стерилизация микрофлоры воздуха жилых помещений с перезарядкой частиц
Автор: Варехов А.Г.
Журнал: Технико-технологические проблемы сервиса @ttps
Рубрика: Диагностика и ремонт
Статья в выпуске: 1 (27), 2014 года.
Бесплатный доступ
В статье обосновывается возможность использования электрополевых воздействий на микрофлору (одиночно живущие бактериальные клетки и споры плесневых грибов) воздуха жилых помещений с целью ее инактивации. Показывается, что для стерилизации биологически активных аэродисперсных систем (биоаэрозолей) невозможно применение часто используемых для этих целей эффектов протекания в водных средах, содержащих микроорганизмы, постоянного или импульсного электрического тока. Приводятся результаты экспериментальных исследований, показывающие возможность высокоэффективной инактивации биологических частиц в результате их зарядки и перезарядки в потоке через последовательно соединенные камеры с коронным разрядом противоположных знаков. Получены значения параметров устройств (разрядные токи, скорость движения потока и другие), необходимые для реализации способа.
Внутренний воздух, биоаэрозоль, стерилизация, коронный разряд, зарядка и перезарядка частиц
Короткий адрес: https://sciup.org/148186139
IDR: 148186139 | УДК: 614.7;537.56;579.63
Текст научной статьи Стерилизация микрофлоры воздуха жилых помещений с перезарядкой частиц
Чувствительность клеток или целостных организмов в отношении электрического поля сама по себе вполне естественна, поскольку электрическое поле всегда было действующим фактором в эволюции биологических систем любого уровня [ 1 ] . Известно, например, что отсутствие естественного электрического поля напряженностью 200-400В ∙ м приводит к угнетению жизненных функций культуры почвенных микроорганизмов B.subtilis [ 2 ] . Отсутствие естественного электрического поля в современных железобетонных зданиях, экранирующих поле, приводит к нарушению циркадных ритмов у человека [ 3 ] .
Использование электрических полей для преципитации частиц и инактивации микроорганизмов, взвешенных в воздухе, началось достаточно давно. Однако широкое понимание процессов, происходящих при этом, особенно при использовании электрических воздействий для инактивации микроорганизмов, не позволяло рационально подойти к вопросам разра- ботки и проектирования технических устройств.
Действие электрического тока на водные клеточные суспензии или на культуры клеток в физиологических жидкостях применяется также достаточно давно. Многие промышленные пищевые технологии используют импульсное электрическое поле для инактивации загрязняющих жидкости (воду) микроорганизмов [ 4 ] . Протекание тока в проводящем биологическом материале (тканевых электролитах) использовалось для заживления ран, сращивания костей и в других полезных терапевтических методах. Очень широкий спектр эффектов слабого постоянного тока (0,008 ÷ 0,08 миллиампера), включая разрушение клеток, описали Петерфи и Уильямс [ 5 ] уже 80 лет назад.
В последнее время возник интерес к эффекту электропорации [6] клеточных мембран при протекании электрического тока, то есть образованию очень тонких (диаметром 0,5 нм) трансмембранных каналов или пор. Эти каналы могут быть использованы для транс- порта в клетки лекарственных препаратов, экстракции из внутриклеточного объема нежелательных продуктов клеточного метаболизма, межклеточного обмена генетической информацией и многих других целей, включая стерилизацию микроорганизмов. Этот эффект привлек массовое внимание косметологов, занятых проблемами омоложения. В этих процедурах действующим фактором является электрический ток, протекающий в тканевых электролитах, но никак не электрическое поле, как это часто и совершенно безосновательно постулируется.
Диэлектрические аэродисперсные системы, содержащие биологически активные компоненты (бактерии и споры грибов), и прежде всего, воздух жилых помещений, напротив, могут быть подвержены действию электрического поля, но не электрического тока. При этом взвешенные в воздухе одиночно живущие бактериальные клетки и сухие споры аллергенных грибов могут быть столь же опасными, как и при контакте с водными системами.
Санитарное состояние воздуха жилых помещений определяется такими бактериальными компонентами, как S. aureus (золотистый стафилококк), Str. viridans и Str. haemolyticus (зеленящий и гемолитический стрептококки), Sarcina lutea и другие виды сарцин, Candida albicans и другие виды рода Candida , а также присутствием многочисленных представителей (например, B.subtilis ) почвенных микроорганизмов. Аллергенные грибы в Санкт-Петербурге, как и во многих других городах, представлены, в основном, P.chrisogenum , A.niger и Rhizopus nigricans . A. niger известен, кроме того, как наиболее эффективный деструктор неметаллических материалов (пластмасс, резин, дерева, герметиков, клеев, лакокрасочных покрытий и многих других).
Недостаточная вентиляция, особенно, на верхних этажах зданий, отсутствие вентиляционных отверстий в жилых комнатах, понижение воздухообмена вследствие использования герметичных пластиковых стеклопакетов, повышенная влажность, отсыревшие бумажные обои и другие факторы способствуют развитию различных патологий [ 7 ] . Стандартные бытовые кондиционеры часто оказываются местами роста плесневых грибов [ 8 ] или смертельно опасной бактерии Legionella pneumophila . Нормой содержания в воздухе спор принято считать значение 500 колониеобразующих единиц (КОЕ) в кубическом метре, но в нижних этажах некоторых старых домах в Санкт-Петербурге это значение может доходить до 40 000 КОЕ∙м .
Рыночная номенклатура устройств, предназначенных для очистки и обеззараживания воздуха жилых помещений, достаточно обширна, однако их декларируемая эффективность может быть сильно преувеличена. Характерно, что Федеральная Торговая Комиссия -независимое агентство правительства США, защищающее права потребителей, - с 1995-го года запретила производителям оборудования для очистки и обеззараживания воздуха жилых помещений заявлять в своих рекламах, что производимые ими устройства экстремально эффективны, не производят побочных вредных продуктов и облегчают условия жизни для людей, подверженных действию аллергенов, астматиков и т.д.
Методы стерилизации воздуха жилых помещений можно разделить на несколько основных существенно отличающихся друг от друга типов.
-
1 .Обработка воздуха озоном, являющимся сильным окислителем и оказывающим губительное действие на все микроорганизмы. Для производства озона используется тлеющий барьерный разряд, который для промышленного производства озона впервые использовал и запатентовал соответствующее устройство («озонатор Сименса») Вернер Сименс в 1857-м году. Проблема озонирования воздуха помещений с целью стерилизации микрофлоры заключается в том, что эффективная с точки зрения инактивации микроорганизмов концентрация озона во много раз превышает предельно допустимую концентрацию для человека.
-
2 . Высокоэффективная фильтрация частиц, включая биологические частицы, общеизвестная как HEPA (High Efficiency Particulate Air), неэффективна с точки зрения стерилизации, если она не сопряжена с дополнительным аппаратным комплексом, предназначенным специально для этой цели. Напротив, осадки биологических частиц в таких системах, как правило, становятся очагами реинфекции воздуха микроорганизмами.
-
3 .Ультрафиолетовое излучение (ртутная линия 253,7 нм), эффективность которого объясняется тем, что излучение в этой области хорошо поглощается ДНК микроорганизмов. Метод оптимален и широко используется для операционных отделений больниц, но практически непригоден для жилых помещений.
-
4 .Использование действия электрического тока на осадки частиц в фильтрующих устройствах. Единственное используемое в медицинских учреждениях РФ изделие «Поток 150М- 01» имеет экстремально высокую эффективность в отношении фильтрации и стерилизации, однако технологические детали этих процессов нигде не обсуждаются.
-
5 .Ионизация воздуха помещений с использованием коронного разряда, обеспечивающая, хотя и достаточно медленно, эффективное освобождение воздуха помещений от всех примесей. Метод не оказывает специфического стерилизующего эффекта. При умеренной производительности ионного источника производство озона и уровень УФ-излучения могут быть сведены к минимуму. Экспериментально показано [ 9 ] , что при уровне напряжения на электродах коронных излучателей до 10 кВ производство озона не превосходит значения ПДК
(0,1 мг м- 3)), а суммарное производство окислов азота NOX в десятки раз ниже ПДК (5,0 мг м- 3).
С целью получения стерилизующего эффекта при использовании последнего из перечисленных методов мы исследовали влияние зарядки и перезарядки в коронном разряде частиц биоаэрозоля (клеток). Можно предположить, что такое воздействие на состояние клеточной поверхности и развивающиеся после воздействия вторичные эффекты могут оказаться гибельными для клетки, но не эквивалентны эффектам, которыми сопровождается протекание тока проводимости в клеточных суспензиях. Отметим также, что перезарядка оставляет частицы заряженными и, таким образом, способствует осаждению инактивированных частиц на поверхностях, ограничивающих помещение.
Устройство для обеззараживания (стерилизации) клеток, взвешенных в воздухе, представляло собой две зарядные камеры на основе коронного разряда обоих знаков, положительного и отрицательного. Обе камеры располагались последовательно друг за другом в трубе, через которую продувался воздух с взвешенными в нем клетками. Каждая камера имела простую коаксиальную конструкцию и представляла собой короткий металлический цилиндр длиной 10 миллиметров и диаметром 40 миллиметров и центральную коронирую-щую иглу, расположенную на оси цилиндра. Небольшая длина цилиндров была оптимальной для того, чтобы свести к минимуму потерю клеток за счет их осаждения (преципитации) и одновременно получить заряд частиц, близкий к предельному.
Использовались клетки Candida albicans, Staphylococcus aureus, Escherichia Coli и Sarcina lutea , непрерывно генерируемые источником - стандартным атомизатором. Концентрация клеток находилась в пределах 106 – 107 см –3 и определялась с помощью стандартного щелевого импактора с вращающейся чашкой Петри.
Для измерения заряда частиц (клеток) использовался следующий простой метод. Воздух, содержащий заряженные частицы, прокачивался через хорошо изолированный электрически металлокерамический цилиндр с размерами пор не более 1 микрона с последующим измерением потенциала электрода – цилиндра с помощью чувствительного электростатического вольтметра. Для расчетов заряда использовался начальный линейный участок кинетической кривой. Точное измерение заряда в каждом случае требовало детального анализа временного хода потенциала и знания электрической емкости, в том числе собственной емкости вольтметра и полной емкости измерительной системы. Число клеток (при условии, что все они задерживались измерительным электродом) определялось как произведение объема воздуха и клеточной концентрации. Этот метод давал очень точные значения заряда, ограничи- ваемые по точности только измерениями концентрации.
Коэффициент стерилизации определялся посредством отбора проб непосредственно из генератора и после стерилизатора, для чего использовались одновременно два щелевых импактора, скомпенсированные по параметрам. Для получения надежных данных каждый эксперимент включал 15 ÷ 20 образцов. Коэффициент стерилизации определялся как отношение исходной концентрации клеток к конечной концентрации (табл. 1).
Таблица1 – Результаты измерения коэффициента стерилизации
|
Культура |
Коэффициент стерилизации |
|
Candida albicans |
0,9846 |
|
Staphylococcus aureus |
0,9300 |
|
Escherichia Coli |
0,9865 |
|
Sarcina lutea |
0,9707 |
Напряжение на электродах обеих зарядных камер составляло 12 кВ ; ток отрицательной короны l_ =35 мкА ; ток положительной короны l_]_=25 мкА ; объемный расход воздуха составлял 2,4 м 3 в час; последовательность изменения знаков зарядки от (+) к (-). Коэффициент стерилизации определялся выражением, полученным исходя из простых вероятностных соображений:
к ст=1-(1- Кг )(1- K2 )(1- Кз )(1- К^ ), где К^ - коэффициент, учитывающий инактивацию под действием озона и ультрафиолета, сопровождающих коронный разряд; 7^2 - инактивация в результате прямого действия электрического поля; К3 - потеря частиц вследствие преципитации (осаждения); ^4 - инактивация за счет перезарядки. Таким образом, каждый из этих коэффициентов имеет смысл вероятности инактивации при действии каждого из факторов в отдельности и при условии их независимого действия. Для определения стерилизующего действия озона ( ^1 ) поверхность предварительно засеянных чашек Петри подвергалась действию озонированного воздуха, полученного из стерилизатора. Для этого также и в тех же условиях использовался щелевой импактор: сначала для засева чашек, а затем для обработки посевного материала озонированным воздухом. Коэффициент ^1 определялся по уменьшению числа колоний на обработанных озоном чашках по отношению к числу контрольных колоний. Стерилизующий эффект электрического поля ( ^2 ) определялся путем исключения коронного разряда при сохранении картины электростатического поля. Эффект фильтрации ( ^3 ) измерялся с помощью стандартного лабораторного нефелометра. Например, значения коэффициентов 7^1 , ^2 , 7^3 для культуры Candida albi. , полученные экспериментально, оказались равными: =
0,039; ^2 =0;Т^з = 0,55. Соответственно, рас- считанное значение К^ = 0,9644 определяет эффект перезарядки.
Для расчетов заряда частиц была использована хорошо разработанная теория зарядки частиц ⦋10]. Уравнение кинетики зарядки в электрическом поле (так называемая дрейфовая составляющая зарядки) обычно записывается в форме v V у 4ТСSq"VeTilc^t , где Qm - предельная величина заряда; к^ - подвижность ионов; П - концентрация ионов; р= - объемная плотность ионного заряда у поверхности частицы; е=1,6∙10 19Кл- заряд электрона; £0 =8,854∙10— 12Ф∙м 1-электрическая постоянная. Для расчетов времени нейтрализации заряда в процессе перезарядки использовалось уравнение для плотности ионного тока зарядки или перезарядки частицы в электрическом поле у поверхности частицы:
= - Dgradnp , в котором Е - компонента поля, нормальная к поверхности частицы; D - коэффициент диффузии ионов; gradnp - нормальная к поверхности частицы составляющая градиента плотности ионного объемного заряда. Кинетика зарядки показана на рис.1, где введены следующие обозначения: tl = - время зарядки частицы в первой камере; ^2 - ^1 - время движения частицы от одной камеры к другой; tg - ^2 = - время нейтрализации заряда; ^4 - tg = - время зарядки частицы во второй камере; £4 - ^2 = - время полного изменения заряда; Qi + ^2 = - суммарное изменение заряда.
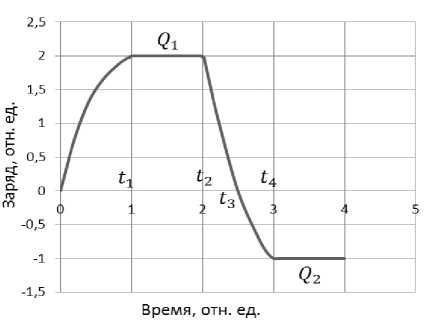
Рисунок 1. Кинетика зарядки и перезарядки клеток Численные расчеты были проделаны для трех значений скорости течения = 53,3;106,6;213,2 см∙с— 1 . Как и прежде, напряжение на разрядных электродах было равно 12кВ, токи короны - равными = 25 мкΑ; L =35 мкΑ. Экспериментальное определение подвижности ионов ^i и объемной плотности ионного заряда p представляют значительные трудности; к тому же подвижность зависит еще и от напряженности поля. Однако это и не требуется, так как оба этих параметра входят в уравнения всегда в виде произведения kip, которое определялось экспериментально по измерениям потенциала специального коллектора, на котором осаждались заряженные частицы. В качестве такого коллектора, как уже отмечалось выше, использовался металлокерамический цилиндр с размерами пор не более 1мкм, через который продувался исследуемый биоаэрозоль. В результате для обеих зарядных камер было получено значение (ktP)= (kiP)2 =3,23∙10 10Сим⋅м–1. Величина предельного заряда для клеток E.Coli была равна 2,25⋅10-16Кл или примерно 1406 в единицах e=1,6⋅10-19Кл.
Время нейтрализации заряда рассчитывалось по формуле
=(klP) ; ( !+5m2 ) , полученной как результат решения приведенного выше уравнения нейтрализации. Расчетные и экспериментальные значения для клеток E.Coli представлены в табл. 2 ниже.
Таблица 2 – Расчетные и эксперимен тальные значения для клеток E.Coli
|
9 r |
SS |
SS 6i |
O) |
4 |
4 |
bp |
9 |
|
O\ eq |
eq 0 |
OO O\ |
VO VO O\ |
||||
|
4D |
00 eq |
0 |
OV |
0 |
So |
VO |
О |
|
eq |
VO |
s |
0 ^ |
0 |
^4 0 |
О |
На рис.2 значения коэффициента стерилизации ^4 для клеток E.Coli представлены в зависимости от суммарного изменения заряда Qe = + Q^ , выраженного в единицах Qz = ( e =1,6∙10 19 Кл), где П - число элементарных зарядов на частице. Таким образом, например, при Qe =200 получаем n = 125.
Рисунок 2. Коэффициент стерилизации в зависимости от величины суммарного изменения заряда
Из представленной таблицы, как и из рис.2, следует, что изменение суммарного заря- да ≥ 0,25 ведет к почти полной инактивации клеток. При скорости V >2м-с “1 заряд, получаемый в первой камере, сравнительно высок, но при этом переход заряда клетки через нулевое значение, вероятно, отсутствует, так как значение заряда противоположного знака, полученного во второй камере, соизмеримо с естественным отрицательным зарядом частиц. Для увеличения коэффициента стерилизации в этом случае следовало бы увеличить длину в направлении потока второй камеры.
Известно, что при отсутствии заряда клетки ( =0), наступает ее гибель, сопро вождающаяся денатурационными явлениями в протоплазме. Хорошо известно также, что многие ферменты быстро денатурируют, если среды переходит через нулевую точку, называемую изоэлектрической. Такой переход может быть непосредственно индуцирован путем перезарядки клеточной поверхности, как это было сделано в описанных экспериментах. При этом процесс перезарядки в газовой дисперсионной среде, по времени занимающий 10 ÷ 20 миллисекунд, термодинамически следует рассматривать как адиабатический. В жидкостной дисперсионной среде, то есть в водных суспензиях клеток, изменение (закисление или защелачивание инкубационной среды) происходит значительно медленнее. Однако независимо от кинетики решающим фактором является, по-видимому, величина электрического заряда белковой молекулы, зависящего от и определяющего, в конечном итоге, конформацию мембранных белков. При атомизации клеточных суспензий, а также в результате таких банальных процессов, как кашель или чихание, взвешенные в воздухе клетки несут на поверхности тонкие водные слои, а сам процесс атомизации представляет собой разрыв сплошности исходной, то есть водной дисперсионной среды по границе «вода-частица», соответствующей радиусу гидродинамического скольжения частицы. Этот вывод принципиально основывается на том, что именно на поверхности гидродинамического скольжения имеет место равновесие (равенство химических потенциалов) среды и периферического адсорбированного слоя (плотной части двойного электрического слоя). Следовательно, поверхностный потенциал атомизированной клетки должен быть равен ее электрокинетическому потенциалу (дзета-потенциалу) [11]. Для оценки величины этого потенциала на границе раздела «жирная кислота-вода» можно использовать значение Z= — 120мВ [11]. Наибольшему значению коэффициента стерилизации ( = 0,9665 в таблице 2), соответствует наибольшее суммарное изменение заряда ( =854∙10 Кл или приблизительно 534 ). Нетрудно подсчитать, что для сферической частицы радиуса 1,5 мкм это соответствует изменению поверхностного потенциала около 160 милливольт. Это значение достаточно близко соответствует типичным значениям поверхностного и трансмембранного потенциалов клеток. Внесение свободного заряда на поверхность клетки изменяет значение наружного обводненного слоя и приводит в действие денатурационные механизмы, приводящие к инактивации, причем в том же масштабе времени, в котором происходит перезарядка. Этот временной масштаб, как уже было отмечено, составляет несколько единиц или десятков миллисекунд.


