Стерины и полифенолы фукоидов мурманского побережья Баренцева моря
Автор: Ткач Анна Васильевна, Облучинская Екатерина Дмитриевна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биоэкология
Статья в выпуске: 2 т.20, 2017 года.
Бесплатный доступ
Представлены результаты исследования содержания полифенолов и стеринов в фукусовых водорослях акваторий мурманского побережья Баренцева моря. Обнаружены максимальные концентрации полифенолов (7,06-9,62 %) во всех фукусовых водорослях губы Лодейная, которая характеризуется наибольшим уровнем загрязнения тяжелыми металлами. При сравнении содержания полифенолов в фукоидах Мурмана установлено, что минимальные значения характерны для Ascophyllum nodosum (1,5-3,3 %), более высокие концентрации (в среднем выше в 1,7-2,0 раза) - для представителей видов Fucus vesiculosus и Fucus serratus. Характер изменений содержания общих полифенолов в фукусовых водорослях Мурмана, исследованный с использованием 3-факторного дисперсионного анализа MANOVA, свидетельствовал о том, что степень влияния солености морской воды наиболее значима. Меньшее влияние оказал фактор местообитания водорослей (комплекс индивидуальных абиотических характеристик конкретной локации). Фактор сезонности оказался статистически незначимым в отношении динамики накопления полифенолов в исследуемых фукоидах. Однако при детальном изучении была выявлена сезонная зависимость содержания полифенолов: представители Fucus vesiculosus и Fucus distichus накапливали полифенолы в весенний период. Наибольшее влияние на содержание общих полифенолов в водорослях Мурмана отмечено при взаимодействии факторов местообитания, солености, сезонности (38,75 %). Установлено, что F. vesiculosus является наиболее богатым по количеству фукостерина, полифенолов и экстрактивных веществ, чем другие массовые представители баренцевоморской флоры, такие как F. serratus, F. distichus и A. nodosum. Показано, что водоросли, произрастающие в губе Ярнышная (восточное побережье Баренцева моря), содержат в два раза больше фукостерина и полифенолов, чем те, что обитают в бухте Белокаменная, и в 13 раз больше по сравнению с водорослями Абрам-мыса.
Фукусовые водоросли, полифенолы, флороглюцин, фукостерин, абиотические факторы, баренцево море
Короткий адрес: https://sciup.org/14294997
IDR: 14294997 | УДК: 582.272:581.19:58.02 | DOI: 10.21443/1560-9278-2017-20-2-326-335
Текст научной статьи Стерины и полифенолы фукоидов мурманского побережья Баренцева моря
Фукусовые водоросли являются природными источниками биологически активных веществ (БАВ): полисахаридов, липидов, пигментов, стеринов, полифенолов и др. Качественные и количественные характеристики этих БАВ водорослей изменяются в зависимости от многих факторов, таких как вид водорослей (видоспецифичность), стадии развития растений, условия их произрастания и т. д. Представители рода Fucus – перспективные источники получения экстрактов, обогащенных полифенолами – растительными антиоксидантами, а также фитостеринов, обладающих широким спектром биологической активности. Данные соединения, выделенные из морских водорослей, используются в качестве ценного ресурса при изготовлении новых растительных лекарственных препаратов, которые ранее создавались на основе только высших наземных растений.
Полифенольные соединения фукоидов, как и других фукусовых водорослей, главным образом состоят из флоротаннинов – продуктов полимеризации флороглюцина (1,3,5-тригидроксибензола) (рис. 1, б) [1]. Почти все фенольные соединения являются активными метаболитами клеточного обмена и играют существенную роль в различных физиологических процессах (дыхании, фотосинтезе, росте, развитии и репродукции) [2]; флоротаннины участвуют в построении клеточных стенок, синтезируются в ответ на повреждения, а также экранируют солнечное УФ-излучение [3].
а б
Рис. 1. Структурные формулы фукостерола (а) и флороглюцина (б)
Fig. 1. The structural formula of fucosterol (a) and phloroglucinol (б)
Стерины (стеролы) – органические спирты, относящиеся к группе стероидов, составная часть неомыляемой фракции животных и растительных липидов. Наиболее распространенным стерином бурых водорослей является фукостерин, который содержится только в мембранах водорослей и отсутствует у высших растений [4].
Предположительно, и стерины и полифенолы участвуют в процессе адаптации растений к стрессовым условиям. Имеются данные, что растения, выращенные в условиях пониженной температуры, короткого дня или высокой засоленности почв, характеризуются измененным соотношением стеринов и фосфолипидов в мембранах, а также полифенолов. Кроме того, изменения в стериновом составе приводят к нарушениям активного и пассивного транспорта через мембраны, снижают активность мембранных ферментов [5]. Содержание фитостеринов и полифенолов водорослей Баренцева моря остается малоизученным.
Цель данной работы – изучение содержания фитостеринов и полифенолов в фукусовых водорослях, собранных в разных биотопах мурманского побережья Баренцева моря.
Материалы и методы
Объектом исследования послужили водоросли Fucus vesiculosus, F. serratus, F. distichus, Ascopyllum nodosum как наиболее распространенные представители фукоидов в Баренцевом море.
Водоросли для исследования содержания общих фенолов были собраны в 2012–2014 гг. в течение четырех гидрологических сезонов (зима, весна, лето, осень) в экспедициях ФГБУН ММБИ КНЦ РАН на станциях в губах и заливах Кольского полуострова. Для сравнения были выбраны акватории Западного, Восточного и Центрального Мурмана (рис. 2), в разной степени подверженные антропогенному влиянию [6]. В каждой акватории станции были выбраны на основании данных литературы и собственных измерений таким образом, чтобы соленость воды имела максимальное и минимальное значения (табл. 1).
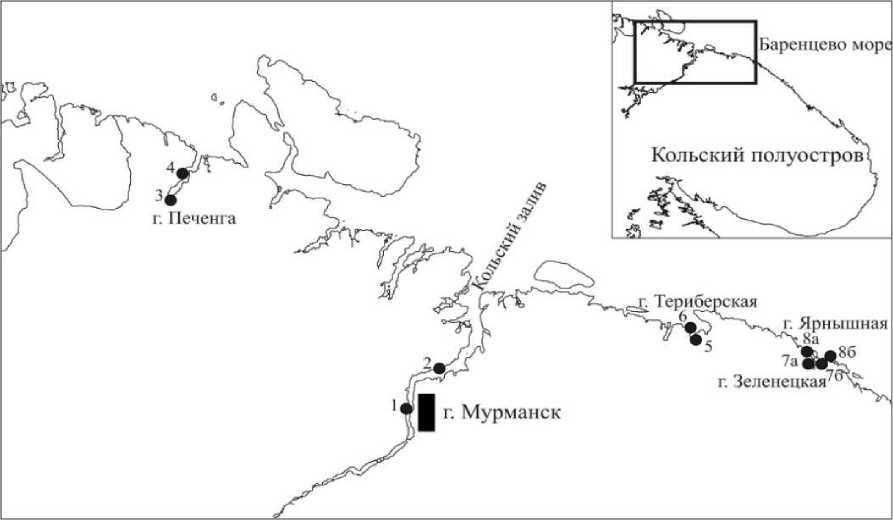
Рис. 2. Район исследований
Fig. 2. The study area
Сбор водорослей для определения стеринов и полифенолов производился в июле, сентябре, а также в период с октября по декабрь 2016 г. в различных по абиотическим факторам и антропогенному влиянию биотопах мурманского побережья Баренцева моря [6]: бухте Белокаменная, губе Ярнышная (рис. 2).
Для исследования были собраны растения в возрасте 4+…7+ лет. Образцы водорослей были заморожены и хранились при температуре –30 ºС.
Полифенолы и стерины извлекали из замороженных измельченных слоевищ водорослей методом перколяции. В качестве экстрагента использовали 96%-й раствор этилового спирта. Экстракцию этанолом проводили при комнатной температуре.
Содержание общих полифенолов определяли по модифицированной методике с использованием реактива Фолина – Чокальтеу [1] в пересчете на флороглюцин (Merck, номер в каталоге № 203-611-2).
Для количественного определения фитостеринов использовали реакцию с раствором серной кислоты (72%-й раствор H 2 SO 4 ) и 8%-м раствором ванилина [7]. Содержание стеринов определяли относительно стандартов фукостерина (Sigma, номер в каталоге № F5379), стигмастерина (Fluka, номер в каталоге № 85860), эргокальциферола (Fluka, номер в каталоге № 95220). Подобраны условия проведения реакции и концентрации реагентов для исследуемых водорослей. Измерения проводили методом спектрофотометрии.
Абсолютно сухую массу образцов определяли согласно общепринятой методике (ГОСТ 26185-84. Водоросли морские, травы морские и продукты их переработки. Методы анализа).
Определение содержания липофильных веществ проводили согласно общей фармакопейной статье (Государственная фармакопея Российской Федерации. XIII издание. ОФС.1.5.3.0006.15). В качестве растворителя использовали 96%-й этанол. Маннит из экстракта был удален.
Таблица 1. Характеристика районов сбора и среднее содержание общих фенолов в фукусовых водорослях Мурмана 2012–2014 гг.
Table 1. Characteristics of collection areas and the average content of total phenols in fucus algae of Murman, 2012–2014
|
Район сбора проб |
CL S Я H |
Место сбора проб |
H о 2 о ч о и |
и ® с к В 1 5 &S |
Концентрации общих фенолов, % а.с.м. (n = 15) |
|||
|
F. vesiculosus |
F. distichus |
F. serratus |
A. nodosum |
|||||
|
Кольский залив |
1 |
Абрам-мыс |
19–25 |
6.6 |
2.24 ± 0.02 |
2.03 ± 0.09 |
– |
1.59 ± 0.08 |
|
2 |
Бухта Белокаменная |
29–33 |
4.6 |
5.34 ± 0.50 |
5.36 ± 0.25 |
4.98 ± 0.10 |
2.24 ± 0.11 |
|
|
Губа Печенга |
3 |
Кут губы Печенга |
21–25 |
8.4 |
3.47 ± 0.07 |
– |
– |
– |
|
4 |
Бухта Девкина Заводь |
30–34 |
6.0 |
5.41 ± 0.38 |
3.00 ± 0.17 |
7.63 ± 0.41 |
3.33 ± 0.56 |
|
|
Губа Териберская |
5 |
Губа Корабельная |
21–25 |
4.2 |
4.01 ± 0.13 |
5.29 ± 0.26 |
6.55 ± 0.30 |
1.91 ± 0.05 |
|
6 |
Губа Лодейная |
25–30 |
9.0 |
8.63 ± 0.88 |
9.62 ± 1.12 |
7.76 ± 0.72 |
7.06 ± 1.01 |
|
|
Губа Ярнышная |
7а |
Бухта Бобровая |
12–15 |
3.0 |
5.85 ± 0.43 |
3.01 ± 0.29 |
3.19 ± 0.17 |
1.57 ± 0.09 |
|
8а |
Центральная часть губы Ярнышная |
32–34 |
1.9 |
4.07 ± 0.19 |
3.85 ± 0.24 |
4.46 ± 0.12 |
3.36 ± 0.46 |
|
|
Губа Зеленецкая |
7б |
Губа Оскара |
25–30 |
2.8 |
5.42 ± 0.34 |
5.16 ± 0.19 |
7.28 ± 0.42 |
4.76 ± 0.37 |
|
8б |
Бухта Прибойная |
33–34 |
2.0 |
2.52 ± 0.03 |
1.31 ± 0.10 |
3.19 ± 0.22 |
1.76 ± 0.04 |
|
Примечание: а.с.м. – абсолютно сухая масса.
Определение содержания полифенолов и фитостеринов проводили в трехкратной повторности.
Полученные данные были обработаны с использованием программы Microsoft Excel, включающей математические и статистические формулы.
Трехфакторный дисперсионный анализ (MANOVA) был использован для изучения влияния факторов сезонности, места обитания, солености (и их взаимодействий) на содержание общих полифенолов фукусовых водорослей Мурмана; в процессе анализа применяли программу NCSS Statistical and Data Analysis v2005.
Результаты и обсуждение
Исследование содержания общих фенолов в акватории Западного, Восточного и Центрального Мурмана в 2012–2014 гг.
Полученные результаты исследования среднего содержания общих полифенолов в фукоидах акваторий мурманского побережья Баренцева моря заметно различаются (табл. 1). Во всех фукусовых водорослях обнаружены максимальные концентрации полифенолов (7,06–9,62 %) в губе Лодейная, которая характеризуется наибольшим уровнем загрязнения тяжелыми металлами по сравнению с указанными районами [6], что подтверждается и другими исследованиями. Так, в работе Å. Forsberg et al. есть данные о том, что большие количества тяжелых металлов способствуют накоплению полифенолов в F. vesiculosus Балтийского моря [8]. При сравнении фукоидов Мурмана по содержанию полифенолов установлено, что минимальные значения характерны для A. nodosum (1,5–3,3 %), а у представителей F. vesiculosus и F. serratus обнаружены более высокие концентрации (в среднем выше в 1,7–2,0 раза).
Известно, что основными факторами, влияющими на биохимический состав водорослей-макрофитов, являются температура, соленость, химический состав морской воды, интенсивность движения воды, длина светового дня и другие абиотические факторы [9]. Макроводоросли отличаются от высших растений по многим показателям, в частности формированием и функционированием клеточных органоидов. Являясь водными организмами, водоросли постоянно контактируют с водной средой, реагируя на изменение внешних условий на биохимическом уровне. Фитохимический состав макроводорослей характеризуется видоспецифичностью и меняется в зависимости от местообитания (комплекса факторов), сезона сбора и т. п.
В работе K. Kyung-Tae (2012) [10] показано, что собранные в Канаде F.vesiculosus и A. nodosum содержат малое количество полифенолов в период с весны до раннего лета, после чего наблюдалось повышение уровня полифенолов вплоть до сентября. У A. nodosum в сентябре количество полифенолов было выше, чем в мае и июне, однако у F. vesiculosus наблюдалось увеличение количества полифенолов с августа и достигало максимальных значений в октябре – ноябре. Если сравнивать эти виды в июле, то в этот период A. nodosum содержит вдвое больше полифенолов, чем F. vesiculosus. Сентябрь и октябрь являются наиболее оптимальными месяцами для сбора канадских водорослей с целью выделения фенолов.
Согласно данным M. A. Ragan (1978) [11] по Норвежскому морю, высокие значения полифенолов у A. nodosum отмечены с октября по конец февраля. Минимальные количества этих соединений наблюдались с апреля по май, затем уровень начинал возрастать, достигая высоких зимних значений в августе – сентябре. У F. vesiculosus максимум наблюдался зимой, затем в марте начинался спад и минимум отмечался с мая по июнь. Затем высокие зимние значения вновь достигались в сентябре – октябре.
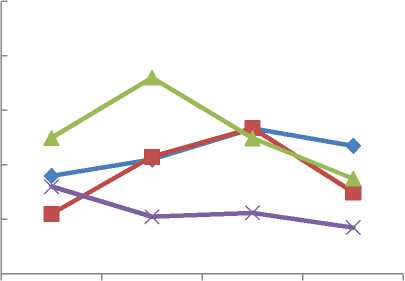
F. vesiculosus
-■- F. distichus
—*- F. serratus
A. nodosum октябрь февраль апрель июль
Рис. 3. Сезонные изменения содержания общих фенолов, % а.с.м., в фукусовых водорослях бухты Белокаменная в 2013–2014 гг. Fig. 3. Seasonal changes in the content of total phenols, % a.d.w. in fucus algae from the Belokamennaya Bay in 2013–2014
При исследовании сезонных изменений содержания полифенолов в четырех видах фукусовых водорослей (рис. 3) нами не выявлено единой тенденции. Водоросли F. vesiculosus и F. distichus накапливали полифенолы в весенний период, у F. serratus максимум полифенолов обнаружен в феврале, у A. nodosum – осенью. Эти данные касались водорослей, обитающих в районе бухты Белокаменная в 2013–2014 гг. Для других исследуемых акваторий сезонные изменения в накоплении полифенолов различны, невозможно выделить единой зависимости. Другими исследователями было показано, что для фукуса пузырчатого, обитающего в районе Абрам-мыса (Кольский залив), максимальное содержание полифенолов отмечается в весенний период, когда активизируются физиологические процессы [12]. В соответствии с результатами нашего исследования можно подтвердить данную закономерность для вида F. vesiculosus, обитающего в Кольском заливе.
Важным фактором, который выделяют исследователи биохимического состава водорослей, является соленость морской воды. Растения, обитающие в условиях пониженной солености, обладают меньшей "восстановительной способностью", чем те, что растут в условиях нормальной солености (около 35 ‰). Однако I. Munda (1960) [13] показал, что пересадка A. nodosum и F. vesiculosus из Норвежского моря в районы с другой (низкой или высокой) соленостью в большинстве случаев не имела эффекта. Вымыванию полифенолов способствовало распреснение [14] и умеренное [11] или интенсивное [14] освещение, а также увеличение солености [15]. В литературе не найдено фактов очевидной корреляции между соленостью, освещенностью и содержанием фенолов. Так, содержание полифенолов в A. nodosum неуклонно снижалось после февраля, в то время как количество солнечного света увеличивалось с марта по май. Однако уровень содержания полифенолов возрастал после этого периода несмотря на достаточное освещение с июля по август. Аналогичное уменьшение количества полифенолов наблюдалось задолго до каких-либо значительных изменений солености, температуры воды, уровня нитратов, и это количество увеличивалось вновь, хотя соленость была все еще низкой, температура воды была далека от максимальной и количество нитратов было минимальным [11].
Для выявления характера изменений содержания общих полифенолов в фукусовых водорослях Мурмана был проведен 3-факторный дисперсионный анализ MANOVA (табл. 2), который показал, что наибольшее влияние оказала соленость (11,25 %). Меньшее, но все же достоверное влияние имел фактор местообитания водорослей (6,09 %), включающий комплекс индивидуальных абиотических характеристик конкретной локации. Фактор сезонности оказался незначительным в нашем исследовании. Наибольшее влияние на содержание общих фенолов водорослей Мурмана оказало совместное взаимодействие факторов местообитания, солености, сезонности – 38,75 %. По критерию Фишера, статистическая модель достоверна (р < 0,05).
Таблица 2. Результаты 3-факторного дисперсионного анализа содержания общих полифенолов на примере F. vesiculosus Table 2. Results of three-way multivariate analyses of variance (MANOVA) in the content of total polyphenols, for example, F. vesiculosus
|
Фактор |
df |
F-test |
FstР(<0,05) |
η 2 , % |
|
Местообитание |
2 |
1330,89 |
3,26 |
6,09 |
|
Соленость |
1 |
4917,34 |
4,11 |
11,25 |
|
Сезон |
2 |
190,48 |
3,26 |
0,87 |
|
Местообитание + соленость |
2 |
636,94 |
3,26 |
2,92 |
|
Местообитание + сезон |
4 |
3216,80 |
2,63 |
29,44 |
|
Соленость + сезон |
2 |
2314,10 |
3,26 |
10,60 |
|
Местообитание + соленость + сезон |
4 |
4234,63 |
2,63 |
38,75 |
Исследование содержания фитостеринов и полифенолов в биотопах мурманского побережья Баренцева моря в 2016 г.
Результаты исследований, полученные в 2016 г., подтверждают тот факт, что F. vesiculosus является одним из наиболее богатых по количественному составу БАВ видом бурых водорослей Баренцева моря [16]. В них содержится наибольшее количество экстрактивных веществ липофильной природы, а также фитостеринов и полифенолов в сравнении с другими изученными видами (F. distichus, Ascopyllum nodosum). Причем данная закономерность справедлива для обеих исследованных локаций (бухты Белокаменная и губы Ярнышная), где были собраны разные виды бурых водорослей. Так, A. nodosum, содержащий наименьшее количество экстрактивных веществ, уступает фукусу пузырчатому по количеству фукостерина в среднем в 5,4 раза, полифенолов – в 4,3 раза, F. serratus и F. distichus – в 1,7–2,0 раза по содержанию как фукостерина, так и полифенолов (рис. 4, 5).
60,0
40,0
20,0
0,0
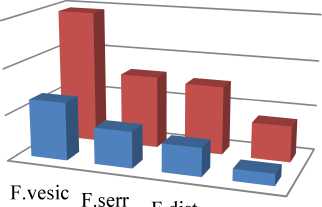
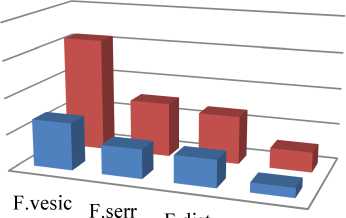
■ б. Белокаменная ■ г. Ярнышная
Рис. 4. Содержание фукостерина, мг/г
Fig. 4. The fucosterol content, mg/g
■ б. Белокаменная ■ г. Ярнышная
Рис. 5. Содержание суммы полифенолов, мг/г
Fig. 5. The content of total polyphenols, mg/g
Губа Ярнышная считается экологически чистым участком. Воды Кольского залива, особенно его южной части, характеризуются высоким уровнем загрязнения (начиная с 2004 г. оцениваются как грязные). Температурный режим районов сбора примерно одинаков в летне-осенний период [17].
Также установлено, что содержание фитостеринов и полифенолов в летне-осенний период выше в водорослях, собранных в губе Ярнышная, где сочетаются относительно мягкие климатические условия, хороший водообмен, узкий диапазон сезонной изменчивости среднемесячных и экстремальных значений температуры и солености воды [18]. Фитохимические показатели для водорослей данной местности по сравнению с обитающими в бухте Белокаменная выше в среднем в 1,8–3 раза. Важным фактором является степень антропогенной нагрузки в биотопах. Так, для губы Ярнышная она минимальна, а в бухте
Белокаменная отмечены нефтяные разливы, связанные с деятельностью пришвартованного вблизи залива рейдового перевалочного комплекса "Белокаменка". Выше в 2,4 раза и индекс загрязнения тяжелыми металлами по сравнению с губой Ярнышная. Учитывая тот факт, что в талломах водорослей, произрастающих в неблагоприятных условиях бухты Белокаменная, не накапливается большого количества стеринов и полифенолов, нельзя делать однозначные выводы об участии данных веществ в адаптации водорослей к окружающим условиям [3; 5].
В литературе есть данные о том, что фукостерин может накапливаться в мембранах клеток водорослей в период низких температур и низкого уровня освещения, что, возможно, является ответом на условия окружающей среды с целью сохранения целостности клеточных мембран [19]. Согласно литературным источникам температурный и световой факторы совместно влияют на количество фукостерола. По нашим ранее полученным результатам, наибольшее влияние на содержание полифенолов в фукоидах Баренцева моря оказывает соленостный режим вод биотопа, что нашло подтверждение и в данной работе.
В рамках настоящего исследования также было изучено содержание фукостерина и полифенольных соединений в F. vesiculosus Абрам-мыса в период с октября по декабрь 2016 г. Результаты, представленные на диаграмме (рис. 6), показали, что сумма экстрактивных веществ в талломе фукуса пузырчатого увеличивается к декабрю, а количество стеринов и полифенолов, наоборот, снижается. В декабре освещенность в течение дня была наименьшей в связи с наступлением периода полярной ночи; в этот месяц количество как фукостерина, так и полифенолов наименьшее. В октябре – ноябре количество полифенолов было выше в 1,4–1,5 раз, фукостерина – в 1,3–1,4 раза.
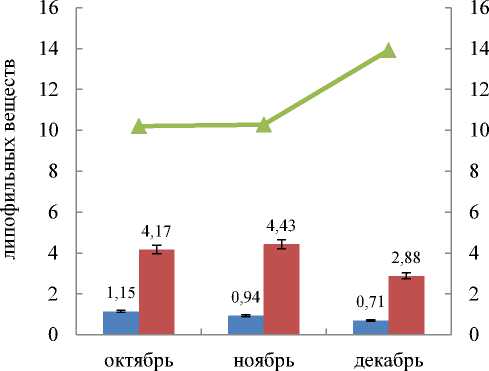
^^ Фукостерин
^^ Полифенолы
—*—Липофильные вещества
Рис. 6. Содержание фукостерина и суммы полифенолов в водорослях F. Vesiculosus Абрам-мыса, % от суммы липофильных веществ Fig. 6. The content of fucosterol and total polyphenols from F. vesiculosus from the cape Abram-Mys, % of the amount of lipophilic substances
Согласно литературным источникам в водоросли Sargassum horneri в октябре содержание фукостерола составляло 19,0 % от общих липидов, ноябре – 16,2, декабре – 14,7 %, максимальное количество данного соединения наблюдалось в мае (19,8 %), минимальное – в марте (10 %). Температура и длина светового дня снижались с октября по декабрь [19]. В другом исследовании, проводившемся с новозеландскими водорослями Undaria pinnatifida, установлено, что наибольшее количество неомыляемых липидов, а именно фукостерола и 24-метиленхолестерола, наблюдалось в зимний период, летом эти показатели значительно уменьшались [20]. В работе Honya et al. (1994) [21] говорится о том, что количество фукостерола и токоферола в бурой водоросли Laminaria japonica, обитающей в Японском море, достигает максимального значения зимой и быстро снижается осенью. Согласно данным S. S. Popov et al. (1985) [22] большое влияние на биосинтез, накопление и соотношение стеринов в водорослях Черного моря оказывает температура воды.
Сравнивая представленные в работе данные, полученные в 2016 г., можно сделать вывод о том, что количество фукостерина и полифенолов в водорослях F. vesiculosus, произрастающих в районе Абрам-мыса, в 5–13 раз меньшее, чем у тех, что произрастают в губе Ярнышная и бухте Белокаменная (рис. 7). При сопоставлении данных о содержании полифенолов в F. vesiculosus, собранных на Абрам-мысе, со средними значениями результатов, полученных в период 2012–2014 гг. (табл. 1), выявлено существенное снижение содержания этих веществ (с 2,2 до 0,4 %) в осенне-зимний период 2016 г., что, вероятно, связано с меняющимся в течение года физиологическим состоянием водорослей, абиотическими условиями, а также уровнем загрязнения в данном районе. Следует отметить, что проведенное исследование содержания фукостерина в фукусовых водорослях Мурмана является началом комплексного исследования БАВ и выводы носят предварительный характер.
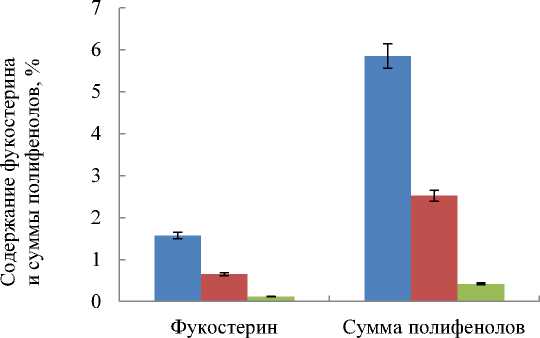
■ г. Ярнышная
■ б. Белокаменная
■ м. Абрам-мыс
Рис. 7. Содержание фукостерина и суммы полифенолов в водорослях Fucus vesiculosus, собранных в разных районах, % от абсолютно сухой массы
Fig. 7. The content of fucosterol and total polyphenols in seaweeds Fucus vesiculosus from different areas, % a.d.w.
Заключение
В результате проведенных исследований можно сделать следующие выводы:
-
1. Обнаружены максимальные концентрации полифенолов (7,06–9,62 %) во всех фукусовых водорослях губы Лодейная, которая характеризуется наибольшим уровнем загрязнения тяжелыми металлами. При сравнении содержания полифенолов в фукоидах Мурмана установлено, что минимальные значения характерны для Ascophyllum nodosum (1,5–3,3 %), более высокие концентрации (в среднем выше в 1,7–2,0 раза) – для представителей Fucus vesiculosus и Fucus serratus.
-
2. Характер изменений содержания общих полифенолов в фукусовых водорослях Мурмана, исследованный с использованием 3-факторного дисперсионного анализа MANOVA, свидетельствует о том, что степень влияния солености морской воды наиболее значима. Меньшее влияние оказывает фактор местообитания водорослей (комплекс индивидуальных абиотических характеристик конкретной локации). Фактор сезонности оказался статистически незначимым в отношении динамики накопления полифенолов в исследуемых фукоидах. Однако при детальном изучении выявлена сезонная зависимость содержания полифенолов: представители Fucus vesiculosus и Fucus distichus накапливали полифенолы в весенний период. Наибольшее влияние на содержание общих полифенолов в водорослях Мурмана отмечено при взаимодействии факторов местообитания, солености, сезонности (38,75 %).
-
3. Водоросли Fucus vesiculosus являются наиболее богатыми по количеству фукостерина, полифенолов и экстрактивных веществ при сопоставлении их с другими массовыми представителями баренцевоморской флоры, такими как F. serratus, F. distichus и A. nodosum. Фукоиды, произрастающие в губе Ярнышная (восточное побережье Баренцева моря), содержат в два раза больше фукостерина и полифенолов, чем те, что обитают в бухте Белокаменная, и в 13 раз больше по сравнению с водорослями Абрам-мыса.
Работа выполнена в рамках Госзадания ММБИ КНЦ РАН на 2017 г. (базовое финансирование ФАНО) по теме "Научные основы инновационных технологий БАВ водорослей Баренцева моря", № в ГЗ 0228-2014-0015.
Список литературы Стерины и полифенолы фукоидов мурманского побережья Баренцева моря
- Van Alstyne K. L. Comparison of three methods for quantifying brown algal polyphenolic compounds//Journal of Chemical Ecology. 1995. V. 21, Iss. 1. P. 45-58.
- Bhakuni D. S., Rawat D. S. Bioactive marine natural products. New York: Springer, 2005. 400 p.
- Pavia H., Cervin G., Lindgren A., Ǻberg P. Effects of UV-B radiation and simulated herbivory on phlorotannins in the brown alga Ascophyllum nodosum//Marine ecology progress series. 1997. V. 157. P. 139-146.
- Simonsen A. C., Bagatolli L. A., Duelund L. . Effects of seaweed sterols fucosterol and desmosterol on lipid membranes//Biophysical Journal. 2009. V. 96, Iss. 3. Supplement 1. P. 606a.
- Лутова Л. А., Шумилина Г. М. Метаболиты растений и их роль в устойчивости к фитопатогенам//Экологическая генетика. 2003. Т. 1, № 0. С. 47-58.
- Облучинская Е. Д., Алешина Е. Г., Матишов Д. Г. Сравнительная оценка загрязнения металлами губ и заливов Мурмана по индексу MPI (Metal pollution index)//Доклады академии наук. 2013. Т. 448, № 5. С. 588-591.
- Минина С. А., Легостева А. Б. Способ количественного определения действующих веществ в сырье и лекарственных формах женьшеня//Бюллетень изобретений. 1989. № 18. А. с. 1480568 (СССР).
- Forsberg Å., Söderlund S., Frank A., Petersson L. R., Pedersén M. Studies on metal content in the brown seaweed, Fucus vesiculosus, from the Archipelago of Stockholm//Environmental Pollution. 1998. V. 49. P. 245-263.
- Облучинская Е. Д. Влияние факторов внешней среды на содержание полисахаридов фукуса пузырчатого Fucus vesiculosus L.//Химия растительного сырья. 2011. № 3. С. 47-51.
- Kyung-Tae К. Seasonal variation of seaweed components and novel biological function of fucoidan extracted from brown algae in Quebec: doctoral dissertation. Université Laval, 2012. 142 p.
- Ragan M. A., Jensen A. Quantitative studies on brown algal phenols. II. Seasonal variation in polyphenol content of Ascophyllum nodosum (L.) Le Jol. and Fucus vesiculosus (L.)//Journal of Experimental Marine Biology and Ecology. 1978. V. 34. P. 245-258.
- Рыжик И. В. Содержание растворимых флоротаннинов у Fucus vesiculosus L. Кольского залива//Современные проблемы экологии и природопользования: сб. материалов региональной науч.-практ. конф. Мурманск: МГТУ, 2014. С. 192-195.
- Munda I. Der Einfluss von Chlorinität auf die chemische Zusammensetzung, Wachstum und Fruktifizierungstätigkeit von einingen Fucaccen. Norsk Inst. for Tang-og Tareforsk. Forelobige Rapp. 1960. N 111. P. 87.
- Sieburth J. McN. Studies on algal substances in the sea. III. The production of extracellular organic matter by littoral marine algae//Journal of Experimental Marine Biology and Ecology. 1969. V. 3. P. 290-309.
- Sieburth J. McN., Jensen A. Studies on algal substances in the sea. II. The formation of geldstoff (humic material) by exudates of Phaeophyta//Journal of Experimental Marine Biology and Ecology. 1969. V. 3. P. 275-289.
- Клиндух М. П., Облучинская Е. Д. Сравнительное исследование химического состава бурых водорослей Fucus vesiculosus и Ascophyllum nodosum//Вестник МГТУ. 2013. Т. 16, № 3. С. 466-471.
- Малавенда С. В., Комракова Д. Г., Малавенда С. С. Изменения структуры литоральных фитоценозов Мурмана при антропогенном воздействии//Вестник МГТУ. 2013. Т. 16, № 3. С. 486-492.
- Ильин Г. В., Моисеев Д. В., Широколобов Д. В., Дерябин А. А., Павлова Л. Г. Гидрологический режим губы Зеленецкая, Восточный Мурман//Вестник МГТУ. 2016. Т. 19, № 1/2. С. 268-277.
- Masaru Terasaki, Chikara Kawagoe, Atsushi Itoet . Spatial and seasonal variations in the biofunctional lipid substances (fucoxanthin and fucosterol) of the laboratory-grown edible Japanese seaweed (Sargassum horneri Turner) cultured in the open sea. URL: http://www.sciencedirect.com/science/article/pii/S1319562X16000115.
- Boulom S., Robertson J., Hamid N., Ma Q., Lu J. Seasonal changes in lipid, fatty acid, α-tocopherol and phytosterol contents of seaweed, Undaria pinnatifida, in the Marlborough Sounds, New Zealand//Food Chemistry. 2014. V. 161, N 15. P. 261-269.
- Honya M., Kinoshita T., Ishikawa M., Mori H., Nisizawa K. Seasonal variation in the lipid content of cultured Laminaria japonica: Fatty acids, sterols, b-carotene and tocopherol//Journal of Applied Phycology. 1994. V. 6. P. 25-29.
- Popov S. S., Marekov N. L., Konaklieva M. I., Panayotova M. I., Dimitrova-Konaklieva S. Sterols from some Black Sea Ulvaceae//Phytochemistry. 1985. V. 24, N 9. Р. 1987-1990.


