Структура атеросклеротической бляшки как определяющий фактор цереброваскулярной реактивности при стенозирующем атеросклерозе сонных артерий
Автор: Максимова Александра Сергеевна, Бобрикова Евгения Эдуардовна, Буховец Ирина Львовна, Плотников Михаил Павлович, Усов Владимир Юрьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.31, 2016 года.
Бесплатный доступ
Цель исследования: сопоставление структуры каротидной бляшки, визуализированной с помощью магнитно-резонансной томографии (МРТ), и реактивности сосудов головного мозга, оцененной с помощью ультразвукового исследования, у пациентов с распространенным атеросклерозом и стенозирующим поражением сонных артерий. Всем пациентам выполнялась МРТ головного мозга и области сонных артерий. Цереброваскулярный резерв оценивали с помощью транскраниального ультразвукового исследования средних мозговых артерий с определением показателей кровотока в условиях функциональных тестов: проб с задержкой дыхания и гипервентиляцией. При проведении пробы с задержкой дыхания у большинства (56%) пациентов с гипоинтенсивной в Т1-ВИ (взвешенных изображениях) и гиперинтенсивной в Т2-ВИ МРТ-картиной бляшки наблюдалась однонаправленная с обеих сторон положительная реакция при функциональной гиперкапнической нагрузке с задержкой дыхания. Напротив, однонаправленная отрицательная либо отрицательная реакция на стороне стеноза выявлялись у пациентов, имеющих гиперинтенсивную бляшку в Т1-ВИ и гипоинтенсивную в Т2-ВИ, по данным МРТ. Проведение МРТ стенок артерий с оценкой структуры атеросклеротической бляшки может быть рекомендовано в качестве скринингового метода у всех пациентов групп риска атеросклероза.
Атеросклероз, сонные артерии, магнитно-резонансная томография, цереброваскулярный риск
Короткий адрес: https://sciup.org/14920106
IDR: 14920106 | УДК: 616.133.333-073.43-073.8
Текст научной статьи Структура атеросклеротической бляшки как определяющий фактор цереброваскулярной реактивности при стенозирующем атеросклерозе сонных артерий
В настоящее время в большинстве стран атеросклероз и его осложнения остаются одной из основных причин смертности взрослого населения, в первую очередь, за счет инфаркта миокарда (ИМ) и ишемического инсульта [1, 2]. При этом нетрудоспособность не только ухудшает функциональное состояние и социальную роль выживших после инсульта, но также приводит и к весьма существенным бюджетным затратам. В последние годы представлены убедительные свидетельства давно сформулированной концепции [1, 3], что едва ли не основную роль в прогрессировании атеросклеротических бляшек и нарушении их стабильности играют vasa vasorum бляшки, развивающиеся при ее патологической васкуляриза- ции. По мере развития атеросклеротической бляшки vasa vasorum обильно врастают в нее и создают обширную поверхность для миграции лейкоцитов, проникновения атрогенных липидов и формирования микрогеморрагий внутрь бляшки [4, 5]. Для оценки морфологии собственно атеросклеротических бляшек, изменений стенок артерий, наряду с ультразвуковыми технологиями, в последнее время широко применяется МРТ и магнитно-резонансная ангиография (МРА) [6, 7]. В свою очередь для оценки состояния цереброваскулярного сосудистого резерва при атеросклеротическом поражении сосудов шеи и головного мозга неизменно широко используются методы ультразвуковой диагностики. При этом проведение нагрузочного тестирования, направленного на активацию механизмов ауторегуляции, позволяет зарегистрировать локальные и/или генерализованные нарушения цереброваскулярной реактивности. Однако парадоксальным образом взаимоотношения цереброваскулярной реактивности у пациентов с гемодинамически значимым стенозом брахиоцефальных артерий с конкретными характеристиками выявленных атеросклеротических бляшек остаются малоизученными.
Цель исследования: оценка взаимосвязи структуры бляшки пораженной артерии, визуализированной с помощью МРТ, и реактивности сосудов головного мозга, определяемой с помощью ультразвуковых методик, у пациентов с каротидным атеросклерозом.
Задачи:
-
1. Изучить МРТ-структуру атеросклеротической бляшки, сгруппировать возможные типы бляшек по данным МРТ.
-
2. Оценить реактивность сосудов головного мозга с помощью транскраниальной допплерографии, сгруппировать наблюдаемые типы реакций мозгового кровотока.
-
3. Сопоставить структуру бляшки по данным МРТ и тип реактивности церебрального кровотока по данным ультразвуковых методик.
Материал и методы
В исследование включен 21 пациент в возрасте от 50 до 78 лет с гемодинамически значимым стенозом брахиоцефальных артерий более 70%. Крупноочаговые инсульты головного мозга не были отмечены ни у кого из включенных в исследование и служили критерием исключения. Всем пациентам впоследствии была проведена каротидная эндартерэктомия (КЭЭ) с проведением затем морфологического исследования удаленной атеросклеротической бляшки.
Исследование проводилось на томографе Toshiba Titan Vantage с индукцией магнитного поля 1,5 Т. Всем пациентам выполнялась МРТ области сонных артерий перпендикулярно ходу общей сонной артерии с получением аксиальных томосрезов сонных артерий толщиной 1– 2,5 мм. Были получены Т1- и Т2-взвешенные МРТ-изоб-ражения (Т1-ВИ и Т2-ВИ), а также изображения в 3D вре-мя-пролетном режиме области бифуркации сонных артерий. Параметры исследований составляли соответственно: Т1-ВИ: TR=900–1000 мс, TE=10 мс, запись проводилась в матрицу 256х256 вокселей, при этом размер вокселя составлял соответственно 0,2х0,2х2 мм. Для Т2-ВИ: TR=3000–4000 мс, TE=100–105 мс. По данным визуальной оценки T1-ВИ и T2-ВИ области каротидного стеноза были выделены четыре возможных типа наблюдаемых бляшек:
-
1. Смешанная бляшка с выраженным фиброзированием и липидным ядром – изображение бляшки усилено в T1-ВИ и в T2-ВИ.
-
2. Бляшка с преобладанием липидного компонента – изображение не усилено в T1-ВИ и усилено в T2-ВИ.
-
3. Бляшка с микрогеморрагиями – изображение усиле-
- но в T1-ВИ и не усилено в T2-ВИ.
-
4. Кальцинированная бляшка – изображение не усилено ни в T1-ВИ, ни в T2-ВИ.
Впоследствии тип бляшки, определенный при МРТ-исследовании сонных артерий, был подтвержден данными морфологического послеоперационного исследования во всех случаях.
Исследование проводилось на ультразвуковом диагностическом аппарате General Electric – Vivid 7 Dimension и Vivid 9 в В-режиме, режимах цветного и импульсноволнового допплеровского картирования. Транскраниальное исследование средних мозговых артерий (СМА) проводилось по общепринятой методике с помощью секторного датчика M5S (1,5–4,5 МГц). Ультразвуковое исследование синхронизировалось с работой сердца под контролем артериального давления и частоты сердечных сокращений. Для оценки цереброваскулярного резерва фоновые параметры кровотока по СМА определяли в исходном состоянии и в условиях функциональных тестов: в условиях модифицированной гиперкапнической пробы с произвольной задержкой дыхания на максимально возможное для пациента время и модифицированной гипокапнической – гипероксической пробы с форсированной гипервентиляцией в течение 60 с [8]. Рассчитывалась усредненная по времени максимальная скорость кровотока (TAMX) в СМА с обеих сторон. На основании полученных данных определяли индекс реактивности, отражающий изменения параметра TAMX. При проведении теста с задержкой дыхания вазодилататорной направленности индекс реактивности рассчитывался как отношение показателя TAMX после пробы к аналогичному значению до пробы (ИР=TAMXпосле/TAMXдо). При оценке индекса реактивности после вазоконстрикторной нагрузки (проба с форсированным дыханием) рассчитывалось соотношение показателя TAMX до пробы и после пробы (ИР=TAMXдо/TAMXпосле) [9]. В контрольную группу исследования вошли 7 здоровых добровольцев, не имеющих данной патологии.
Для оценки типа реакции кровотока на проводимую стимуляцию и последующего анализа активности ауторегуляторных механизмов использовалась следующая общепринятая классификация [9]:
– положительная реакция (соответствует норме – сохранности цереброваскулярного резерва), индекс реактивности 1,1–1,4;
– отрицательная реакция (соответствует исчерпанности цереброваскулярного резерва при функциональной пробе), индекс реактивности 0,9–1,1;
– парадоксальная реакция (соответствует фактической декомпенсации цереброваскулярного резерва в покое), индекс реактивности менее 0,9.
Статистическая обработка результатов была проведена в программе SPSS 11.05.0, с применением t-критерия Стьюдента для анализа количественных данных, подчиняющихся нормальному закону распределения, а также точного критерия Фишера для анализа малых выборок качественных данных.
Таблица 1
Соотношение положительных, отрицательных и парадоксальных реакций в СМА при проведении нагрузочных тестов с задержкой дыхания и гипервентиляцией
|
Показатели |
Положительная реакция |
Отрицательная реакция |
Парадоксальная реакция |
|
|
Проба с гиперкапнией (n=21) |
Сторона стеноза |
7 |
6 |
8 |
|
Контралатеральная сторона |
11 |
6 |
4 |
|
|
Проба с гипокапнией (n=15) |
Сторона стеноза |
11 |
3 |
1 |
|
Контралатеральная сторона |
9 |
1 |
5 |
|
Таблица 2
Соотношение типов реакций в одноименных СМА при проведении нагрузочных тестов с задержкой дыхания и гипервентиляцией
|
Показатели |
Однонаправленная положительная реакция |
Однонаправленная отрицательная реакция |
Разнонаправленная реакция |
|
Проба с гиперкапнией (n=21) |
5 |
8 |
8 |
|
Проба с гипокапнией (n=15) |
7 |
2 |
2 |
Таблица 3
Показатели индекса реактивности СМА (среднее±стандартное отклонение) при проведении функциональных проб в группе исследования и контрольной группе
|
Показатели |
Группа исследования |
Контрольная группа |
||
|
Сторона стеноза |
Контралатеральная сторона |
Правая сторона |
Левая сторона |
|
|
Проба с гиперкапнией (n=21) |
0,98±0,20 p<0,001 |
1,16±0,35 p>0,05 |
1,28±0,14 |
1,14±0,20 |
|
Проба с гипокапнией (n=15) |
1,28±0,29 p>0,05 |
1,18±0,36 p>0,05 |
1,10±0,22 |
1,33±0,15 |
Примечание: * – уровень статистической значимости различий p – по сравнению с контрольной группой.
Результаты
По направленности реакции мозгового кровотока при функциональном тестировании с оценкой методом транскраниального ультразвукового исследования (УЗИ) все пациенты были разделены на три группы:
-
1. С однонаправленной положительной реакцией (при положительной реакции в парных СМА).
-
2. С однонаправленной отрицательной реакцией (при двусторонних отрицательных либо парадоксальных реакциях или их сочетании в СМА).
-
3. С разнонаправленной реакцией (при односторонней положительной реакции в сочетании с отрицательным либо парадоксальным ответом контралатераль-но) [9].
Данные о распределении пациентов на группы представлены в таблице 1.
При оценке изменений параметров кровотока по СМА в ответ на определенное воздействие оценивали реакцию не только в бассейне пораженной артерии, но и на про- тивоположной стороне (табл. 2). При проведении пробы с задержкой дыхания у большинства пациентов наблюдалась однонаправленная отрицательная либо парадоксальная реакция, при проведении гипероксической пробы – однонаправленная положительная реакция.
У пациентов с гемодинамически значимым стенозом наблюдались статистически значимые различия индекса реактивности на стороне стеноза при проведении пробы с задержкой дыхания в сравнении с контрольной группой, тогда как при проведении гипервентиляционного теста значимых различий обнаружено не было (табл. 3).
При анализе МРТ области сонных артерий у наших пациентов мы в данной работе сознательно ограничились результатами исследований без дополнительного парамагнитного контрастирования. Это вызвано тем, что в рутинной практике время-пролетная МРА сосудов головного мозга выполняется намного чаще и в выполнении легче, чем методики контрастированной МРА. В связи с этим выглядит весьма важным и заманчивым получение возможности выявлять наиболее прогностически опасные бляшки каротидных артерий уже по данным исходного неконтрастированного МРТ-исследова-ния в соответствии с представленными выше типами бляшек [10].
По выделенным нами группам гиперинтенсивное изображение бляшки в T1-ВИ и T2-ВИ (смешанная бляшка с выраженным фиброзированием и липидным ядром) было обнаружено у одного пациента; гипоинтенсивное в Т1-ВИ и гиперинтенсивное в T2-ВИ (бляшка с преобладанием липидного компонента) – у 9 пациентов; гиперинтенсивное изображение в T1-ВИ, гипоинтенсивное в Т2-ВИ (бляшка с микрогеморрагиями) – у 5 пациентов; полностью кальцинированных бляшек, дающих одновременно гипоинтенсивный сигнал и в Т1-ВИ, и в Т2-ВИ, обнаружено не было.
Поскольку целью данного исследования было сопоставление структуры атеросклеротической бляшки и реактивности СМА, мы оценили взаимосвязь непосредственно МРТ-картины атеросклеротической бляшки (типы бляшек) и сочетанную реакцию реактивности (однонаправленная положительная, однонаправленная отрицательная и разнонаправленная реакция) при проведении функциональных проб на обеих сторонах исследования. Полученные результаты при проведении пробы с задер-
Таблица 4
Взаимосвязь структуры бляшки, определенной по данным МРТ, и направленности реакции мозгового кровотока при функциональной пробе с задержкой дыхания – гиперкапнией, по данным ультразвукового исследования (n=15)
|
Показатели |
Структура бляшки (тип по данным МРТ) |
|
Т1-ВИ усилен, Т1-ВИ не усилен, Т1-ВИ усилен, Т1-ВИ не усилен, Т2-ВИ усилен Т2-ВИ усилен Т2-ВИ снижен Т2-ВИ не усилен |
|
|
Однонаправленная положительная реакция Однонаправленная отрицательная реакция Разнонаправленная реакция (отрицательная на стороне стеноза) |
–5–– 132– –13– |
Таблица 5
Взаимосвязь структуры бляшки, по данным МРТ-исследования, и направленности реакции мозгового кровотока при функциональной пробе с гипервентиляцией, по данным ультразвукового исследования (n=11)
|
Показатели |
Структура бляшки (тип по данным МРТ) |
|
Т1-ВИ усилен, Т1-ВИ не усилен, Т1-ВИ усилен, Т1-ВИ не усилен, Т2-ВИ усилен Т2-ВИ усилен Т2-ВИ не усилен Т2-ВИ не усилен |
|
|
Однонаправленная положительная реакция Однонаправленная отрицательная реакция Разнонаправленная реакция (отрицательная на стороне стеноза) |
13–– –11– –23– |
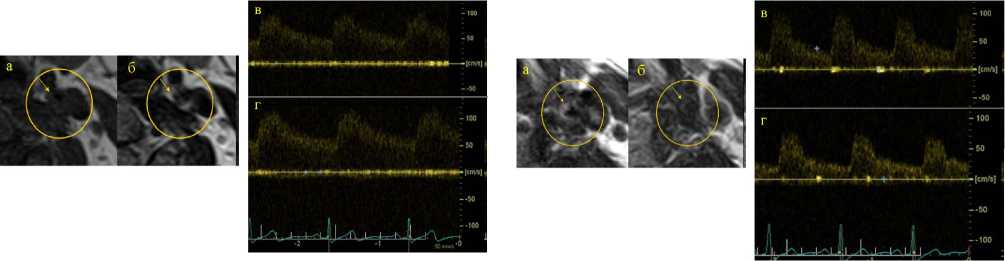
Рис. 2. МРТ-исследование в аксиальных срезах и ультразвуковое исследование – допплеровский спектр кровотока СМА у пациента с разнонаправленной реакцией на нагрузку при проведении гиперкапнической пробы. а – Т1-взв. SE МРТ; б – Т2-взв. SE МРТ; в – допплеровский спектр СМА на стороне гемодинамически значимого стеноза у пациента в покое; г – допплеровский спектр СМА на стороне гемодинамически значимого стеноза (75%) у пациента при проведении пробы с задержкой дыхания. На МРТ видна гиперинтенсивная в Т1-ВИ и гипоин-тенсивная в Т2-ВИ атеросклеротическая бляшка (стрелки) – вследствие микрогеморрагии в бляшку. Индекс реактивности СМА на этой стороне при проведении гиперкапнической пробы = 0,78 – парадоксальная реакция
Рис. 1. МРТ-исследование в аксиальных срезах и ультразвуковое исследование – допплеровский спектр кровотока СМА у пациента с однонаправленной положительной реакцией на нагрузку. а – Т1-взв. SE МРТ; б – Т2-взв. SE МРТ; в – допплеровский спектр СМА на стороне гемодинамически значимого стеноза у пациента в покое; г – допплеровский спектр СМА на стороне гемодинамически значимого стеноза у пациента при проведении пробы с задержкой дыхания. На МРТ визуализируется гипоинтенсивная в Т1-ВИ и гиперинтенсивная в Т2-ВИ атеросклеротическая бляшка (стрелки) – с преобладанием липидного ядра. Индекс реактивности СМА при проведении гиперкапнической пробы = 1,12 – положительная реакция жкой дыхания представлены в таблице 4, при проведении пробы с гипервентиляцией – в таблице 5.
Проведенный статистический анализ показал, что при использовании нагрузочного теста с задержкой дыхания найдена взаимосвязь между определенной при МРТ структурой бляшки и направленностью реакции кровотока (p=0,081), при этом можно предположить, что при увеличении выборки вероятность ошибки станет меньше, так как полученное значение p достаточно близко к пороговому. При проведении пробы с гипервентиляцией значимых различий обнаружено не было. При проведении пробы с задержкой дыхания у большинства (56%) пациентов с гипоинтенсивной в Т1-ВИ и гиперинтенсивной в Т2-ВИ МРТ-картиной бляшки наблюдалась однонаправленная положительная реакция на нагрузку (типичный пример представлен на рисунке 1). Однонаправленная отрицательная либо отрицательная реакция на стороне стеноза (разнонаправленная в целом) выявлялись у пациентов, имеющих гиперинтенсивную бляшку в Т1-ВИ и гипоинтенсивную в Т2-ВИ по данным МРТ (типичный пример на рисунке 2).
Обсуждение
В доступной литературе нам не удалось найти прямых сопоставлений показателей типологии атеросклеротических бляшек сонных артерий, по данным МРТ (или иного лучевого исследования) и показателей реактивности кровотока в артериях головного мозга при дуплексном сканировании, хотя взаимосвязь между наличием критического стеноза и патологическими очаговыми изменениями головного мозга по данным МРТ хорошо подтверждена [6, 7]. Поэтому наше исследование имело своей целью, в первую очередь, выявить типы атеросклеротических бляшек, видимых при МРТ-исследовании уже и до проведения контрастирования парамагнетиком, которые сопровождаются патологическими типами реакций кровотока в СМА в условиях функциональных тестов с гипер- и гипокапнией, то есть представляют непосредственную опасность развития ишемического инсульта.
В контрольной группе в условиях нагрузочных тестов были получены положительные реакции, что свидетельствует о нормальной активности ауторегуляторных механизмов [1, 7]. Оказалось, что для практических целей у наших пациентов проба с гипероксией – гипокапнией (гипервентиляционная) не дает информации о взаимоотношениях реактивности сосудистого русла мозга и структуры атеросклеротической каротидной бляшки. Напротив, при использовании гиперкапнической пробы с задержкой дыхания (методически наиболее легко применимой у всех групп больных) такая связь выявляется. При этом патологические реакции мозгового кровотока у пациентов с бляшками с выраженным липидным ядром выявляются в 44% случаев. А при развитии внутрибляшеч-ных геморрагий, но без нарушений эндотелиальной целостности бляшки – ни в одном из наших случаев бляшка не сопровождалась разрывом интимы и тромбозом – такие нарушения цереброваскулярной реактивности в условиях гиперкапнической нагрузки отмечались у всех пациентов. Наличие внутрибляшечных геморрагий с повреждениями интимы уже однозначно расценивается как показание к хирургическому вмешательству [2, 8]. Нарушение цереброваскулярного сосудистого резерва, определяемое при функциональной пробе с гиперкапнией, представляет собой доказательство гемодинамической значимости бляшки и вследствие этого, вероятно, также необходимости проведения КЭЭ [3, 8]. Ранее было также показано, что интенсивно контрастируемые парамагнетиком каротидные бляшки ассоциированы с высоким риском развития ишемических цереброваскулярных нарушений [7]. Полученные нами данные показывают, что при атеросклеротическом стенозе ВСА внутрибляшечные геморрагии даже и без повреждения эндотелия сосуда сопровождаются критическим нарушением цереброваскулярной реактивности, оцениваемой по кровотоку в СМА. Следовательно, обоснованно считать визуально определяемые при МРТ внутрибляшечные геморрагии критическим фактором риска, требующим удаления такой бляшки открытой КЭЭ или интервенционным методом (внутрисосудистым баллонированием и стентированием). Практически крайне важно, что выявление таких осложненных бляшек возможно в ходе обычного МРТ-исследования головного мозга с охватом в поле зрения области каротидной бифуркации, с получением МР-то-мосрезов этой области в Т1- и Т2-взвешенных спин-эхо режимах тонкими срезами по 1–2,5 мм, что доступно сегодня абсолютно на всех современных рутинных МР-то-мографах.
Таким образом, проведение МРТ-исследования области общей и ВСА может быть рекомендовано в качестве скринингового у всех пациентов, входящих в группу риска по данной патологии. Однако для выявления реальной значимости такого скринингового применения представленных здесь методик оценки характера атеросклеротической бляшки будет необходимо статистически более обширное, вероятно, меж- или многоцентровое исследование.
Выводы
-
1. Гемодинамически значимые атеросклеротические бляшки с микрогеморрагиями и без нарушения поверхности эндотелия вызывают патологические изменения реактивности артерий головного мозга, которые наблюдаются у 100% таких пациентов. При наличии бляшек с преобладанием липидного ядра патологические варианты реактивности кровотока СМА отмечаются лишь в 44% случаев.
-
2. Функциональная проба с гиперкапнией наиболее информативна для выявления функциональных нарушений кровотока головного мозга при атеросклеротических поражениях сонных артерий.
Список литературы Структура атеросклеротической бляшки как определяющий фактор цереброваскулярной реактивности при стенозирующем атеросклерозе сонных артерий
- Никитин Ю.П., Николаев К.Ю., Рагино Ю.И. и др. Эндотелиальная дисфункция, гипертония, атеросклероз. -Новосибирск: Изд-во СО РАН, 2014. -132 с.
- Parmar J.P., Rogers W.J, Mugler J.P. et al. Magnetic resonance imaging of carotid atherosclerotic plaque in clinically suspected acute transient ischemic attack and acute ischemic stroke//Circulation. -2010. -Vol. 122(20). -P. 2031-2038.
- Грацианов Д.А. Влияние тренировки к холестерину на развитие экспериментального атеросклероза. -Томск: Изд-во ТГУ, 1982. -97 с.
- Carlier S., Kakadiaris I., Dib N. et al. Vasa vasorum imaging: A new window to the clinical detection of vulnerable atherosclerotic plaques//Curr. Atheroscler. Rep. -2005. -Vol. 7(2). -P. 164-169.
- Рагино Ю.И. Факторы и механизмы коронарного Атеросклероза и его осложнений//Атеросклероз. -2012. -Т. 8, № 1. -С. 61-64.
- Абрамова Н.Н. Магнитно-резонансная томография и магнитно-резонансная ангиография в визуализации сосудистых структур//Вестн. рентгенол. и радиол. -1997. -№ 2. -C. 50-54.
- Бобрикова Е.Э., Щербань Н.В., Ханеев В.Б. и др. Оценка состояния атеросклеротических бляшек брахиоцефальных артерий средствами высокоразрешающей контрастированной МРТ: взаимосвязь с ишемическим повреждением головного мозга//Мед. визуал. -2013. -№ 1. -С. 26-31.
- Национальные рекомендации по ведению пациентов с заболеваниями брахиоцефальных артерий. Российский согласительный документ. -М., 2013. -72 с.
- Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. -М.: Реальное время, 2003. -324 с.
- Cai J.M., Ferguson M.S., Polissar N. et al. Classification of human carotid atherosclerotic lesion using in Vivo multi-contrast MR imaging//Circulation. -2002. -Vol. 106. -P. 1368-1373.
- Страздень Е.Ю., Шария М.А., Тарарак Э.М. и др. Применение магнитно-резонансной томографии в определении стабильности атеросклеротической бляшки//Рос. электрон. журн. лучевой диагностики. -2013. -Т. 3, № 1(9). -С. 57-62.


