Структура и функции протеасомы
Автор: Дутченко А.П., Шатобалов Я.И.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 8 (84), 2023 года.
Бесплатный доступ
В данной статье описана структура и функции протеасом. Эукариотическая 26S протеасома представляет собой комплекс, состоящий из одной 20S-основной протеасомы и двух 19S-регуляторных колпачков. 20S-ядерная протеасома содержит семь различных α-субъединицы и семь различных β-субъединиц в его двойном симметричном α7β7β7α7 сложенном комплексе. Основными функциями протеасомы являются переваривание белков, намеченных для разрушения благодаря связыванию с убиквитином и процессинг белков.
Протеасома, убиквинтин, процессинг
Короткий адрес: https://sciup.org/140301435
IDR: 140301435 | УДК: 636.082.12
Текст научной статьи Структура и функции протеасомы
STRUCTURE AND FUNCTIONS OF THE PROTEASOME.
Протеосомы представляют собой комплексы, состоящие из большого числа протеаз, которые переваривают белки, намеченные для разрушения благодаря связыванию с убиквитином. Разрушение белков очень важно для устранения избытка ферментов и других белковых молекул, которые становятся ненужными клетке после того, как они выполнят свои нормальные функции, а также для удаления неправильно свернутых белков. Работа протеасомного комлекса связана с патогенезом многих заболеваний, поэтому знания в этой области могут помочь в понимании причины болезни и механизма ее течения [1].
Эукариотическая 26S протеасома представляет собой большой комплекс размером 2,4 МДа, состоящий из одной 20S-основной протеасомы и двух 19S-регуляторных колпачков (рис. 1).
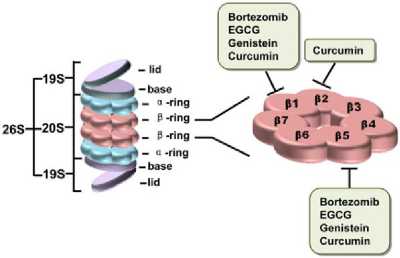
Рис. (1). Схема протеасомы 26S и ее каталитических субъединиц [4] 208-ядерная протеасома содержит семь различных а-субъединицы и семь различных 0-субъединиц в его двойном симметричном а7в7в7а7 сложенном комплексе, среди которых в основном три набора в -субъединиц, в1 (каспазоподобные, или пептидил-глутамил -пептид-гидролизующие, PGPH-подобные), 02 (трипсиноподобные) и 05 (химотрипсин-подобные) являются протеолитически активными. Регуляторные колпачки 19S состоят из крышки, которая отвечает за распознавание и стыковку полиубиквитинилированных белков с протеасомой ядра 20S, и основания, которое содержит АТФазы. Они требуется для разворачивания крупных белков. В отличие от обычных протеолитических ферментов, которые содержат каталитическую триаду, каталитические субъединицы протеасомы, а именно β1, β2 и β5, принадлежат к особой группе, называемой N-концевыми нуклеофильными гидролазами, которая использует боковую цепь N-концевого остатка в качестве каталитического нуклеофила [2-3]. Различные наблюдения указывают на то, что все три каталитические в-субъединицы действительно реагируют с пептидными связями субстратов, а также с электрофильными функциональными группами ингибиторов через их -ОН-группу N-концевого треонина [4-5].
Активность протеасом может быть либо повышена, либо понижена в условиях in vivo. Во многих случаях рака активность протеасом повышается с помощью клеточных онкогенных факторов. Повышенная активность протеасом, в свою очередь, способствует деградации белков-супрессоров опухоли, что приводит к выживанию и пролиферации раковых клеток, а также развитию лекарственной устойчивости [6-8].
С другой стороны, активность протеасом может быть подавлена ингибиторами, включая некоторые синтетические соединения, такие как бортезомиб (первый терапевтический ингибитор протеасом, выпущенный в 2003 году) и многие натуральные продукты, такие как растительные полифенолы [8].
Чай является вторым по популярности напитком в мире после воды. Зеленый чай и, в меньшей степени, черный чай богаты полифенолами. Основными катехинами в зеленом чае являются (-)- эпигаллокатехин-3-галлат [(-)-EGCG], (-)-эпигаллокатехин [(-)- EGC], (-)-эпикатехин-З-галлат [(-)-ЭКГ] и (-)-эпикатехин [(-)-ЕС] . Среди них EGCG является наиболее распространенным и активным, и он был тщательно изучен на предмет его биологической активности и клеточных мишеней. Одной потенциально важной клеточной мишенью EGCG является протеасома. Оба встречаются в природе (-)-EGCG и его синтетический энантиомер (+)-EGCG способны мощно, специфически и необратимо ингибировать химотрипсиноподобную активность в5-субъединицы протеасомы in vitro (IC50 = 86-194 нМ) и in vivo (1-10 мкм). Следует отметить, что EGCG способен взаимодействовать не только с субъединицей β5 в конститутивной протеасоме, но и с субъединицей β5i в иммунопротеасоме, индуцируемой интерфероном -у (называемой активностью BrAAP) с еще более высоким сродством [4].
Дубильная кислота (ТА) относится к гидролизуемым дубильным веществам, состоящим либо из галлотаннинов, либо из эллагитаннинов. Поскольку полифенолы чая, содержащие эфирные связи, являются мощными ингибиторами протеасом, способность ТА ингибировать активность протеасом была протестирована и подтверждена на очищенной 20S протеасоме и клеточной 26S протеасоме в различных типах клеток, а также на моделях мышей, несущих опухоль. Ингибирование функции протеасомы TA к нарушению прогрессирования клеточного цикла [4].
Таким образом, эукариотическая 26S протеасома имеет сложную структуру, состоящую из одной 20S-основной протеасомы и двух 19S-регуляторных колпачков. В свою очередь, 20S-ядерная протеасома содержит семь различных α-субъединицы и семь различных β-субъединиц в его двойном симметричном α7β7β7α7 сложенном комплексе. Основными функциями протеасомы являются переваривание и процессинг белков.
Список литературы Структура и функции протеасомы
- Gomes A. Genetics of Proteasome Diseases / A. Gomes // Scientifica. - 2013. -P. 1-30.
- Kisselev A. Why does threonine, and not serine, function as the active site nucleophile in proteasomes? / 3. A. Kisselev, Z. Songyang, A. Goldberg // Journal of Biological Chemistry. - 2000. - № 275. -P. 14831-14837.
- Moore B. Advances in and applications of proteasome inhibitors / B. S. Moore, A. S. Eustaquio, R. P. McGlinchey / Curr Opin Chem Biol. - 2008. -P. 434-440.
- Shen M. Targeting Tumor Ubiquitin-Proteasome Pathway with Polyphenols for Chemosensitization / M. Shen, C. Hang, Q. Ping Dou // Anti-Cancer Agents in Medicinal Chemistry. - 2012. - № 8. -P. 891-901.
- Rechsteiner M. Proteasomes, Overview / M. Rechsteiner // Encyclopedia of Biological Chemistry. - 2013. -P. 590-594.
- Adams J. The proteasome: a suitable antineoplastic target /j. Adams // Nat. Rev. Cancer. - 2004. -P. 349-360.
- Jesenberger V. Deadly encounter: ubiquitin meets apoptosis / V. Jesenberger, S. Jentsch // Nat. Rev. Mol. Cell Biol. - 2002. -P. 112-121.
- Voorhees P. The proteasome and proteasome inhibitors in cancer therapy / P. Voorhees, R. Orlowski // Annu. Rev. Pharmacol. Toxicol. - 2006. - № 46. -P. 189-213. EDN: MKRJFB


