Структура интракраниальных вен и упруго-вязкостные свойства мембран эритроцитов подростков с соединительнотканной дисплазией
Автор: Прошин А.Н., Машин В.В., Белова Л.А., Белов Д.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2021 года.
Бесплатный доступ
Цель. Исследовать при помощи магнитно-резонансной ангиографии особенности интракраниальных вен и методом атомно-силовой микроскопии - упруго-вязкостные свойства мембран эритроцитов подростков с соединительнотканной дисплазией. Материалы и методы. Обследовано 156 подростков. Основную группу (ОГ) составили 82 подростка с признаками дисплазии соединительной ткани (ДСТ), группу сравнения (ГС) - 74 подростка без проявлений ДСТ. ДСТ оценивали по шкале Л.Н. Абакумовой (2006). Магнитно-резонансная ангиография проводилась на аппарате Siemens Magnetom Symphony, оснащенном сверхпроводящей магнитной системой с силой поля 1,5 Тесла. С целью изучения состояния цитоплазматической мембраны эритроцитов были изготовлены сухие препараты эритроцитов. Препарат подвергался сканированию, которое проводилось с помощью атомно-силового микроскопа SOLVER P47-Pro. Результаты. У большинства подростков ОГ выявлены анатомические варианты строения синусов твердой мозговой оболочки. При этом гипоплазия синусов у пациентов ОГ диагностировалась чаще, чем асимметрия данных структур. В ГС количество анатомических вариантов строения синусов твердой мозговой оболочки также превалировало над симметричным строением, но чаще диагностировалась асимметрия синусов. Сравнительный анализ значений модуля Юнга в двух группах пациентов показал статистически значимое превосходство данного показателя в ОГ. Корреляционный анализ степени выраженности ДСТ и значений модуля Юнга выявил умеренную прямую корреляцию. Выводы. Можно предположить, что имеющиеся при ДСТ особенности структуры церебральных сосудов и эластических свойств мембран эритроцитов, заложенные в процессе эмбриогенеза, ухудшают функциональные и адаптационные возможности интракраниальных сосудов, что способствует возникновению и прогрессированию церебральных венозных расстройств и их последующей клинической манифестации.
Интракраниальные вены, модуль юнга, дисплазия соединительной ткани
Короткий адрес: https://sciup.org/14122865
IDR: 14122865 | УДК: 616.8-005 | DOI: 10.34014/2227-1848-2021-3-47-60
Текст научной статьи Структура интракраниальных вен и упруго-вязкостные свойства мембран эритроцитов подростков с соединительнотканной дисплазией
Введение. Проблема дисплазии соединительной ткани (ДСТ) приобретает все большую актуальность для врачей различных специальностей, поскольку данное состояние является фоном для формирования разнообразной полиорганной и полисистемной патологии. Полиморфизм клинических проявлений соединительнотканных нарушений нередко приводит к проблеме постановки точного диагноза, так как не всегда удается за множеством отдельных симптомов увидеть единую системную патологию [1–7].
В то же время известно, что наличие сосудистых аномалий, которые нередко выявляются у пациентов с ДСТ, ассоциируется с риском возникновения острой сосудистой патологии в более молодом возрасте по сравнению с общей популяцией [8–10]. Поскольку в структуре сосудистой системы головного мозга количество вен превосходит количество артериальных сосудов, нарушение их формирования сопровождается значимыми клиническими проявлениями. Также доказано, что одним из факторов, влияющих на развитие цереброваскулярных заболеваний, является конституциональная венозная недостаточность [11]. Рядом авторов описана роль исходного тонуса вен, обусловленного конституциональными и наследственными факторами, в патогенезе венозной дисциркуляции головного мозга и формировании церебральных венозных тромбозов [12, 13]. Следует отметить, что Р. Вирхов, описывая патогенез тромбозов, дает характеристику красным коагуляционным тромбам, формирование которых связано со стазом и свертыванием крови, подчеркивая, что они образуются в основном в венозных сосудах [14] и макроскопически представляют собой сеть фибрина, между волокон которой располагается множество эритроцитов.
Говоря о формировании венозных тромбозов, необходимо обратить внимание на физиологические свойства эритроцитов, принимающих непосредственное участие в данном патологическом процессе. Согласно литературным данным нарушение эритропоэза является неотъемлемой частью патогенеза ДСТ. Так, при ДСТ наблюдаются патологические изменения структурно-функционального состояния мембран эритроцитов, которые проявляются сниженным процентом содержания сфингомиелина и холестерина в структуре мембраны, снижением активности фермента Ка+/К+-АТФ-азы, приводящим к нарушению ионного гомеостаза внутри клетки [15]. Кроме того, показано, что при ДСТ нарушается поверхностный микрорельеф мембран эритроцитов периферической крови, что приводит к укорочению жизненного цикла клетки [16]. В то же время на сегодняшний день остаются неизученными упруго-вязкостные характеристики мембран эритроцитов при ДСТ, отражающие особенности реологических свойств крови, которые играют важную роль в патогенезе нарушений мозгового кровообращения.
Сосудистые заболевания головного мозга у детей являются одной из наиболее значимых медико-социальных проблем современной детской неврологии. Дети с цереброваскулярной патологией, вынужденные развиваться на фоне сформировавшихся неврологических осложнений, требуют значительных моральных и материальных затрат на обеспечение их медицинских потребностей и образования, что подчеркивает актуальность изучения данной проблемы [10, 17].
Таким образом, изучение анатомо-физиологических особенностей организма подростков с расстройством вегетативной нервной системы, развивающимся на фоне ДСТ, остается одной из актуальных проблем неврологии и педиатрии, поскольку данные изменения являются факторами, способствующими формированию цереброваскулярной патологии в молодом возрасте.
Цель исследования. Исследовать при помощи магнитно-резонансной ангиографии особенности интракраниальных вен и методом атомно-силовой микроскопии - упруго-вязкостные свойства мембран эритроцитов подростков с соединительнотканной дисплазией.
Материалы и методы. Обследовано 156 подростков в возрасте от 12 до 17 лет, проходящих лечение в психоневрологическом отделении № 2 ГУЗ «Детская городская клиническая больница г. Ульяновска» с диагнозом «расстройство вегетативной нервной системы G90.8». В числе обследованных было 72 мальчика (средний возраст 14,26±1,52 года) и 84 девочки (средний возраст 14,79±1,69 года). Основную группу (ОГ) составили 82 подростка с проявлениями расстройства вегетативной нервной системы и признаками ДСТ (средний возраст 14,68±1,53 года).
Критерии включения: признаки соединительнотканной дисплазии по критериям Л.Н. Абакумовой (2006).
Критерии исключения: наследственные нарушения соединительной ткани (синдромы Марфана, Элерса - Данлоса и др.); приобретенные деформации опорно-двигательного аппарата; травмы органов опоры и движения в течение последних 2 лет, сопровождающиеся нарушением целостности костной ткани; острые и хронические заболевания внутренних органов; онкологические заболевания; психические заболевания.
Группу сравнения (ГС) составили 74 подростка с проявлениями расстройства вегетативной нервной системы без признаков ДСТ (средний возраст 14,58±1,54 года).
В группу контроля (ГК) вошли 30 практически здоровых подростка в возрасте от 12 до 17 лет (средний возраст 14,26±1,5 года).
В соответствии с принципами Хельсинкской декларации у всех пациентов либо их законных представителей было получено информированное письменное согласие на участие в исследовании.
Подростки были комплексно обследованы с целью выявления внешних (костноскелетных, суставных, кожно-мышечных, малых аномалий развития) маркеров дисплазии соединительной ткани. Наличие дисплазии соединительной ткани оценивали на основании шкалы Л.Н. Абакумовой [18].
Для оценки состояния интракраниальных вен применялась магнитно-резонансная венография (МРВ), которая проводилась на аппарате Siemens Magnetom Symphony, оснащенном сверхпроводящей магнитной системой с силой поля 1,5 Тесла. Исследование параметров церебрального венозного оттока осуществлялось с использованием времяпролетной магнитно-резонансной флебографии – Time of flight (TOF) в режиме двумерного (2D) изображения. Для обработки данных МРВ использовался алгоритм выбора проекции по максимальной интенсивности сигнала (MIP), при котором соответствующие яркие пиксели на всех параллельных 2D-срезах образуют в результате проекционную флебограмму. Оценивались прямой, верхний сагиттальный, поперечные, сигмовидные венозные синусы. Гипоплазия поперечного или сигмовидного синуса диагностировалась в том случае, если поперечный размер данного синуса составлял не более 1/3 поперечного размера одноименного противоположного синуса [19].
Для изучения томограмм использовались данные в формате DICOM 3.0. Измерение прямолинейных дистанций проводилось при помощи программных средств графической станции eFilm Workstation 3.4.
С целью исследования состояния цитоплазматической мембраны эритроцитов подростков с ДСТ проводилась атомно-силовая микроскопия сухих препаратов нативных эритроцитов. Преимущество данной методики заключается в том, что свойства нативных эритроцитов in vitro практически не отличаются от свойств клеток в естественных условиях.
В начале исследования на предметное стекло со шлифованными краями толщиной 1 мм наносилась капля цельной венозной крови, которая затем равномерно распределялась шпателем с целью создания монослоя эритроцитов. Далее препарат подвергался высушиванию на воздухе при комнатной температуре в течение 20 мин. Потом проводилось сканирование полученного препарата атомно-силовым микроскопом (АСМ) SOLVER P47-Pro (NT-MDT, Россия), оснащенным неконтактным кремниевым зондом серии NSG10 (NT-MDT) жесткостью 3,08–37,6 Н/м, резонансной частотой около 140–390 кГц, высотой зонда 14–26 мкм и радиусом закругления кантилевера 10 нм. В данном исследовании применялся колебательный (резонансный) режим сканирования образца с генерируемой частотой 300 kHz. В колебательном режиме сканирования кантилевер приводится в резонансные колебания и взаимодействие с поверхностью исследуемого образца вызывает изменение амплитуды, частоты или фазы резонансных колебаний. Для измерения силового взаимодействия зонда и образца в системе прерывистого контакта (tapping mode) используется резонансная схема.
Сканируемая площадь препарата составляла 90 нм2. На каждом образце выбирались 20–30 эритроцитов, далее исследовалась упругость мембраны каждого из них в 9 точках, расположенных в периферической части клетки и в области центрального углубления, с последующим вычислением среднего значения модуля Юнга для каждой из 9 точек и для клетки в целом.
Обработка полученных данных и необходимые расчеты проводились с помощью специализированного программного обеспечения для АСМ – Nova V1.1.0.1847. Для расчета значения модуля Юнга по графикам силовых кривых использовалась модель Герца [20]. Таким образом, сила воздействия зонда в зависимости от глубины его проникновения в поверхность исследуемого образца определяется выражением
F = — E x Ah1'5, где F – сила, действующая на поверхность субстрата; R – радиус закругления зонда; Δh – глубина проникновения зонда в поверхность образца; E – модуль Юнга.
Ниже приведена формула расчета модуля Юнга, учитывающая радиус закругления кантилеверов, примененных в данном исследовании:
£ = 7'5х1о3х^'
где F – Δ y силового графика; Δ h – Δ x силового графика.
Для Δ x и Δ y на силовом графике программы Nova выбиралась область линейного изменения значений силовой кривой нажатия кантилевера на поверхность мембраны эритроцита.
Полученные результаты подвергались статистическому анализу с использованием Statis-tica 8.0 (StatSoft, США) и Microsoft Excel 2010. Точный критерий Фишера, непараметрический U-критерий Манна – Уитни использовались для проверки гипотезы о различии выборок групп пациентов. В качестве индикатора наличия связи между количественными показателями применялся коэффициент ранговой корреляции Спирмена. Для выявления параметров, по которым группа подростков с ДСТ отличается от других исследуемых групп, и определения степени данного отличия использовался пошаговый дискриминантный анализ с включением. Результаты представлены в виде n (%) и Мe [25 %; 75 %]. Для всех видов анализа различия между группами принимались за статистически значимые при р<0,05.
Результаты и обсуждение. Проведена МРВ с целью визуализации интракраниальной венозной системы и поиска ее анатомических особенностей, которые могли бы являться вероятной причиной или фактором, способствующим развитию симптомов церебральной венозной недостаточности.
9; 11%
26; 32%
73; 89%
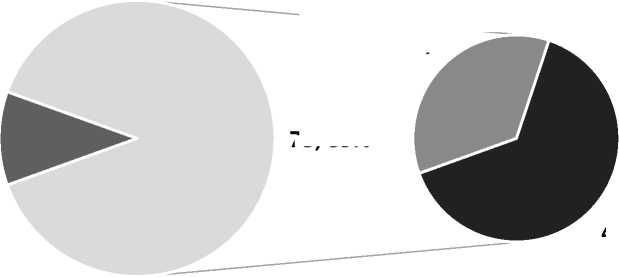
47; 57%
-
■ Симметричное строение Symmetrical structure
-
■ Варианты строения Structure options
-
■ Асимметрия Asymmetry
-
■ Гипоплазия Hypoplasia
Рис. 1. Анатомическое строение поперечных и сигмовидных синусов твердой мозговой оболочки у пациентов с ДСТ
Fig. 1. Anatomical structure of transverse and sigmoid sinuses of the dura mater in patients with connective tissue dysplasia
У подавляющего большинства подростков с ДСТ визуализировались анатомические варианты строения поперечных и сигмовидных синусов твердой мозговой оболочки (р<0,05). При этом гипоплазия венозных синусов твердой мозговой оболочки у пациентов ОГ диагностировалась статистически значимо чаще, чем их асимметрия (р<0,05) (рис. 1).
У пациентов ГС количество анатомических вариантов строения поперечных и сигмовидных синусов твердой мозговой оболочки также превалировало над симметричным строением (р<0,05), но в данной группе статистически значимо чаще диагностировалась асимметрия, чем гипоплазия синусов (р<0,05) (рис. 2).
26; 35%
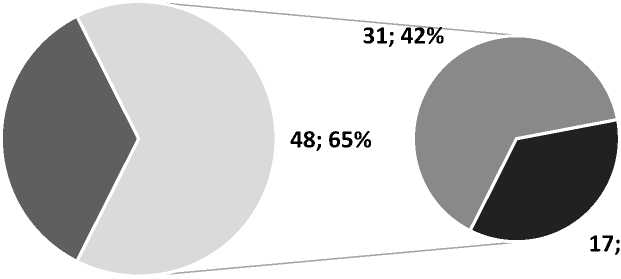
23%
-
■ Симметричное строение Symmetrical structure
-
■ Варианты строения S tructure options
-
■ Асимметрия Asymme try
-
■ Гипоплазия Hypoplas ia
Рис. 2. Анатомическое строение поперечных и сигмовидных синусов твердой мозговой оболочки у пациентов без ДСТ
Fig. 2. Anatomical structure of transverse and sigmoid sinuses of the dura mater in patients without connective tissue dysplasia
Таблица 1
Table 1
Структура поперечных и сигмовидных синусов твердой мозговой оболочки у подростков с расстройством вегетативной нервной системы на фоне ДСТ, n (%)
Structure of transverse and sigmoid sinuses of the dura mater in adolescents with autonomic disturbances and connective tissue dysplasia, n (%)
|
Показатели МРТ MRI parameters |
Основная группа Main group (n=82) |
Группа сравнения Comparison group (n=74) |
Группа контроля Control group (n=30) |
|
|
Симметричное строение Symmetrical structure |
9 (10,9)*# |
26 (35,1) |
12 (40,0) |
|
|
Анатомические варианты строения Anatomical structure options |
73 (89,1)*# |
48 (64,9) |
18 (60,0) |
|
|
Асимметрия Asymmetry |
Всего Total |
26 (31,7)*# |
31 (41,9) |
13 (43,3) |
|
Dex>Sin |
16 (19,5) |
17 (23,0) |
8 (26,6) |
|
|
Sin>Dex |
10 (12,2) |
14 (18,9) |
5 (16,7) |
|
|
Гипоплазия Hypoplasia |
Всего Total |
47 (57,4)*# |
17 (23,0) |
5 (16,7) |
|
Правые синусы Right sinuses |
19 (23,2) |
7 (9,5) |
2 (6,7) |
|
|
Левые синусы Left sinuses |
28 (34,2) ″ |
10 (13,5) |
3 (10,0) |
|
Примечание: * – статистически значимые различия с группой сравнения (p<0,05); # – статистически значимые различия с группой контроля (p<0,05); ″ – статистически значимые различия внутри группы (p<0,05).
Note. * – the differences are significant compared with the comparison group (p<0.05); # – the differences are significant compared with the control group (p<0.05); ″ – the differences are significant within the group (p<0.05).
При сравнении показателей МРВ трех групп пациентов получены данные о том, что анатомические варианты строения венозных синусов твердой мозговой оболочки, такие как асимметрия и гипоплазия, статистически значимо чаще визуализировались в группе пациентов с ДСТ, чем в ГС и ГК (р<0,05) (табл. 1).
Гипоплазия поперечных и сигмовидных синусов твердой мозговой оболочки во всех группах чаще встречалась слева, но статистическая значимость данного наблюдения была подтверждена только в группе подростков с ДСТ (р<0,05) (табл. 1).
ГС и ГК были сопоставимы по процентному соотношению симметричного строения и различных вариантов строения сигмовидных и поперечных венозных синусов (р>0,05) (табл. 1).
В результате сканирования образцов получены изображения топографии поверхности мембран нормальных эритроцитов, пред- ставляющих собой гладкие двояковогнутые диски. Эритроциты пациентов с ДСТ не имели визуальных отличий от эритроцитов пациентов без признаков ДСТ.
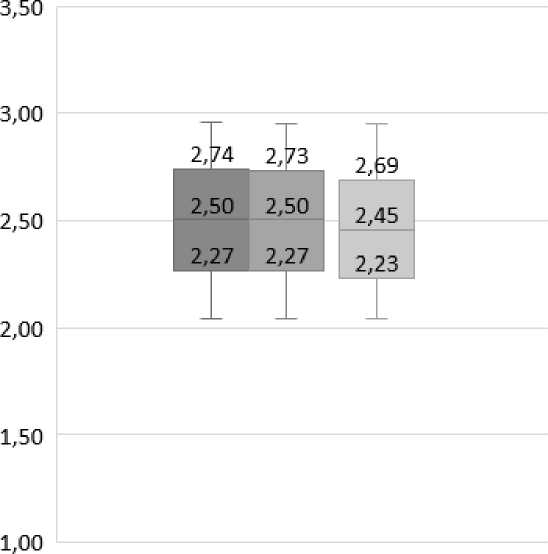
Эритроциты пациентов трех групп были сопоставимы по диаметру. Статистически значимых отличий получено не было (p>0,05) (рис. 3).
Таким образом, морфометрические показатели эритроцитов не зависели от наличия или отсутствия ДСТ и были сопоставимы во всех трех группах пациентов.
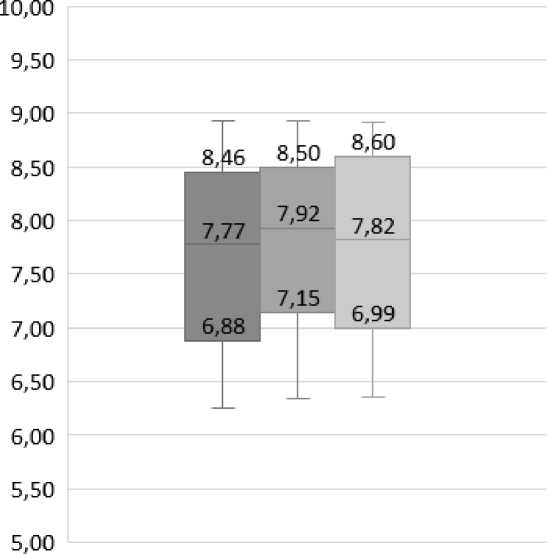
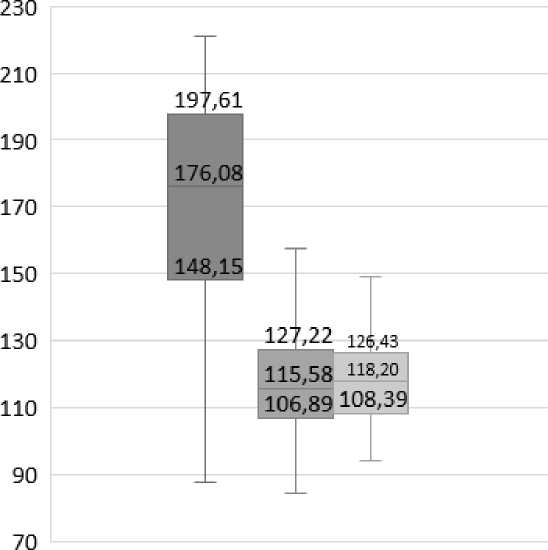
Сравнительный анализ значений модуля Юнга поверхности эритроцитов в трех группах пациентов показал статистически значимое превосходство данного показателя в группе подростков с ДСТ по сравнению с двумя другими (р<0,05) (рис. 5).
Проведено исследование модуля Юнга периферической части и в области центрального углубления эритроцитов трех групп пациентов (табл. 2).
Основная группа Main group
Группа сравнения Comparison group
Группа контроля Control group
Рис. 3. Диаметр эритроцитов, Мe [25 %; 75 %], мкм
Fig. 3. Diameter of red blood cells, Мe [25 %; 75 %], µm
Основная группа Main group
Группа сравнения Comparison group
Группа контроля Control group
Рис. 4. Высота эритроцитов, Мe [25 %; 75 %], мкм
Fig. 4. Height of red blood cells, Мe [25%; 75 %], µm
Основная группа Main group
Группа сравнения Comparison group
Группа контроля Control group
Рис. 5. Значения модуля Юнга (Е), Мe [25 %; 75 %], MPa
Fig. 5. Young's modulus (E) characterizing the elastic-viscous properties of red blood cell membranes, Мe [25 %; 75 %], MPa
Таблица 2
Table 2
Значения модуля Юнга (E), характеризующего упруго-вязкостные свойства мембран эритроцитов, Мe [25 %; 75 %], MPa
Young's modulus (E) characterizing the elastic-viscous properties of red blood cell membranes, Мe [25 %; 75 %], MPa
|
Основная группа Main group (n=82) |
Группа сравнения Comparison group (n=74) |
Группа контроля Control group (n=30) |
|
|
Поверхность эритроцита Red blood cell surface |
176,08 [148,15; 197,61]*# |
115,58 [106,89; 127,22] |
118,20 [108,39; 126,43] |
|
Периферическая часть поверхности эритроцита Peripheral part of the red blood cell surface |
185,01 [149,66; 197,71]*# ″ |
118,55 [106,14; 134,23] ″ |
123,07 [114,68; 129,36] ″ |
|
Центральное углубление поверхности эритроцита Central depression of the red blood cell surface |
173,02 [145,37; 196,07]*# |
113,23 [107,46; 121,33] |
114,14 [108,07; 119,93] |
Примечание: * – статистически значимые различия с группой сравнения (p<0,05); # – статистически значимые различия с группой контроля (p<0,05); ″ – статистически значимые различия с центральным углублением поверхности эритроцита (p<0,05).
Note. * – the differences are significant compared with the comparison group (p<0.05); # – the differences are significant compared with the control group (p<0.05); ″ – the differences are significant compared with the flattish, indented center of the red blood cell (p<0.05).
Во всех трех исследуемых группах значения модуля изометрического сжатия периферической части поверхности эритроцита были статистически значимо выше, чем в области центрального углубления (р<0,05).
Значения модуля Юнга периферической части поверхности эритроцитов подростков с ДСТ статистически значимо выше, чем в двух других группах (р<0,05). В области центрального углубления поверхности эритроцита значения модуля Юнга также статистически значимо выше в ОГ пациентов (р<0,05).
У пациентов ГС и ГК статистически значимых отличий значений модуля Юнга получено не было (p>0,05) (рис. 5).
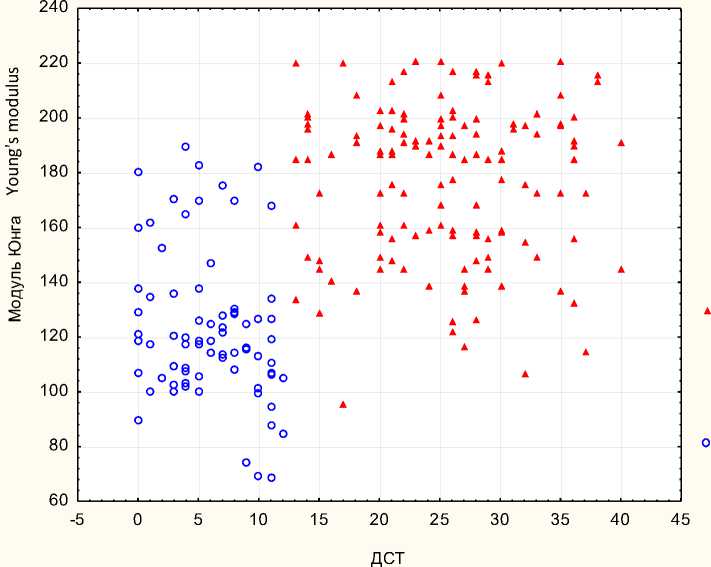
Категоризованная диаграмма рассеяния отражает смещение облака точек группы пациентов с ДСТ вверх по оси Y, что также сви- детельствует о более высоком значении модуля изометрического сжатия мембраны эритроцитов крови у данной категории пациентов (рис. 6).
С помощью корреляционного анализа степени выраженности ДСТ и значений модуля Юнга обнаружена умеренная прямая статистически значимая корреляция между данными показателями (r=0,56375; р<0,05) (рис. 7).
Таким образом, проведенные исследования указывают на прямую статистически значимую связь между ДСТ и реологическими свойствами крови, что проявляется в снижении эластичности и вязкости мембраны эритроцитов у подростков с ДСТ и, следовательно, в меньшей способности эритроцитов упруго деформироваться при прохождении через микроциркуляторное русло.
дет ve tissue dysplasia
ГС on group
Рис. 6. Диаграмма рассеяния данных шкалы ДСТ и значений модуля Юнга
Fig. 6.
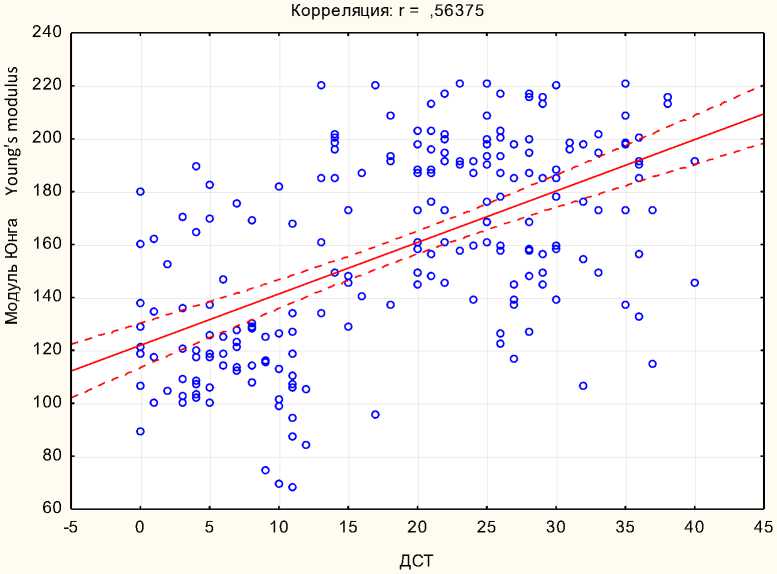
Рис. 7. График корреляции между ДСТ и модулем Юнга
Fig. 7. Correlation graph between connective tissue dysplasia and Young's modulus
* ДСТ tive tissue sia о ГС rison gp
По данным нашего исследования, у подростков с ДСТ чаще, чем у пациентов без данной патологии, встречаются анатомические варианты строения синусов твердой мозговой оболочки, такие как асимметрия и гипоплазия, а также особенности структурно-функционального состояния эритроцитов, что негативно отражается на церебральной гемодинамике, в т.ч. на уровне микроциркуляторного русла. Нарушения гемодинамики в свою очередь могут усугубить дисфункцию лимбиче-ско-ретикулярного комплекса, что способствует формированию и прогрессированию синдрома вегетативной дисфункции, который, как сообщается, является одной из наиболее важных причин развития первичных форм церебральной венозной дисциркуляции [21].
Вследствие вышесказанного можно предположить, что имеющиеся при ДСТ особенности строения церебральных сосудов и микроциркуляции, сформированные в процессе эмбриогенеза, т.е. носящие врожденный, конституциональный характер, являются факторами, способствующими формированию церебральной венозной недостаточности и, кроме того, участвуют в формировании и прогрессировании синдрома вегетативной дисфункции в процессе роста и развития организма, что в свою очередь ухудшает функциональные и адаптационные возможности интракраниальных сосудов. Данные особенности пациентов с ДСТ способствуют раннему возникновению и последующему углублению церебральных венозных расстройств и их последующей клинической манифестации в молодом возрасте.
Таким образом, можно ожидать нарастания венозных расстройств у пациентов с ДСТ с возрастом, что свидетельствует о необходимости как можно более раннего выявления нарушений венозной гемодинамики у подростков с признаками ДСТ, последующего наблюдения в динамике и проведения профилактических мероприятий с целью предупреждения раннего дебюта цереброваскулярной патологии.
Выводы:
Список литературы Структура интракраниальных вен и упруго-вязкостные свойства мембран эритроцитов подростков с соединительнотканной дисплазией
- ЯковлевВ.М., ГлотовА.В., ЯгодаА.В. Иммунопатологические синдромы при наследственной дисплазии соединительной ткани. Ставрополь: Типография БЛАНКОМ; 2007. 234.
- Кадурина Т.И., Гнусаев С.Ф., Арсентьев В.Г. Полиорганные нарушения при дисплазиях соединительной ткани. Алгоритмы диагностики. Тактика ведения. Медицинский вестник Северного Кавказа. 2016; 11 (2): 239-263.
- Костик И.А. Неврологические проявления дисплазии соединительной ткани у детей: автореф. дис. ... канд. мед. наук. СПб.; 2009. 22.
- Пузырев В.П., Фрейдин М.Б. Генетический взгляд на феномен сочетанных заболеваний человека. Acta naturae. 2009; 3: 57-63.
- Арсентьев В.Г. Дисплазия соединительной ткани как конституциональная основа полиорганных нарушений у детей: автореф. дис. ... д-ра мед. наук. СПб.; 2012. 44.
- Кесова М.А. Беременность и недифференцированная дисплазия соединительной ткани: патогенез, клиника, диагностика: автореф. дис. ... д-ра мед. наук. М.; 2012. 43.
- Сичинава И.В., Шишов А.Я., Белоусова Н.А. Особенности проявлений гастродуоденальной патологии у детей с дисплазией соединительной ткани. Педиатрия. 20i2; 9i (4): 6-i0.
- Robertson W.C., Given C.A. Spontaneous intracranial arterial dissection in the young: diagnosis by CT angiography. BMC Neurol. 2006; 6 (i6): i-5.
- Шилова М.А. Патология аорты у лиц с дисплазией соединительной ткани в аспекте внезапной смерти. Кубанский научный медицинский вестник. 2009; 6 (iii): 79-S2.
- Петрухин А.С., БобыловаМ.Ю., Михайлова С.В. Этиология инсульта у детей. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2015; 115 (3): 64-74.
- Никитин Ю.М., Белова Л.А., Машин В.В., Белов В.Г., Ниязова Р.М., Винокуров Л.Н., Бердичевский М.Я. Сердечная гемодинамика и состояние кровотока на различных структурно-функциональных уровнях сосудистой системы головного мозга при гипертонической энцефалопатии. Клиническая физиология кровообращения. 2011; 4: 42-48.
- Стулин И.Д., Дебиров М.Д., Хорева Е.Т., Солонский Д.С., Кащеев А.В., Паневин А.И., Кажла-ев Д.О., Селезнев Ф.А. Энцефалопатия пробуждения - синдром преходящей венозной дисгемии у флебопатов. Клиническая физиология кровообращения. Материалы конференции «Нейросоно-логия и церебральная гемодинамика». М.; 2009: 33-36.
- Белова Л.А., Машин В.В., Моисеев М.Ю., Прошин А.Н. Сравнительное клинико-нейровизуализа-ционное исследование венозных и артериальных инсультов. Анналы клинической и экспериментальной неврологии. 2015; 9 (4): 16-21.
- Virchow R. Gesammelte Abhandlungen zur Wissenshaftlichen Medicin. Frankfurt: Meidinger; 1856.
- Суханова Г.А., Баркаган З.С., Котовщикова Е.Ф., Мамаев А.Н., Цывкина Л.П. Тромботические мезенхимальные дисплазии и их связь с другими тромбофилиями. Гематология и трансфузиоло-гия. 2003; 6: 13-14.
- Пономарева Д.А. Состояние периферического звена эритрона при дисплазии соединительной ткани у детей. Бюллетень сибирской медицины. 2008; 1: 56-59.
- Yock-Corrales A., Mackay M., Mosley I. Acute childhood arterial ischemic and hemorrhagic stroke in the emergency department. Ann. Emerg. Med. 2011; 58 (2): 156-163.
- Аббакумова Л.Н. Клинические формы дисплазии соединительной ткани у детей. СПб.: СПбГПМА; 2006. 43.
- Anderson C.M., Edelman R.R., Turski P.A. Clinical Magnetic Resonace Angiography. New York: Raven Press; 1993; 1-41: 359-398.
- Hertz H. Über die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 1881; 92: 156-171.
- Чуканова Е.И., Чуканова А.С., Мамаева Х.И. Хроническая церебральная венозная недостаточность. Этиология, клиника, лечение. Поликлиника. 2018; 1 (1): 23-27.


