Структурно-функциональная характеристика макулярной зоны сетчатки у больных сахарным диабетом 1-го и 2-го типов без диабетической ретинопатии
Автор: Казарян Армине Амасьевна, Овсепян Татевик Рубиковна, Шишкин Михаил Михайлович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 (18), 2014 года.
Бесплатный доступ
Представлены результаты морфологических и функциональных исследований макулярной зоны сетчатки у больных сахарным диабетом (СД) 1-го и 2-го типов без клинически видимой диабетической ретинопатии (ДР). Анализ томографических (ОКТ) и электроретинографических (ЭРГ) параметров выявил истончение слоев и нарушение функциональной активности макулярной зоны сетчатки у больных с СД без ДР
Сахарный диабет, диабетическая ретинопатия, оптическая когерентная томография, электроретинограмма
Короткий адрес: https://sciup.org/14338487
IDR: 14338487
Текст научной статьи Структурно-функциональная характеристика макулярной зоны сетчатки у больных сахарным диабетом 1-го и 2-го типов без диабетической ретинопатии
Диабетическая ретинопатия (ДР) является достаточно частым осложнением СД и остается основной причиной слепоты и слабовиде-ния во всем мире. ДР долгое время рассматривалась как микрососудистое осложнение сахарного диабета (СД). Однако, учитывая, что сетчатка по своим анатомо-функциональным характеристикам является васкуляризованной нейрональной тканью, то ДР является не только сосудистым, но и нейродегенеративным заболеванием [1]. Впервые в 1962 Bloodworth охарактеризовал ДР как комплекс дегенеративных изменений всех нейрональных элемен- тов сетчатки [2]. Эту гипотезу подтверждают факты нарушения цветооощущения, снижения контрастной чувствительности у больных СД без или с минимальными проявлениями ДР [3]. Считается, что нейродегенеративные изменения сетчатки являются наиболее ранним и стойким проявлением гипергликемии [4]. Ранние нейродегенеративные изменения сетчатки можно оценить с помощью электроретино-граммы (ЭРГ) и оптической когерентной томографии (ОКТ).
В связи с этим, целью нашей работы явилась оценка структурных изменений и био- электрической активности сетчатки, а также изучение взаимосвязи этих изменений у больных с СД 1-го и 2-го типов без ДР.
Материал и методы. Обследованы 22 пациента (22 глаза) с СД 1 типа без проявлений ДР (средний возраст 29,2 ±10,9 лет) – СД1ДР0 и 32 пациента (32 глаза) с СД 2 типа без ДР (средний возраст 58,7 ± 6,8 лет) – СД2ДР0.
Контрольную группу составили 64 здоровых испытуемых сопоставимого возраста: 32 человека (32 глаза) со средним возрастом 34,3 ± 9,2 лет составили контрольную группу для СД1, и 32 человека (32 глаза) со средним возрастом 54,7 ± 6,7 лет – для СД2.
Средняя продолжительность заболевания при СД1 составила 5,6±1,4 лет, а при СД2 – 8,8±2,2 лет. Средний уровень гликированного гемоглобина (HbА1с) у больных с СД1 составил 8,91±1,1%, а у больных с СД2 – 8,57±1,2%, Максимальная корригированная острота зрения (МКОЗ) в среднем составила 0,99±0,13 и достоверно не отличалась от МКОЗ у здоровых испытуемых. Всем пациентам, кроме рутинных методов исследований (острота зрения, тонометрия, офтальмоскопия), проводилась флуоресцентная ангиография (ФАГ ) – для исключения наличия ДР, исследование на ОКТ спектральных доменов RTVue-100 SD-OCT (Optvue, USA), ЭРГ исследования с помощью аппаратно-программного комплекса «Электроретиног-раф» (MBN, Россия). У всех пациентов были обследованы оба глаза, но ввиду того, что показатели ЭРГ и ОКТ правого и левого глаза у одного и того же пациента достоверно не отличались, то в статистический анализ были включены показатели только одного глаза.
Критериями включения в исследование являлись:
-
1. МКОЗ > 0,8 с рефракционными отклонениями не больше ±3,0Д.
-
2. Отсутствие в анамнезе офтальмологических операций, патологии сетчатки и зрительного нерва (ВМД, эпиретинальная мембрана, глаукома и т.д.).
Регистрировались различные виды ЭРГ: максимальная ЭРГ, фликер 30Гц ЭРГ, осцилля-торные потенциалы (ОП; отражает активность амакриновых клеток, при этом ранние ОП характеризуют активность нейронов on-пути передачи импульсов, а поздние ОП – активность нейронов off-пути), хроматическая ЭРГ на красный, зеленый и синий стимулы (характе- ризует активность различных спектральных колбочек макулярной зоны), паттерн ЭРГ, ЭРГ на длительный стимул. Оценивались амплитудные и временные показатели волн всех видов ЭРГ. Для ОП был рассчитан индекс ОП (ИОП – среднее арифметическое значение амплитудных показателей), в том числе – индекс ранних и поздних ОП (ИОП1 и ИОП2).
Статистический анализ проводили при помощи пакета статистических программ EpiInfo 5.0. Считали среднюю (M), среднеквадратичное отклонение ( σ ), статистическую погрешность среднего (m). Достоверность различий частот признаков в изучаемых группах оценивали с помощью критерия χ 2 (для таблиц 2 на 2 – в точном критерии Фишера). Связи между непрерывными числовыми переменными исследовали при помощи корреляционного анализа. Достоверность различия средних значений оценивалась критерием Стьюдента для р=0,05.
Результаты. Сравнение ЭРГ в группах больных СД1 и СД2 выявило достоверное удлинение латентности а- и b-волн макулярной ЭРГ на красный и синий стимулы, снижение амплитудных показателей а- и b-волн смешанной ЭРГ. Сравнение ОКТ параметров 2 групп выявило достоверное снижение толщины наружной перифовеа, общей толщины пери- и пара-фовеа (рис. 1а, 1б, 1в).
Однако, в силу того, что СД1 и CД2 развиваются в разном возрасте, найденные различия могут быть следствием не особенности патоло-
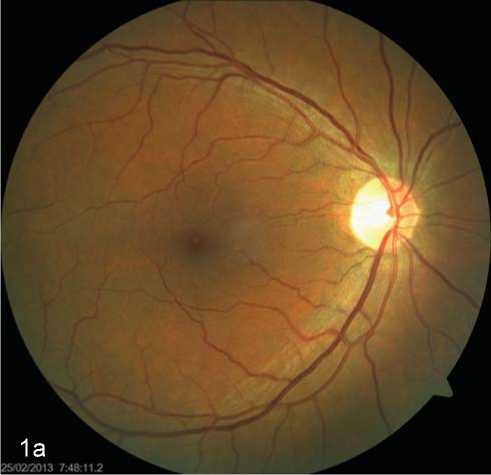
Рис.1а. Пациент В., 48 лет. Продолжительность СД – 7 лет. ОКТ макулярной зоны правого глаза. Глазное дно.
Patient:
DOB (age): 28/07/1964 (48)
ID:
Disease: diabet
Algorithm Version: A6, 2, 2, 73
Gender: M
Operator:
Exam Date: 25/02/2013
Physician:
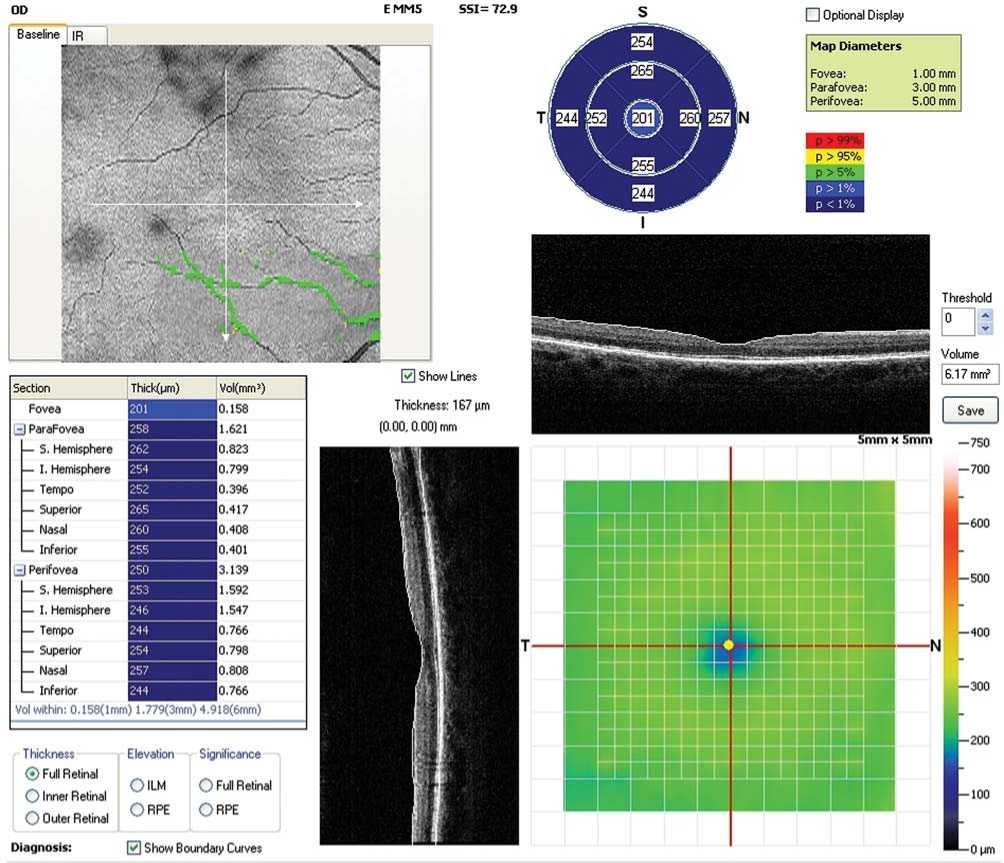
Рис.1б. Пациент В., 48 лет. Продолжительность СД – 7 лет. ОКТ макулярной зоны правого глаза. Снижение общей толщины макулы.
гических изменений сетчатки разных типов СД, а возрастных изменений сетчатки. Для проверки этой гипотезы мы использовали аппарат частной корреляции, рассчитанный под контролем возраста. И выяснили, что все найденные различия являются следствием возрастного фактора. Исходя из этого мы объединили группы СД1 и СД2.
Cоответствующие возрастные контрольные группы также объединили, так как выявленные нами достоверные различия являлись следствием отличия возраста. В дальнейшем сравнивали 2 группы – СДДР0 (54 пациента, 54 глаза) и общая контрольная группа (64 здоро- вых добровольцев – 64 глаза).
ЭРГ параметры – выявлено достоверное снижение амплитуды b-волны макулярной ЭРГ на красный (p ≤ 0,027) и синий (p ≤ 0,03) стимулы, удлинение латентности а-волны макулярной ЭРГ на зеленый стимул (p ≤ 0,04), снижение индекса ОП (рис. 2а и 2б) с высокой достоверностью (p ≤ 0,0004), снижение амплитуды а-вол-ны (p ≤ 0,01), удлинение латентности а- (p ≤ 0,005) и b-волн (p ≤ 0,001) общей ЭРГ, удлинение латентности компонента on-1 (p ≤ 0,003) ЭРГ на длительный стимул.
ОКТ параметры – выявлено снижение толщины общей фовеа (p ≤ 0,0001), пара- (p ≤ 0,001) и
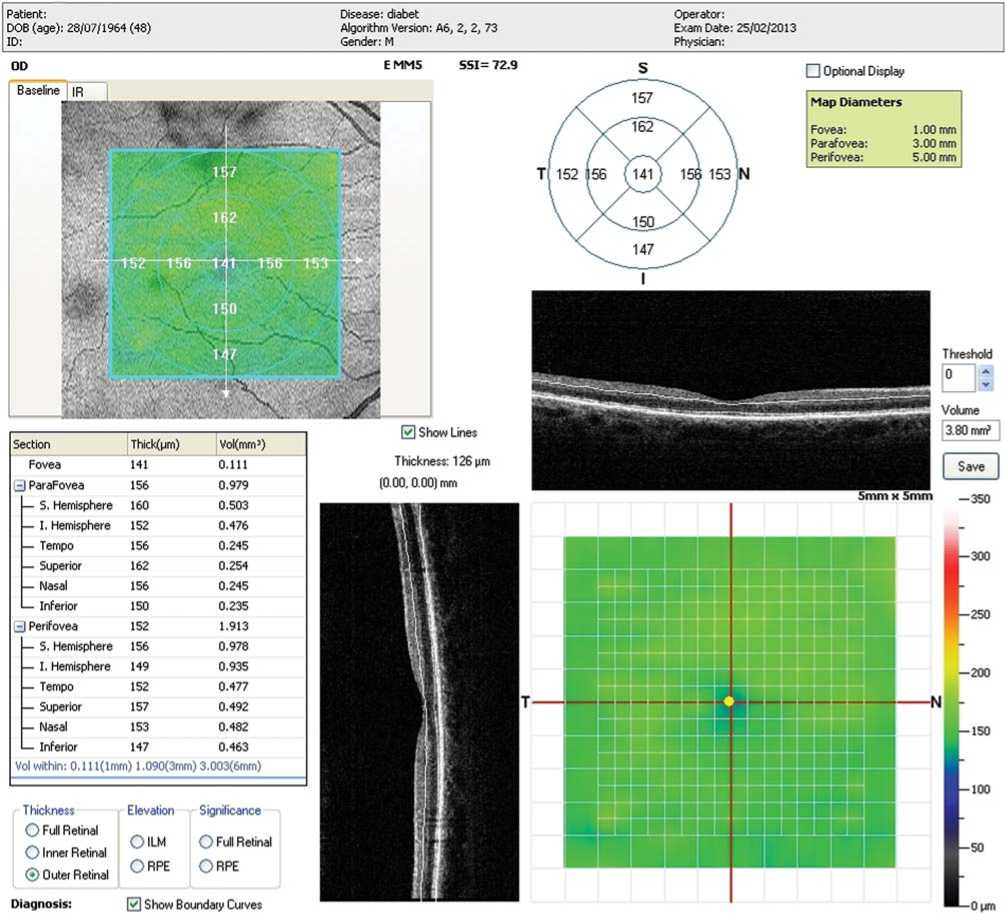
Рис.1в. Пациент В.,48 лет. Продолжительность СД – 7 лет. ОКТ макулярной зоны правого глаза. Снижение толщины наружных слоев макулы.
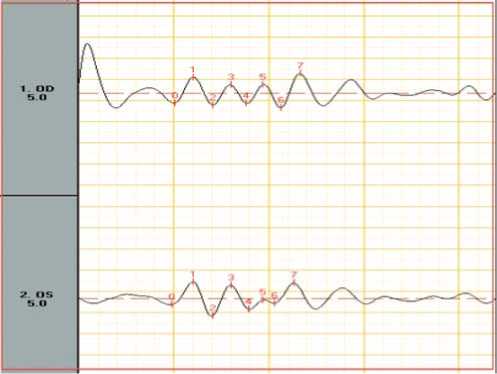
Рис.2. ОП: а – СД1, б. – СД2. Выраженное снижение амплитуд всех волн ОП.
перифовеа (p ≤ 0,02), внутренней пара-(p ≤ 0,004) и перифовеа (p ≤ 0,01), наружной парафовеа (p ≤ 0,008).
Кроме этого, нами проведены корреляции ОКТ и ЭРГ параметров как в группе больных СДДР0 (r1), так и в контрольной группе (r2).
Далее мы сравнивали достоверность отличия коэффициентов корреляции (r1 и r2) обеих групп с целью определения какие изменения ОКТ и ЭРГ параметров вызваны именно СД. Статистический анализ выявил достоверное отличие коэффициентов корреляции (табл).
Таблица
Коэффициент корреляции ЭРГ и ОКТ параметров
|
Фактор 1 |
Фактор 2 |
Г1 |
Р1 |
г2 |
р2 |
Р |
|
Лат а-красный |
Внутр, парафовеа |
0 ,2 |
0,2 |
-0,4 |
0,002 |
0,01 |
|
Ампл а-зел. |
Внутр, перифовеа |
0,15 |
0,3 |
0,66 |
0,002 |
0,04 |
|
Амп. b Зел |
Внутр, парафовеа |
0,05 |
0,7 |
0,56 |
0,01 |
0,04 |
|
Амп. b Зел |
Внутр, перифовеа |
0,13 |
0,38 |
0,76 |
0,0001 |
0,01 |
|
Лат а Зел |
Внутр, парафовеа |
0,3 |
0,4 |
-0,6 |
0,005 |
0,006 |
|
Амп. а Син. |
Внутр перифовеа |
0,02 |
0,8 |
0,47 |
0,03 |
0,05 |
|
Амп. а Син |
Наруж. перифовеа |
0,18 |
0,26 |
0,65 |
0,004 |
0,05 |
|
Амп. b Син. |
общая перифовеа |
0,3 |
0,05 |
0,46 |
0,04 |
0,3 |
|
Амп. b Син. |
Внутр, перифовеа |
0,3 |
0,04 |
0,4 |
0,05 |
0,2 |
|
Амп. b Син. |
Наруж. перифовеа |
0,27 |
0,09 |
0,65 |
0,004 |
0,11 |
|
иоп |
Внутр, перифовеа |
0,25 |
0,11 |
0,5 |
0,01 |
0,2 |
|
ИОП1 |
Внутр, парафовеа |
0,4 |
0,08 |
0,5 |
0,02 |
0,3 |
|
ИОП 2 |
общая перифовеа |
0,17 |
0,28 |
0,5 |
0,006 |
0,05 |
|
ИОП 2 |
Внутр, перифовеа |
0,12 |
0,43 |
0,57 |
0,007 |
0,04 |
Примечание: r1 – коэффициент корреляции в группе больных СДДР0, r2 – коэффициент корреляции в контрольной группе.
Р – достоверность отличия коэффициентов корреляции (r1 и r2).
Заключение. Полученные нами ОКТ и ЭРГ показатели у больных с СДДР0 типа без клинически видимой ДР свидетельствуют о диабетическом поражении слоев макулы. Первичные ранние изменения центральной зоны сетчатки у больных с СДДР0 типа проявляются в парафовеальной зоне – истончением всех слоев сетчатки, а в перифовеальной зоне – истончением только внутренних слоев сетчатки. Эти морфометрические изменения сопровождаются нарушением биоэлектрической активности внутренних слоев сетчатки (снижение амплитуды b-волны макулярной ЭРГ на красный и синий стимулы, снижение ИОП) и замедлением генерации и/или передачи импульсов. Все эти изменения свидетельствуют о развитии ранних нейродегенеративных процессов в разных слоях сетчатки.
Список литературы Структурно-функциональная характеристика макулярной зоны сетчатки у больных сахарным диабетом 1-го и 2-го типов без диабетической ретинопатии
- Antonetti D.A., et al. Diabetic retinopathy: seeing beyond glucose-induced microvascular disease. Diabetes, 2006; 55(9): 2401-11.
- Bloodworth JM Jr. Diabetic retinopathy. Diabetes, 1962; 11: 1-22.
- Roy M.S., Gunkel R.D., Podgor M.J. Color vision defects in early diabetic retinopathy. Arch Ophthalmol, 1986;104(2): 225-8.
- Van Dijk H.W., Verbraak F.D., Kok P.H., et al. Early neurodegeneration in the retina of type 2 diabetic patients. Invest Ophthalmol Vis Sci. 2012; 53:2715-9.


