Структурные особенности межклеточного матрикса кожи при хроническом облитерирующем атеросклерозе сосудов нижних конечностей по данным атомно-силовой микроскопии (сообщение 1)
Автор: Бауэр В.А., Гайдаш А.А., Соколович Г.Е., Хафизова А.Ф., Бабенко О.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4-1 т.24, 2009 года.
Бесплатный доступ
Приведены данные о структурных особенностях межклеточного матрикса кожи человека по данным атомно-силовой микроскопии в норме и при облитерирующем атеросклерозе. Изучены образцы кожи, биопсированные на основе информированного согласия у здоровых лиц и больных облитерирующим атеросклерозом. Исследования методом атомно-силовой микроскопии выполнены на базе зондовой нанолаборатории NTEGRA. Показано, что межклеточный матрикс в нормальной коже представлен вязкой жидкостью, которая в несколько слоев окружает коллагеновые фибиллы. Приведены морфометрические параметры нано (в пределах 10-100 нм)- и мезопор (в пределах 150-400 нм) кожи в норме и при хроническом облитерирующем атеросклерозе. Показано, что при облитерирующем атеросклерозе внеклеточный матрикс кожи подвергается озолению и регрессируют его пористые структуры. Одновременно снижаются показатели адгезионных сил коллагеновых волокон, что свидетельствует об их дегидратации. При этом в безволокнистой части внеклеточного матрикса регистрируется гипергидрофилия. Постулируется, что утрата пористости кожи неизбежно ведет к нарушению процессов тканевой миграции воды. На основании изменения соотношения показателей адгезионных сил уточняется ранее высказанная гипотеза, согласно которой источником воды при интерстициальном отеке в фазе блока микроциркуляции может быть вода, секвестрированная коллагеном.
Внеклеточный матрикс кожи, атомно-силовая микроскопия, хронический облитерирующий атеросклероз сосудов нижних конечностей, адгезия, секвестр воды коллагеновыми волокнами, наномезопоры
Короткий адрес: https://sciup.org/14919146
IDR: 14919146 | УДК: 616.13-004.6:617.58:616.5-076
Текст научной статьи Структурные особенности межклеточного матрикса кожи при хроническом облитерирующем атеросклерозе сосудов нижних конечностей по данным атомно-силовой микроскопии (сообщение 1)
Хронические облитерирующие заболевания артерий нижних конечностей являются составной частью заболеваний сердечно-сосудистой системы, поражая 2-3% процента населения и около 17% лиц 55-70-летнего возраста [2; 6; 8; 11; 12; 14; 16; 18]. При развитии заболевания на фоне сладж-синдрома в микроциркуляторном русле снижается объемный кровоток, что неизбежно ведет к падению перфузионного давления [1; 11; 13; 15]. При этом, несмотря на затрудненный приток, отток крови остается на прежнем уровне [1; 15]. И, тем не менее, в интерсти-ции развивается отек [9; 10; 13]. Что же является источником воды для столь объемных отеков, каковыми являются интерстициальные отеки при атеросклеротической облитерации кровеносных сосудов нижних конечностей? Возможно, что в ходе прогрессирования этого заболевания плазма крови является источником воды лишь до стадии тромбирования капиллярного русла. В этой связи напомним, что в коллагене I типа вода занимает до 70% объема, а объем этого типа белка в межуточном веществе кожи достигает 80%. Учитывая эти обстоятельства, мы полагаем, что в условиях блока микроциркуляции источником воды может стать коллаген, секвестрирующий огромные массы воды, количество которой вполне достаточно для развития обширных отеков. Цель работы – изучить структурные особенности межклеточного матрикса кожи при облитерирующем атеросклерозе.
МАТЕРИАЛ И МЕТОДЫ
Образцы кожи брали с соблюдением норм биоэтики у волонтеров (контрольная группа) и у больных с хроническим облитерирующим атеросклерозом сосудов нижних конечностей. Биопсию производили на уровне тыльной поверхности стопы в проекции медиального лимфатического коллектора. 60
Для изучения структурных характеристик межклеточного вещества использовали атомно-силовую микроскопию (AFM-сканирование) на базе зондовой нанолаборатории NTEGRA Prima. AFM-сканирование осуществлено со стороны дермы без предварительной фиксации образцов контактным методом на воздухе с помощью кремниевых зондов серии CSG10 (радиусом закругления 10 нм) в условиях постоянной силы и высоты с частотой развертки 1,56 Hz. Локальную адгезиометрию проводили методом силовой спектроскопии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рисунках 1 и 2 представлены AFM-сканы межуточного вещества здоровой кожи, где видны неизмененные коллагеновые волокна с четко просматриваемой D-периодичностью. Размер D-периодов (доменов) колеблется в пределах 61-66 нм, составляя в среднем 62 нм, что согласуется с данными рентген-структурного анализа [17]. Наружная поверхность

Рис. 1. AFM-скан межуточного вещества здоровой кожи. Размер скана 2000 нм. Демонстрируется нормальная структура коллагеновых волокон в формате структуры рельефа поверхности с четко выраженной D-периодичностью
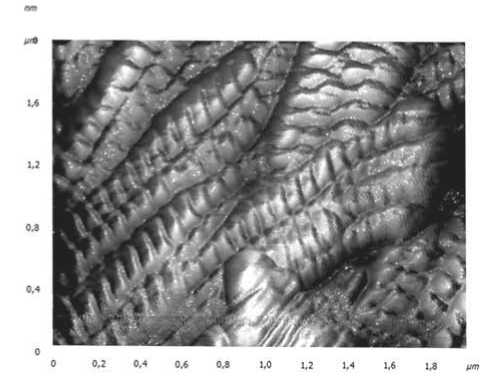
Рис. 2. AFM-скан межуточного вещества здоровой кожи. Размер скана 2000 нм. Демонстрируется участок в формате 3D с формирующимися интерстициальными нанощелями между коллагеновыми волокнами коллагеновых фибрилл в области главных участков выпуклая. Домены коллагеновых волокон выступают над поверхностью в виде ступенек высотой до 50 нм. Ступенчатость поверхности обусловлена поперечным сдвигом ультратонких нитей тропоколлагенов относительно короткой оси фибрилл. Средние значения показателей адгезионных сил в области главных участков D-периодов колеблются в пределах 4582 нН (наноньютонов). Показатель адгезионных сил в интерстициальных пространствах межклеточного матрикса, образованных расщелинами между коллагеновыми волокнами, колеблется в пределах 90110 нН.
Важной структурной особенностью межуточного вещества в здоровой коже является наличие пор. Размеры пор колеблются в пределах от 25 нм до 100-250 нм. Характерной морфологической особенностью пор является отсутствие структурированной стенки. Фактически поры представлены дырчатыми дефектами, уходящими в глубь интерстиция

Рис. 3. AFM-скан межуточного вещества здоровой кожи. Размер скана 5 000 нм. Демонстрируется участок в формате структуры рельефа поверхности с пористыми образованиями в межуточом веществе

Рис. 4. AFM-скан межуточного вещества здоровой кожи. Размер скана 1 000 нм. Демонстрируется участок в формате структуры рельефа поверхности с формировавшимися нано-и мезо-каналами в межуточном веществе
(рис. 3). Края дефектов по степени плотности межуточного вещества существенно отличаются от остального протяжения интерстициального пространства. Об этом свидетельствуют более низкие значения показателей адгезионных сил в краях 28,8± 1,4 нН и в области дна 33,3±1,2 нН нанопоровых образований. Таким образом, поверхность пор образована более плотной фазой. Указанные особенности свидетельствуют о том, что данные нанопористые образования являются достаточно обособленными структурами межуточного вещества. При этом поры расположены далеко не равномерно в интерстициальном пространстве, что, с одной стороны, свидетельствует об их высокой пластичности. Поры, в частности, могут появляться в участках повышенной метаболической активности и, наоборот, в менее активных участках коллабироваться с последующим слипанием и слиянием с межуточным веществом.
Не менее интересным морфологическим феноменом являются пористые структуры в виде наноканалов, которые более четко визуализируются в режиме фазового контраста (рис. 4). В отличие от простых пор наноканалы имеют более структурированные стенки, которые образованы более плотной фазой межуточного вещества, образованной, по-видимому, агрегированными макромолекулярными комплексами. О большей плотности стенок каналов свидетельствует их устойчивость при попытках рассечения гидрофобным кантилевером. Диаметр наноканалов колеблется от 50 до 350 нм. Наноканалы часто располагаются вблизи коллагеновых фибрилл, некоторые из них непосредственно контактируют с волокнами. Обнаруженная пористая структура явно принимает участие в водном обмене и, в частности, в процессах внутри- и трансдермальной миграции воды.
При облитерирующем атеросклерозе наблюдается массовая деструкция коллагеновых волокон, а также изменяются их морфометрические и адгезионные свойства. Разрушение коллагеновых волокон происходит по механизму упорядоченной дезинтеграции доменов по линии так называемых узких участков фибрилл. Коллагеновые волокна распадаются на фрагменты, состоящие из 5-7, 3-5, 2-3 и единичных доменов. Поперечного расщепления коллагеновых волокон с распадом на нитчатые фрагменты нами не обнаружено. Распавшиеся коллагеновые волокна являются источником частиц детрита размерами 25-50 нм. Некоторые из них агрегируются в крупные зерна диаметром от 150 нм до 8001000 нм. Численная плотность частиц интерстициального детрита может достигать 15-30 на 1 мкм2 поверхности образца. При этом количество частиц наноразмерного диапазона преобладает над количеством частиц мезо-и микроразмерных диапазонов, что свидетельствует о трансформации геля межуточного вещества в мелкодисперсный золь (рис. 5). В сохранившихся коллагеновых волокнах 61

Рис. 5. AFM-скан межуточного вещества кожи больного облитерирующим атеросклерозом. Размер скана 4 мкм. Демонстрируется распад коллагеновых фибрилл и агрегация частиц в интерстиции кожи (крупная частица указана стрелкой)
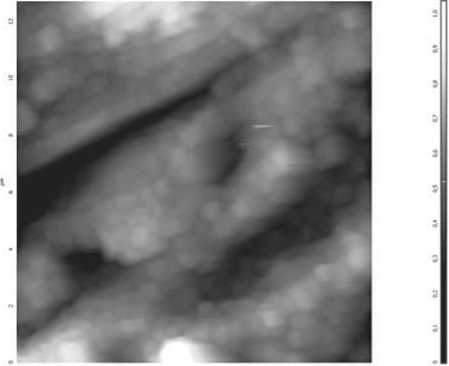
Рис. 6. AFM-скан межуточного вещества кожи больного облитерирующим атеросклерозом. Размер скана 15 000 мкм. Демонстрируется накопление вязкой жидкости в интерстициальных щелях
регистрируется разнонаправленное изменение морфометрических показателей. В частности, существенно уменьшается продольный размер D-периодов до 50,4±3,3 нм (в контроле 64,1±2,2 нм), а толщина, наоборот, увеличивается до 166,2±6,6 нм (в контроле 92,5±6,8 нм). Укорочение и одновременное утолщение доменов свидетельствуют о сжатии коллагеновых фибрилл преимущественно в продольном направлении. Морфологически такие коллагеновые волокна имеют как бы сплюснутый вид. По данным локальной силовой спектроскопии, установлено фактически двукратное падение показателей адгезионных сил коллагеновых волокон до 34,1±1,5 нН (в контроле 68,2±1,7 нН). Снижение сил адгезии свидетельствует о том, что в пористых структурах коллагеновых волокон содержится меньшее количество воды в сравнении с нормой [4, 5]. Таким образом, деструкция коллагеновых волокон при облитерирующем атеросклерозе характеризуется следующими особенностями:
-
1. Кластерный распад на отдельные домены.
-
2. Сжатие преимущественно в продольном направлении.
-
3. Дегидратация коллагеновых фибрилл.
Учитывая указанные обстоятельства, мы полагаем, что одним из ключевых механизмов разрушения коллагеновых волокон в ишемической стадии облитерирующего атеросклероза является их продольное сжатие. При этом из узких участков коллагеновых волокон, которые более рыхлые за счет меньшей концентрации нитей тропоколллагена, может выдавливаться свободная вода. В результате коллагеновые волокна высыхают и в ходе разрушения раскалываются по рыхлым участкам, формируя морфологический феномен, напоминающий сучковатый перелом сухих веток. Подобный феномен нами описан у больных, страдающих буллезными дерматозами, и назван секвестром воды [3]. Уходящая из коллагеновых фибрилл свободная вода накапливается в межуточном веществе. На это указывает увеличение значений показателей адгезионных сил межуточного вещества до 121,5±8,6 нН (в контроле 85,0±2,6 нН), что свидетельствует о выраженной гидратации межклеточного матрикса. При облитерирующем атеросклерозе межуточное вещество кожи становится слоистым. При этом толщина отдельных слоев колеблется в пределах 200-400 нм, но местами достигает 800-1000 нм. Отечная жидкость заполняет расширенные интерстициальные щели (рис. 6). Важной морфологической особенностью межклеточного матрикса при облитерирующем атеросклерозе является уменьшение количества пористых структур.
ЗАКЛЮЧЕНИЕ
При облитерирующем атеросклерозе в коллагеновых волокнах развиваются структурные и физико-химические сдвиги в виде продольного сжатия, распада и дегидратации. Межклеточный матрикс подвергается мелкодисперсному озолению, что ведет к росту осмотического давления внутри интер-стиция. В результате создаются условия для «откачки» воды из нанопор коллагеновых волокон и ее задержки в тканях. Принципиально важно то, что пористые структуры межуточного вещества подвергаются регрессии. Это затрудняет процессы внутри- и трансдермальной миграции воды и усугубляет развитие отечного синдрома.
Таким образом, в процессе развития облитерирующего атеросклероза снижается водоудерживающая способность коллагеновых белков, что способствует массовому высвобождению связанной воды и осложняется развитием обширных интерстициальных отеков.
Список литературы Структурные особенности межклеточного матрикса кожи при хроническом облитерирующем атеросклерозе сосудов нижних конечностей по данным атомно-силовой микроскопии (сообщение 1)
- Байтингер В.Ф. Основные закономерности перестройки сосудистого русла при облитерирующем атеросклерозе нижних конечностей/В.Ф. Байтингер, М.А. Соловцов, И.О. Савельев//Вопросы реконструктивной и пластической хирургии. -2001. -№3. -С. 53-54.
- Белов Ю.В. Тактика хирургического лечения больных с диффузным поражением артерий нижних конечностей/Ю.В. Белов, А.Н. Косенков, Н.Л. Баяндин//Хирургия. -1999. -№4. -С. 4-10.
- Буллёзные дерматозы (вопросы клиникоморфологической диагностики и морфогенеза по данным электронной и атомно-силовой микроскопии)/Под ред. В.В. Прохоренкова, А.А. Гайдаша, Л.Н. Синицы. -Красноярск: ООО ИПЦ «КАСС», 2008. -188 с.
- Габуда С.П. Структура коллагена и разупорядоченность водной подсистемы в фибриллярных белках/С.П. Габуда, А.А. Гайдаш, Е.А. Вязовая//Биофизика. -2005. -№2. -С. 231-235.
- Габуда С.П. Физические свойства и структура связанной воды в фибриллярных белках коллагенового типа по данным сканирующей калориметрии/С.П. Габуда, А.А. Гайдаш, В.А. Дребущак, С.Г. Козлова//Письма в ЖЭТФ. -2005. -Т. 82. -№9. -С. 697-700.
- Крестьянинов А.Е. К вопросу стандартизации оказания медицинской помощи больным с ишемией конечности на амбулаторном этапе/А.Е. Крестьянинов, В.И. Саламанов, А.М. Хабибуллин//Матер. Всероссийской науч.-практ. конф. «Стандартизация медицинских технологий, реабилитация в ангиологии и сосудистой хирургии». -Кемерово: Медицина и просвещение, 2006. -С. 22-23.
- Михайлов А.Н. Химия и физика коллагена кожного покрова/А.Н. Михайлов//Легкая индустрия. -М., 1980. -186 с.
- Покровский А.В. Неспецифический аортоартериит/А.В. Покровский, А.Е. Зотиков//Клиническая ангиология: руководство. В. 2 т./под ред. А.В. Покровского. -М.: Медицина, 2004. -С. 697-734.
- Поярков В.Д. Роль нарушений внутрикостной динамики в патогенезе ишемического синдрома и их коррекция при окклюзирующем атеросклерозе инфраингвинальных артерий: автореф. дис. … дра мед. наук/В.Д. Поярков. -Томск, 1994. -33 с.
- Поярков В.Д. Хирургия коллатеральной недостаточности нижней конечности/В.Д. Поярков. -Томск: ТМЛ-Пресс, 2007. -96 с.
- Савельев В.С. Критическая ишемия нижних конечностей/В.С. Савельев, В.М. Кошкин. -М.: Медицина, 1997. -160 с.
- Чазов Е.И. Взгляд из прошлого в будущее/Е.И. Чазов//Тер. арх. -2004. -Т. 76, №6. -С. 8-15.
- Чепеленко Г.В. Патогенез атеросклероза у больных без нарушения липидного обмена: гипотеза утилизации холестерина и образования атероматозной бляшки/Г.В. Чепеленко//Ангиол. и сосуд. хир. -2003. -№3. -С. 20-25.
- Cade, J.F. High risk of the arterially ill vor venous thromboembolism/J.F. Cade//Crit. Carc. Med. -1982. -Vol. 10, №7. -P. 75-81.
- Jon, J.H. Surgical management of Takayasus arteritis/J.H. Jon, D.K. Kim, K.H. Park//J. Korean Med. Sci. -2006. -Vol. 21, №1. -P. 20-24.
- Mydre, H. What is the clot critical limb ischemia?/H. Mydre, E. Witso//Critical ischemia. -1995. -Vol. 5, №2. 1987; 7: 13-5.
- Orgel J.P., Miller A., Irving T.C., Fischetti R.F., Hammersley A.P., Wess T.J. The insitu three dimensional packing structure of type I collagen". Structure, 9, 1061-1069. (2001).
- Van Damme, H. Acute limb ischemia: clinical, diagnostic and therapeutic aspects/H. Van Damme, R. Limet//Rev Med Liege. -2005. -Vol. 60, №4. -P. 247-254.


