Сурьмаорганические производные дикарбоновых кислот. Синтез и строение (обзор)
Автор: Губанова Юлия Олеговна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 3 т.9, 2017 года.
Бесплатный доступ
Рассматриваются методы синтеза сурьмаорганических производных дикарбоновых кислот, в которых атомы сурьмы имеют в различной степени искаженную тригонально-бипирамидальную координацию.
Пентафенилсурьма, дикарбоновая кислота, рентгеноструктурный анализ, карбоксилат бис(тетрафенилсурьмы), кислый карбоксилат тетрафенилсурьмы
Короткий адрес: https://sciup.org/147160401
IDR: 147160401 | УДК: 546.865+547.53.024+548.312.5 | DOI: 10.14529/chem170310
Текст научной статьи Сурьмаорганические производные дикарбоновых кислот. Синтез и строение (обзор)
Методы синтеза сурьмаорганических производных дикарбоновых кислот и изучение особенностей их строения практически не изучены, поэтому актуальность настоящей работы очевидна.
Первым структурно охарактеризованным дикарбоксилатом бис (тетрафенилсурьмы) является оксалат бис (тетрафенилсурьмы), полученный в 1992 году из бромида тетрафенилсурьмы и оксалата серебра в толуоле с выходом 79 % [1].
2Ph 4 SbBr + AgO(O)C–C(O)OAg → Ph 4 SbO(O)C–C(O)OSbPh 4 + 2AgBr
Более эффективный метод синтеза подобных соединений сурьмы, позволяющий выделять целевой продукт с более высоким выходом, основан на реакции пентафенилсурьмы с дикарбоновыми кислотами в растворе ароматического углеводорода. Как правило, взаимодействие исходных реагентов протекает при комнатной температуре, для завершения реакции требуется непродолжительное нагревание реакционной смеси до 80-100 ° С. В зависимости от мольного соотношения исходных реагентов могут быть получены как кислые карбоксилаты тетрафенилсурьмы, так и дикарбоксилаты бис (тетрафенилсурьмы).
Так, взаимодействие пентафенилсурьмы с дикарбоновыми кислотами в толуоле при мольном соотношении 2:1 приводит к образованию карбоксилатов бис (тетрафенилсурьмы) [2–8]. Для завершения реакции необходимо нагревание на водяной бане в течение часа. Температуры плавления и выходы карбоксилатов бис (тетрафенилсурьмы) приведены в табл. 1.
2 Ph 5 Sb + HOC(O)R(O)OH→ Ph 4 SbOС(О)R(O)COSbPh 4 + 2 PhH
R =–СH(OH)–CH 2 –,–СH(OH)–CH(OH)–; 1,2-C 6 H 4 –C≡C–; –СH 2 –CH 2 –; 1,2-С 6 F 4 ; 1,2-C 6 Cl 4 ; С 2 B 10 H 10
Таблица 1
Выходы и температуры плавления соединений (Ar 4 Sb) 2 R, полученные из пентафенилсурьмы и дикарбоновой кислоты при мольном соотношении 2:1
|
№ |
R |
Т. пл., °С |
Выход, % |
Литература |
|
1 |
–СH(OH)–CH 2 – |
165–167 |
92 |
[2] |
|
2 |
–СH(OH)–CH(OH)– |
167–168 |
94 |
[2] |
|
3 |
1,2-C 6 H 4 |
238 |
93 |
[3] |
|
4 |
–СH=CH– |
232 |
99 |
[4] |
|
5 |
–C≡C– |
178 |
90 |
[5] |
|
6 |
–СH 2 –CH 2 – |
193–194 |
98 |
[2] |
|
7 |
1,2-С 6 F 4 |
214 |
85 |
[6] |
|
8 |
1,2-C 6 Cl 4 |
227–228 |
91 |
[7] |
|
9 |
С 2 B 10 H 10 |
157 |
94 |
[8] |
При мольном соотношении 1:1 удалось получить кислые карбоксилаты тетраарилсурьмы [4, 9–11]. Температуры и выходы синтезированных соединений приведены в табл. 2.
Ar 5 Sb + HOC(O)–R–(O)COH → Ar 4 SbOC(O)–R–C(O)ОH + ArH
Ar = Ph, R= –СH=CH–,–СH 2 –CH 2 –, 1,2-C 6 H 4
Ar = p -Tol, R= 1,2-C 6 H 4
Таблица 2
Выходы и температуры плавления соединений Ar 4 SbRH, полученные из пентафенилсурьмы и дикарбоновой кислоты при мольном соотношении 1:1
|
№ |
Ar |
R |
T. пл, °С |
Выход, % |
Литература |
|
10 |
Ph |
–СH=CH– |
165 |
87 |
[4] |
|
11 |
Ph |
–СH 2 –CH 2 –, |
147 |
97 |
[9] |
|
12 |
Ph |
1,2-C 6 H 4 |
190-191 |
98 |
[10] |
|
13 |
p -Tol |
1,2-C 6 H 4 |
175 |
98 |
[11] |
В некоторых случаях при мольном соотношении 1:1 вместо ожидаемого продукта – кислого карбоксилата тетрафенилсурьмы были синтезированы карбоксилаты тетрафенилсурьмы: происходило декарбоксилирование одной из карбоксильных групп. Так были получены пропиолат тет-рафенилсурьмы (т. пл. 174 °С, выход 76 %) [5] и карборанилкарбоксилат тетрафенилсурьмы (т. пл. 148 °С, выход 88 %) [8]:
Ph 5 Sb + HOC(O)R(O)COH → Ph 4 SbOС(О)RH + PhH + CO 2
R = C≡C, C 2 B 10 H 10
Cледует отметить, что декарбоксилирование сурьмаорганического производного ацетилендикарбоновой кислоты протекало при нагревании, а производного карборанилдикарбоновой кислоты – при комнатной температуре. Минорным продуктом реакции пентафенилсурьмы с ацетилендикарбоновой кислотой являлся также карбонат бис (тетрафенилсурьмы) с выходом 10 %, идентифицированный по температуре плавления и ИК-спектру [12].
Таблица 3
Основные геометрические параметры молекул 1–9
|
№ |
R |
d Sb-O, Å |
d Sb-C экв , Å |
d Sb-C акс , Å |
ωOSbC aкс , град |
∑ω C экв SbС экв , град |
|
1 |
–СH(OH)– CH 2 – |
2,243(4) 2,267(7) |
2,111(6)–2,116(6) |
2,164(5) |
174,8(2) |
356,7 |
|
2* |
–СH(OH)– CH(OH)– |
2,252(7) 2,284(7) |
2,074(12)–2,121(9) 2,072(13)–2,102(11) |
2,164(11) 2,169(11) |
176,4(4) 177,4(3) |
356,0 358,0 |
|
3 |
1,2-C 6 H 4 |
2,242(3) |
2,115(5)–2,137(4) |
2,176(5) |
177,83(3) |
357,29 |
|
4 |
–СH=CH– |
2,207(3) 2,217(3) |
2,111(4)–2,127(4) 2,109(4)–2,114(5) |
2,172(4) 2,168(5) |
178,1(2) 177,2(2) |
357,9 357,98 |
|
5 |
–C≡C– |
2,287(4) 2,389(4) |
2,110(7)–2,133(6) 2,108(6)–2,119(6) |
2,179(6) 2,165(6) |
175,5(2) 174,7(2) |
357,0 356,2 |
|
6 |
–СH 2 –CH 2 – |
2,319(2) 2,528(2) |
2,138(3)–2,147(3) |
2,176(3) |
166,80(8) |
355,12 |
|
7 |
1,2-С 6 F 4 |
2,283(3) 2,357(3) |
2,100(5)–2,113(4) 2,108(4)–2,124(4) |
2,158(4) 2,141(4) |
176,18(14) 177,42(14) |
356,19 355,58 |
|
8 |
1,2-C 6 Cl 4 |
2,474(1) 2,310(1) |
2,098(2)–2,116(2) 2,100(2)–2,116(2) |
2,147(2) 2,164(2) |
170,14(6) 175,31(6) |
356,76 355,19 |
|
9 |
С 2 B 10 H 10 |
2,275(3) 2,364(3) |
2,115(4)–2,122(4) 2,112(4)–2,118(4) |
2,173(4) 2,165(4) |
176,77(13) 175,74(13) |
357,16 355,25 |
*Два типа кристаллографически независимых молекул.
Химия элементоорганических соединений
Согласно данным рентгеноструктурного анализа атомы сурьмы в молекулах 1–8 имеют искаженную тригонально-бипирамидальную координацию. Карбоксилатный лиганд выполняет мостиковую функцию, соединяя два фрагмента Ph 4 Sb. Аксиальные углы OSbC варьируют от 166,80(8)° до 166,80(8), суммы углов в экваториальных плоскостях от 355,12° до 358,0° (табл. 3). Аксиальные связи во всех случаях длиннее экваториальных и лежат в диапазоне 2,141(4)– 2,179(6) Å. Длины связей Sb–O варьируют в диапазоне 2,242(3)–2,528(2) Å, что больше суммы ковалентных радиусов атомов сурьмы и кислорода (2,07Å [12]).
В молекуле карборанилкарбоксилата тетрафенилсурьмы тригонально-бипирамидальная координация центрального атома сурьмы наиболее искажена. В аксиальных положениях находятся карбоксилатный и фенильные лиганды. Сумма углов в экваториальной плоскости равна 352,38(14)°. Аксиальный угол OSbC акс равен 174,06(12)°. Валентные углы OSbC экв меньше 90° и лежат в диапазоне 76,71(12)–86,89(13)°, при этом углы C акс SbC экв (97,58(15)–101,19(14)°) больше 90°. Расстояния Sb–C экв варьируют в диапазоне 2,095(4)–2,116(3) Å. Аксиальная связь длиннее экваториальных и равна 2,136(4) Å. Расстояние Sb–O составляет 2,469(3) Å, что меньше суммы ковалентных радиусов сурьмы и кислорода (2,07 Å [12]).
Таблица 4
Основные геометрические параметры молекул 10–13
|
№ |
Ar |
R |
d Sb-O, Å |
d Sb-C экв , Å |
d Sb-C акс , Å |
ωOSbC aкс , град |
∑ω C экв SbС экв , град |
|
10 |
Ph |
–СH=CH– |
2,509(1) |
2,092(2)–2,108(4) |
2,130(2) |
173,46(7) |
351,7 |
|
11 |
Ph |
–СH 2 –CH 2 – |
2,302(1) |
2,111(2)–2,121(2) |
2,169(2) |
175,78(7) |
355,99 |
|
12 |
Ph |
1,2-C 6 H 4 |
2,530(3) |
2,099(4)–2,117(4) |
2,129(4) |
177,5(1) |
352,7 |
|
13 |
p-Tol |
1,2-C 6 H 4 |
2,463(9) |
2,066(11)–2,105(10) |
2,117(11) |
176,5(4) |
352,5 |
В молекулах 10–13 тригонально-бипирамидальная координация атома сурьмы искажена в большей степени по сравнению с карбоксилатами бис (тетрафенилсурьмы). Суммы углов в экваториальной плоскости лежат в диапазоне 351,7–355,99°, углы OSbC акс 173,46(7)–177,5(1)°. Связи Sb– C акс составляют 2,117(11)–2,169(2) Å, Sb–C экв 2,066(11)–2,121(2) Å, Sb–O 2,302(1)–2,530(3) Å. Искажение валентных углов, удлинение связи Sb–O наряду с укорочением аксиальной связи демонстрируют тенденцию перехода фрагмента Ph 4 Sb в тетраэдрическую конфигурацию.
При замене ароматического углеводорода на диоксан взаимодействие пентафенилсурьмы с щавелевой кислотой (мольное соотношение 2:1) приводит к образованию сольвата оксалата бис (тетрафенилсурьмы) с диоксаном ( 14 ) [13]:
C 4 H 8 O 2
2Ph 5 Sb + HOC(O)C(O)OH → Ph 4 SbOC(O)C(O)OSbPh 4 ⋅ С 4 H 8 O 2 + 2 PhH
По данным РСА, в молекуле 14 атомы сурьмы имеют искаженное октаэдрическое окружение. В экваториальной плоскости октаэдра находятся атомы кислорода тетрадентатного лиганда, наряду с двумя атомами углерода фенильных групп, в аксиальных позициях находятся атомы углерода двух других фенильных групп. Следует отметить, что сольватная молекула диоксана не участвует в образовании внутри- и межмолекулярных водородных связей.
Взаимодействием сукцината бис (тетрафенилсурьмы) с йодом получен сольват трииодида [(μ4-сукцинато)гексадекафенилтетрасурьмы] с бензолом ( 15 ) [14]:
PhH
2Ph 4 SbOC(O)CH 2 CH 2 C(O)OSbPh 4 + 3I 2 → (Ph 4 Sb) 2 O(О)CCH 2 CH 2 C(O)О(Ph 4 Sb) 2 ][I 3 ] 2 ∙4PhH
Реакция сукцината бис (тетрафенилсурьмы) с йодом протекала с разрывом связи сурьма– кислород и образованием центросимметричных сукцинат-анионов, каждый из которых координирует на себя четыре катиона Ph 4 Sb; в качестве противоионов выступают трииодид-анионы.
Другой метод получения сурьмаорганических производных дикарбоновых кислот, основанный на реакции дигалогенида трифенилсурьмы с натриевыми солями дикарбоновых кислот в метаноле и последующим нагреванием с обратным холодильником в течение 8–12 часов, эффективен в синтезе ( μ -2,3-дибромсукцинато- κ 2 О 1: О 4) бис [метокси- κO ]трифенилсурьмы( 16 ) [15]:
CH 3 ONa
Ph 3 SbCl 2 + HO(O)C–CH(Br)–CH(Br)–C(O)OH→
→ Ph 3 (OCH 3 )SbO(O)C–CH(Br)–CH(Br)–C(O)OSb(OCH 3 )Ph 3 16
В молекуле 16 атомы сурьмы имеют незначительно искаженную тригонально-бипирамидальную координацию. В экваториальных положениях находятся атомы углерода фенильных групп, в аксиальных атомы кислорода карбоксилатного лиганда и метоксигруппы.
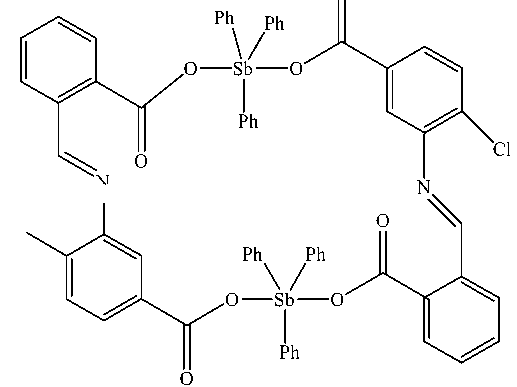
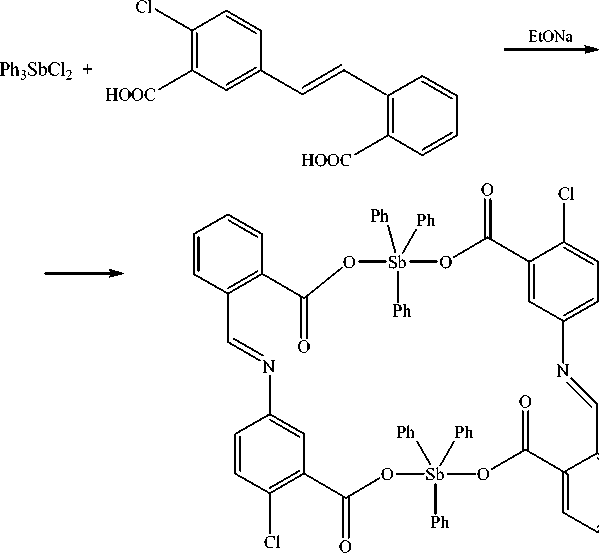
Взаимодействием хлорида трифенилсурьмы с основаниями Шиффа в присутствии метилата натрия при нагревании с обратным холодильником в течение 12 часов при мольном соотношении 1:1 были получены два 24-членных макроцикла симметричного строения общей формулы [Ph 3 SbL] 2 , где H 2 L–5-{[(2-карбоксифенил)метилен]амино}-4-хлорбензойная кислота и 5-{[(2-карбоксифенил)метилен]амино}-2-хлорбензойная кислота. В состав молекул 17 , 18 входит два атома сурьмы, содержащие два атома сурьмы, связанные между собой основаниями Шиффа, выполняющими мостиковую функцию [16].
|
Ph3SbCl2 + HOOC Cl |
Cl EtONa HOOC O Ph Ph O Sb O । I Ph O Cl NN O N Ph Ph O Sb O Ph O 17 |
Химия элементоорганических соединений
Заключение
Взамодействием пентаарилсурьмы с дикарбоновыми кислотами образуются 2 типа продуктов: 1) карбоксилаты бис (тетрафенилсурьмы), полученные из пентафенилсурьмы и дикарбоновой кислоты в толуоле при нагревании и мольном соотношении 2:1; 2) кислые карбоксилаты тетра-фенилсурьмы, синтезируемые из пентаарилсурьмы и дикарбоновой кислоты при мольном соотношении 1:1. В случае взаимодействия пентафенилсурьмы с ацетилендикарбоновой и карбора-нилдикарбоновой кислотами происходит декарбоксилирование одной из карбоксильных групп и образование пропиолата и карборанилкарбоксилата тетрафенилсурьмы соответственно. Второй метод синтеза сурьмаорганических производных дикарбоновых кислот, основанный на реакции дихлорида трифенилсурьмы с натриевыми солями дикарбоновых кислот, позволяет синтезировать биядерные макроциклические сурьмаорганические соединения, в которых карбоксилатные лиганды выполняют мостиковую функцию. Реакция сукцината бис (тетрафенилсурьмы) с йодом протекает с образованием центросимметричных сукцинат-анионов, каждый из которых координирует на себя четыре катиона Ph4Sb; в качестве противоионов выступают трииодид-анионы.
Список литературы Сурьмаорганические производные дикарбоновых кислот. Синтез и строение (обзор)
- Millington, P.L. Phenylantimony (V) Oxalates: Isolation and Crystal Structures of , 2ox and (SbPh4)2ox/P.L. Millington, D.B. Sowerby//J. Chem. Soc., Dalton Trans. -1992. -No. 7. -P. 1199-1204.
- Шарутин, В.В. Синтез и строение сукцината, малата и тартрата бис(тетрафенилсурьмы)/В.В. Шарутин, О.К. Шарутина//Коорд. химия. -2014. -Т. 40, № 9. -С. 559-563 DOI: 10.1134/S1070328414090073
- Синтез, строение и реакции μ-оксо-бис/В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др.//Коорд. химия. -2001. -Т. 27, № 9. -С. 710-716. DOI: 10.1023/a:1017909824029
- Reactions of pentaphenylantimony with dycarboxylicasids/V.V. Sharutin, O.K Sharutina, A.P. Pakusina et al.//J.Organometal. Chem. -1997. -V. 536-537, № 1-2. -P. 87-92 DOI: 10.1016/s0022-328x(96)06463-7
- Sharutin, V.V. Interaction of pentaphenylantimony with acetylenedicarboxylic acid. Molecular structure of bis(tetraphenylantimony)acetylenedicarboxilate/V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanova//Вестник ЮУрГУ. Серия «Химия». -2015. -Т. 7, № 4. -С. 17-22 DOI: 10.14529/chem150403
- Синтез и строение тетрафторфталата бис(тетрафенилсурьмы)/В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др.//Журн. общ. химии. -2002. -Т. 72, Вып. 2. -С. 2029-2032 DOI: 10.1023/A:1023411228493
- Шарутин, В.В. Синтез и строение тетрахлорфталата бис(тетрафенилсурьмы)/В В. Шарутин, O.K. Шарутина//Журн. неорг. химии. -2015. -Т. 60, №. 3. -С. 292-294 DOI: 10.1134/S0036023615030171
- Interaction of pentaphenylantimony with carboranedicarboxylic acid/V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanovaet al.//Journal of organometallic chemistry. -2015. -V. 798. -P. 41-45 DOI: 10.1016/j.jorganchem.2015.09.002
- Шарутин, В.В. Синтез и строение кислого сукцината тетрафенилсурьмы/В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова//Бутлеровские сообщения. -2014. -Т. 39, № 7. -С. 139-141.
- Синтезистроениекислогофталататетрафенилсурьмы/В.В. Шарутин, О.К. Шарутина, И.Г. Мельникова и др.//Изв. РАН. Сер. хим. -1996. -№ 8. -С. 2082-2085 DOI: 10.1007/bf01457791
- Шарутин, В.В. Реакции пентаарил сурьмы с диацилатами триарилсурьмы/В.В. Шарутин, О.К. Шарутина, А.П. Пакусина, В.К. Бельский//Журн. общ. химии. -1997. -Т. 67, Вып. 9. -С. 1536-1541.
- Бацанов, С.С. Атомные радиусы элементов/С.С. Бацанов//Журн. неорг. химии. -2001. -Т. 36, № 12. -С. 3015-3037.
- Синтез и строение сольвата оксалата бис(тетрафенилсурьмы) с диоксаном/В.В. Шарутин, О.К. Шарутина, Е.В. Артемьева и др.//Бутлеровские сообщения. -2016. -Т. 47, № 19. -С. 17-20.
- Синтез и строение сольвата трииодида с бензолом 2⋅ 4PhH/В. В. Шарутин, О.К. Шарутина, Ю.О. Губанова и др.//Коорд. химия. -2017. -Т. 43, № 7. -С. 444-448 DOI: 10.7868/S0132344X17060093
- Quan, L. (μ-2,3-Dibromo-succinato-κO:O)bis-/L.Quan, H. Yin, W. Fu//ActaCryst. Sec. E. -2011. -V. E67. -M. 713 DOI: 10.1107/S1600536811016114
- Highly symmetrical 24-membered macrocyclic organoantimony(V) complexes constructed from Schiff base ligands possessing two terminal carboxyl groups/M. Hong, H.-D. Yin, W.-K. Li et al.//Inorg. Chem. Communications. -2011. -V. 14, no 10. -P. 1616-1621 DOI: 10.1016/j.inoche.2011.06.023


