Существующие проблемы и пути их решения при анализе аминокислотного состава
Автор: Санжеев А.П., Михина А.А., Севко Д.А., Севко А.В., Ворожейкин С.Б., Анохина Е.П., Коротаева А.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (78), 2018 года.
Бесплатный доступ
При анализе белковых препаратов для получения точных результатов анализа содержания аминокислот необходимо уделять внимание как выбору метода анализа аналитов, так и методу пробоподготовки образцов. В настоящее время известно несколько основных подходов для решения такой задачи: кислотный и щелочной гидролиз. В данной статье проведено сравнение методов анализа аминокислот с их пред- и постколоночной дериватизацией на примере определения содержания лизина в образцах сульфата лизина с известным содержанием целевого вещества. Для предколоночной дериватизации использовали ортофталевый ангидрид, и нингидрин для постколоночной дериватизации. Экспериментально нами было показано преимущество использования постколоночной дериватизации, т.к. были получены более точные результаты. Хроматографическое разделение, дериватизацию и детектирование выполняли на аминокислотных анализаторах фирм Hitachi (Япония) и Sykam (Германия). Далее были рассмотрены виды пробоподготовки белковых и пептидных препаратов с последующим определением в них валина и треонина методом постколоночной дериватизации...
Аминокислоты, высокоэффективная жидкостная хроматография, ионообменная хроматография, капиллярный электрофорез, аминокислотный анализ, кислотный гидролиз
Короткий адрес: https://sciup.org/140244258
IDR: 140244258 | DOI: 10.20914/2310-1202-2018-4-185-189
Текст научной статьи Существующие проблемы и пути их решения при анализе аминокислотного состава
Аминокислоты играю огромную роль в процессах жизнедеятельности живых организмов, являясь структурной единицей белков. Они отвечают за транспорт и хранение питательных веществ, функционирование и восстановление различных тканей, в том числе мышц, костей, волос. В природе обнаружено уже более 700 аминокислот, 21 из них протеиногенная, то есть кодируется генетическим кодом.
Анализ аминокислот важен для различных областей: пищевой промышленности, производства лекарств, клинических анализов и т. д. Среди большого числа разработанных подходов (тонкослойная, ионообменная, газовая хроматография) наиболее чувствительными являются методики, основанные на хроматографическом разделении целевых аналитов с использованием различных видов дериватизации: пред- и постколоночной. Использование дериватизирующих агентов позволяет решить проблемы, возникающие при их хроматографическом разделении:
─ высокая полярность молекул аминокислот за счет наличия карбоксильной и аминогрупп не позволяет разделить их хроматографически без использования ионообменных неподвижных фаз;
─ низкие коэффициенты поглощения аминокислот в ультрафиолетовой области [1]
затрудняют их детектирование и не позволяют достичь низких пределов обнаружения.
При предколоночной дериватизации используют ортофталевый ангидрид (рисунок 1), а дериватизаты после ВЭЖХ-разделения детектируют с использованием УФ-детектора. Недостатком этого метода является наблюдае- мое в ряде случаев разложение дериватизатов до завершения анализа.
CHO
+ HS-CH3-CH2-OH * H2N-R —•
"CHO 2-меркаптоэтанол амино-группа фталевый ангидрид zCH2-CH2-OH
Рисунок 1. Реакция фталевого ангидрида с аминогруппой аминокислот
Figure 1. The reaction of the phthalic anhydride with amino acid group
При постколоночной дериватизации в качестве реагента используют нингидрин (рисунок 2), позвляющий получить стабильные дериватизаты после разделения аминокислот на ионообменной колонке. Дериватизаты при этом детектируются спектрофотометрически.
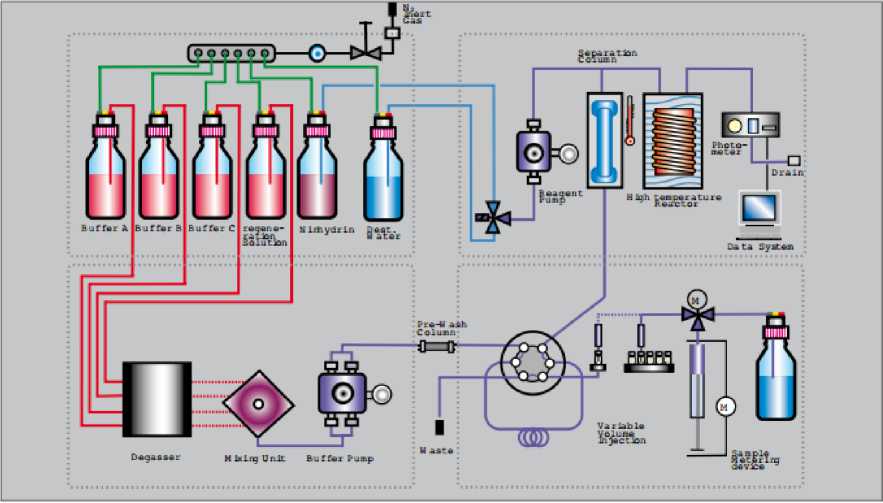
Flow Diagram S 433
Рисунок 2. Постколоночная дериватизация аминокислот нингидрином
Figure 2. Post-column ninhydrin derivatization of aminoacids
Для анализа на аминокислотный состав белковых и пептидных препаратов важным является выбор пробоподготовки, необходимо сначала провести исчерпывающий гидролиз этих полимеров до отдельных аминокислот и учесть при этом все возможные потери.
Стандартная процедура разложения белка до аминокислот – кислотный гидролиз (6М раствор соляной кислоты при температуре 110 °С [1–6]) – позволяет в дальнейшем определить все аминокислоты, кроме серосодержащих (цистеин и метионин).
Серосодержащие аминокислоты при кислотном гидролизе частично разлагаются, поэтому для точного определения их количества в пробе необходимо предварительно перевести их в стабильные соединения (рисунок 3) – цистеиновую кислоту и метионинсульфон соответственно. Для этого проводят окисление указанных аминокислот путем охлаждения (0 – 5 ºС) с надмуравьиной кислотой в течение 18 ч. Далее уже можно проводить кислотный гидролиз и количественное определение цистеиновой кислоты и метионинсульфона с последующим пересчетом на исходные аминокислоты [1, 2, 5, 6].
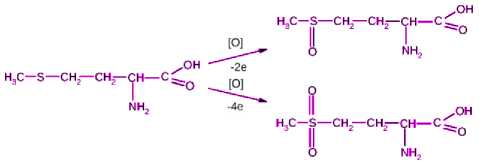
Рисунок 3. Реакция окисления метионина
Figure 3. Reaction of methionine oxidation
Отдельно отметим, что при кислотном гидролизе триптофан полностью разлагается, поэтому для его определения используют щелочной гидролиз (гидроксид бария, 110 ºС, 20 ч [7]).
Цель работы – сравнение методов с пред-и постколоночной дериватизацией на примере анализа образца сульфата лизина. Метод, который покажет наилучшую точность, будет в дальнейшем использован для отработки методов пробоподго-товки образцов белков и пептидов на содержание валина и треонина.
Материалы и методы
Реактивы и материалы
Оборудование
Анализатор аминокислотный HITACHI L-8900 (Япония); анализатор аминокислотный Sykam S 433 (Германия); хроматограф жидкостной 1290 Infinity II LC (Agilent Technologies, Германия); весы неавтоматического действия Mettler Toledo XPE 204 (Швейцария); электропечь сопротивления низкотемпературная лабораторная SNOL 67/350 (Литва)
Результаты и обсуждение
В образцах сульфата лизина было проведено определение содержания указанной аминокислоты в свободной форме. Как заявляет производитель, содержание лизина в продукте должно быть не меньше 55%. Испытания проводились двумя методами анализа: с пред-и постколоночной дериватизацией (таблица 1).
Таблица 1.
Результаты анализа сульфата лизина
Table 1.
Results of analysis of lysine sulfate
|
Название, номер пробы Sample name, sample number |
Содержание лизина, % Lysine content, % |
|||||
|
Дериватизация Derivatization |
Европейская аккредитованная лаборатория [9] European Accredited Laboratory |
Заявлено Control |
||||
|
Пред-колоночная Pre-column |
∆ от независимого определения ∆ to control |
Постколоночная [8] Post-column |
∆ от независимого определения ∆ to control |
|||
|
Сульфат лизина № 1 Lysine sulphate № 1 |
42,5 |
16,3 |
56,1 |
2,8 |
58,8 |
≥55 |
|
Сульфат лизина № 2 Lysine sulphate № 2 |
49,8 |
6,4 |
54,9 |
1,3 |
56,2 |
≥55 |
|
Сульфат лизина № 3 Lysine sulphate № 3 |
50,9 |
7,0 |
58,3 |
0,4 |
57,9 |
≥55 |
Экспериментально показано, что при постколоночной дериватизации результаты согласуются с теми, что измерены в независимой Европейской аккредитованной лаборатории. Таким образом, этот метод был выбран для дальнейшей работы.
Для определения оптимальной пробопод-готовки образцов белков и пептидов на валин и треонин в качестве первой стадии был выбран кислотный гидролиз, т. к. целевые аналиты не являются серосодержащими и не требуется определения триптофана.
После процесса кислотного гидролиза перед анализом рН в образце необходимо довести до 2,2. Для этого возможно использование двух подходов:
─ полностью выпарить соляную кислоту и перерастворить образец в буфере с соответствующим рН;
─ довести рН в образце после гидролиза до нужного значения путем добавления щелочи.
Экспериментально было установлено, что при использовании первого подхода гидрофобные аминокислоты (например, валин) не полностью перерастворяются после упаривания, и итоговые результаты анализа получаются заниженными (таблица 2). Предположительно, это связано с частичным «запеканием» целевых аналитов с углеводами.
Второй же подход, несмотря на большой расход дополнительного реактива (0,3 г щелочи на 1 пробу), дает более точные результаты.
Таблица 2.
Сравнение результатов разных способов пробоподготовки
Table 2.
Comparison of results of different methods of sample preparation
|
Аминокислота в пробе Aminoacid in sample |
Содержание аминокислот, % Aminoacids content, % |
Европейская аккредитованная лаборатория [9] European Accredited Laboratory |
|||
|
Метод перерастворения Reconstitution method |
∆ от независимого определения ∆ to control |
Метод добавки щелочи Basic addition method |
∆ от независимого определения ∆ to control |
||
|
Валин Valine |
0,64 |
0,33 |
0,96 |
0,01 |
0,97 |
|
Треонин Threonine |
0,79 |
0,05 |
0,84 |
0 |
0,84 |
Заключение
Проведено сравнение методов анализа аминокислот с пред- и постколоночной дерива-тизацией на примере определения содержания сульфата лизина. Экспериментально доказано преимущество использования постколоночной дериватизации с нингидрином.
Список литературы Существующие проблемы и пути их решения при анализе аминокислотного состава
- Fallon A., Booth R.G.F., Bell L.D. Applications of HPLC in Biochemistry. Elsevier Science Publicher B.V. (Biomedical Division), 1987. 314 p.
- Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки; под ред. Ю.В. Митина. М.: Мир, 1985. 455 c.
- Joergensen L., Thestrup H.N. Determination of amino acids in biomass and protein samples by microwave hydrolysis and ion-exchange chromatography//Journal of Chromatography A. 1995. № 1-2. P. 421-428.
- Csapo J., Kiss-Csapo Z., Albert C., Loki K. Hydrolysis of proteins performed at high temperatures and for short times with reduced racemization, in order to determine the enantiomers of D-and L-amino acids//Acta Univ. Sapientiae, Alimentaria. 2008. № 1. P. 31-48.
- Boardman N.K. Ion-Exchange Chromatography//In: Biemann K. et al. Modern Methods of Plant Analysis. Moderne Methoden der Pflanzenanalyse. Berlin, Heidelberg: Springer, 1962. V. 5. P. 159-204.
- Fountoulakis M., Lahm H.-W. Hydrolysis and amino acid composition analysis of proteins//Journal of Chromatography A. 1998. № 795 (2). P. 263-275.
- ГОСТ 13496.21-2015 Корма, комбикорма, комбикормовое сырье. Методы определения лизина и триптофана. М.: Стандартинформ, 2016.
- ГОСТ 33428-2015. Корма, премиксы. Определение содержания лизина, метионина и треонина. М.: Стандартинформ, 2016.
- Commission Regulation (EC) No. 152/2009 of 27 January 2009 laying down the methods of sampling and analysis for the official control of feed.


