Связь особенностей экспрессии интегринов 1 и 3 с лимфогенным метастазированием при инвазивной карциноме неспецифического типа молочной железы с учетом морфологической гетерогенности опухоли
Автор: Крахмаль Н.В., Телегина Н.С., Завьялова М.В., Вторушин С.В., Крохмаль В.А., Перельмутер В.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.36, 2021 года.
Бесплатный доступ
Цель: изучить экспрессию интегринов β1 и β3 при инвазивной карциноме неспецифического типа молочной железы и сопоставить полученные результаты с особенностями морфологической гетерогенности опухоли и показателями лимфогенной диссеминации.Материал и методы. Группу исследования составили 107 пациенток с раком молочной железы (РМЖ), гистотип опухоли в 100% случаев соответствовал по морфологии инвазивной карциноме неспецифического типа (инвазивная протоковая карцинома). Предоперационное лечение больные не получали. В каждом случае выполняли морфологическое исследование образцов первичной опухоли и лимфатических узлов аксиллярной клетчатки, полученных в результате проведения оперативного этапа лечения (радикальная мастэктомия или секторальная резекция молочной железы с аксиллярной лимфаденэктомией). Иммуногистохимически оценивали показатели экспрессии маркеров интегринов β1 и β3 в ткани первичной опухоли.Результаты. Исследование продемонстрировало, что увеличение степени злокачественности карциномы молочной железы ассоциировано с уменьшением частоты случаев с наличием позитивной экспрессии интегрина β1 и с увеличением частоты случаев с позитивной экспрессией интегрина β3. Метастазы в лимфатических узлах значимо реже определяли при наличии позитивной экспрессии интегрина β1 в альвеолярных и солидных структурах по сравнению со случаями негативной экспрессии маркера в аналогичных структурах (48%; χ2 = 3,5; р = 0,05 и 48%; χ2 = 4,8; р = 0,02 соответственно). Лимфогенные метастазы регистрировали статистически значимо чаще при наличии позитивной экспрессии интегрина β3 в дискретных группах клеток по сравнению со случаями, в которых экспрессия изучаемого маркера в описанных структурах была негативной (47 и 23% соответственно; χ2 = 5,1; р = 0,02).Заключение. Результаты работы показали наличие взаимосвязей между морфологической гетерогенностью опухоли и показателями экспрессии интегринов β1 и β3 в паренхиматозных структурах новообразования, выявили зависимость описанных параметров с частотой лимфогенной диссеминации у пациенток с РМЖ. Полученные в результате проведенного исследования данные расширяют и дополняют известные ранее сведения, указывают на возможность оценки маркеров в качестве потенциальных факторов прогноза течения онкологического заболевания.
Рак молочной железы, интегрины β1 и β3, морфологическая гетерогенность
Короткий адрес: https://sciup.org/149139371
IDR: 149139371 | УДК: 575.174.015.3:618.19-006.6-036.4-039-033.2-097 | DOI: 10.29001/2073-8552-2021-36-4-78-85
Текст научной статьи Связь особенностей экспрессии интегринов 1 и 3 с лимфогенным метастазированием при инвазивной карциноме неспецифического типа молочной железы с учетом морфологической гетерогенности опухоли
Крахмаль Н.В., Телегина Н.С., Завьялова М.В., Вторушин С.В., Крохмаль В.А., Перель-мутер В.М. Связь особенностей экспрессии интегринов β1 и β3 с лимфогенным метастазированием при инвазивной карциноме неспецифического типа молочной железы с учетом морфологической гетерогенности опухоли. Сибирский журнал клинической и экспериментальной медицины. 2021;36(4):78–85.
Financial disclosure:
no author has a financial or property interest in any material or method mentioned. The study was supported by Grant of the President of the Russian Federation No. НШ-2701.2020.7 “Development of new approaches to predicting the course of breast carcinomas based on morphological and molecular-genetic tumor heterogeneity”.
Актуальность
Интегрины представляют собой одно из наиболее изученных семейств поверхностных рецепторов, способных формировать связи с молекулами внеклеточного матрикса и обладающих свойством трансформировать сигналы микроокружения во внутриклеточные сигналы, запуская тем самым множество каскадных механизмов клеточного ответа. По природе интегрины являются нековалентно связанными гетеродимерными трансмембранными молекулами (гликопротеины), в состав которых входят α- и β-субъединицы, выполняющие роль клеточного рецептора и не обладающие собственной ферментативной активностью. Интегрины осуществляют запуск биохимических и механических сигналов, контролирующих клеточный фенотип, что, в свою очередь, может определять дальнейшую судьбу клетки. На данный момент у человека было охарактеризовано 18 α- и 8 β-субъединиц, образующих около 24 комбинаций αβ-рецепторов с различной субстратной специфичностью [1, 2].
Интегрины, связывающие Arg-Gly-Asp последовательность (RGD-пептид), принадлежат к наиболее изученному подсемейству, которое включает αvβ1, αvβ3, αvβ5, αvβ6, αvβ8, α5β1 и αIIbβ3 интегрины. Представители данного подсемейства распознают RGD-последовательность в некоторых компонентах внеклеточного матрикса, среди них фибронектин, витронектин, остеопонтин и фибриноген. Интегрины, участвующие в связывании клеток с коллагеном или ламинином, объединяют в другое подсемейство, которое включает β1 (α1β1, α2β1, α10β1, α11β1, α6β1) или β4 (α6β4) [1]. В этих взаимосвязях интегрины осуществляют двунаправленную коммуникацию между клетками и структурами внеклеточного матрикса [3].
Особое значение для данного исследования представляют интегрины семейства β1 и β3, поскольку именно этим молекулам отведена значимая роль в онкогенезе рака молочной железы (РМЖ). Функции интегринов β1 широко связаны с регуляцией многих клеточных процессов, таких как пролиферация, клеточная адгезия, дифференцировка, миграция и онкогенная трансформация клеток молочной железы. Так, к примеру, делеция гена субъединицы интегрина β1 в базальных или люминальных клетках ставит под угрозу регенераторный потенциал эпителия железы, что обусловливает роль интегринов β1 в поддержании пула стволовых клеток [2].
Цепь интегрина β1 может связывать различные α-субъединицы, которые определяют специфичность лиганда внеклеточного матрикса к гетеродимеру инте-грина. Мало что известно о вкладе отдельных димеров интегрина в развитие тканевых и клеточных структур молочной железы, при этом отмечен тесный синергизм сигнальных путей интегринов и EGFR (Epidermal growth factor receptor) [1, 2, 4]. При инвазивной карциноме молочной железы повышенная экспрессия интегрина β1 в опухоли коррелирует с плохой выживаемостью, что де- монстрирует его вклад в формирование более злокачественного потенциала в клетках новообразования [3]. Показано, что ремоделирование микроокружения с повышением жесткости фибриллярных коллагенов под действием лизилоксидазы, а также повышение содержания β1 интегрина при РМЖ коррелируют с возникновением процессов злокачественной трансформации нормальной ткани в инвазивную карциному, определяя худший общий прогноз [5].
Интегрин β3 в составе αvβ3-гетеродимера также связывается со многими белками внеклеточного матрикса, усиливает пролиферацию и миграцию за счет фосфорилирования нижестоящих сигналов киназного пути фокальной адгезии (FAK). Экспериментальные исследования демонстрируют способность интегринов осуществлять контроль над метастатической способностью клеток РМЖ в ткань головного мозга [6]. T. Bui и соавт. провели исследование, в котором изучение влияния комбинированной делеции β1-/β3-интегринов на прогрессирование, пролиферативный и апоптотический статус опухолей молочной железы, управляемых и регулируемых ErbB2 рецептором тирозинкиназы, показало уменьшение количества пролиферирующих клеток с возникновением нарушений в прогрессии заболевания и маргинальное увеличение количества апоптотических клеток. Кроме того, в работе было подтверждено снижение клеточной адгезии к фибронектину и распространения клеток опухоли за счет уменьшения образования устойчивых фокальных адгезионных комплексов. Исследование демонстрирует потребность в интегрине β1 в процессах метастазирования. Оценка метастатической пенетрантности и количества метастазов в легких в условиях комбинированной делеции β1-/β3-интегринов показала как уменьшение количества метастазов в легочной ткани, так и снижение пенетрантности. При этом селективная делеция интегринов β1 оказывает большее влияние на процессы опухолевой диссеминации, чем селективная делеция интегринов β3 [7].
Известно, что для РМЖ характерным является наличие выраженной внутриопухолевой гетерогенности, при этом между опухолевыми клетками и компонентами микроокружения карциномы существуют сложные взаимодействия. Стромальные клетки, внеклеточный матрикс и межклеточная жидкость в значительной мере определяют процессы опухолевой прогрессии и метастазирования [3, 8]. В свою очередь, особенности микроокружения опухоли могут влиять на формирование клинически значимых вариаций фенотипов РМЖ и, возможно, способны предсказать исход [9]. Экспрессия и активность интегринов, их адгезионные свойства являются важными в процессах онкогенеза, определяя вероятность метастазирования, а также формирования лекарственной устойчивости опухоли [10]. В связи с этим определенный интерес представляло исследование и оценка экспрес-сионных характеристик описанных маркеров в опухоли при РМЖ, сопоставление полученных результатов с особенностями гетерогенности строения карцином данной локализации и показателями лимфогенной опухолевой диссеминации.
Материал и методы
Группу исследования составили 107 пациенток, которые проходили лечение в отделении общей онкологии НИИ онкологии Томского НИМЦ. У всех пациенток был диагностирован РМЖ, гистотип опухоли в 100% случаев соответствовал по морфологии инвазивной карциноме неспецифического типа (инвазивная протоковая карцинома) молочной железы. Возраст пациенток варьировал от 29 до 85 лет (средний возраст – 57,2 ± 11,2 года), 74,8% ( n = 80) составили женщины старше 50 лет, меньшими по количеству оказались группы в возрасте от 35 до 50 лет – 23,4% ( n = 25) и до 35 лет – 1,8% ( n = 2). У 31 пациентки (29%) менструальная функция была сохранена (возраст 45,7 ± 8,1 года), у 76 (71%) определялось состояние менопаузы (возраст 61,9 ± 8,6 года). Предоперационное лечение больные не получали. В 49% случаев ( n = 52) объем оперативного пособия соответствовал радикальной мастэктомии, в 51% ( n = 55) – секторальной резекции молочной железы с аксиллярной лимфаденэктомией. Стадию заболевания оценивали в соответствии с международной классификацией опухолей молочной железы по системе TNM (WHO Classification of Tumors Editorial Board. Breast Tumours; Lyon, 2019).
Чаще выявлялись I и IIA стадии ( n = 49 и n = 33 соответственно), реже диагностировали IIB ( n = 14), IIIA ( n = 9), IIIB ( n = 1) и IIIC ( n = 1) стадии процесса. Новообразования наиболее часто располагались в наружных квадрантах молочных желез (48,6%; n = 52), реже – во внутренних квадрантах (25,23%; n = 27) и на границе наружных и внутренних квадрантов (24,3%; n = 26). Центральная локализация процесса наблюдалась лишь в 1,87% случаев
( n = 2). В исследуемой группе преобладали опухоли, размер которых соответствовал 2–5 см и менее 2 см (52,34%; n = 56 и 46,73%; n = 50 соответственно), в 0,93% случаев ( n = 1) размер первичного новообразования составил более 5 см.
Выполняли морфологическое исследование операционного материала. Макроскопически оценивали ткань первичной опухоли молочной железы и ткань органа вне новообразования с целью исключить случаи с мульти-центрическим ростом. Аксиллярную клетчатку детально исследовали на предмет выявления всех имеющихся в пределах операционного материала лимфатических узлов. Материал фиксировали в 10% растворе нейтрального формалина в течение 24 ч с последующей вырезкой образцов. Проводку, заливку материала в парафин и изготовление гистологических срезов осуществляли по стандартной методике с окраской препаратов гематоксилином и эозином. В полученных срезах морфологическое исследование ткани первичной опухоли проводили согласно следующему алгоритму: определяли гистологический тип РМЖ и оценивали степень злокачественности новообразования.
Гистотип устанавливали в соответствии с классификацией опухолей молочной железы (WHO Classification of Tumors Editorial Board. Breast Tumours; Lyon, 2019). В исследование включали только случаи с классической морфологией инвазивной карциномы неспецифического типа. Степень злокачественности определяли по модифицированной схеме P. Scarff, H. Bloom и W. Richardson. В паренхиматозном компоненте опухоли оценивали наличие различных типов структур: альвеолярных, трабекулярных, тубулярных и солидных, а также дискретные группы опухолевых клеток (рис. 1). К альвеолярным структурам относили комплексы опухолевых клеток (15– 20 клеток) округлой или слегка неправильной округлой формы.
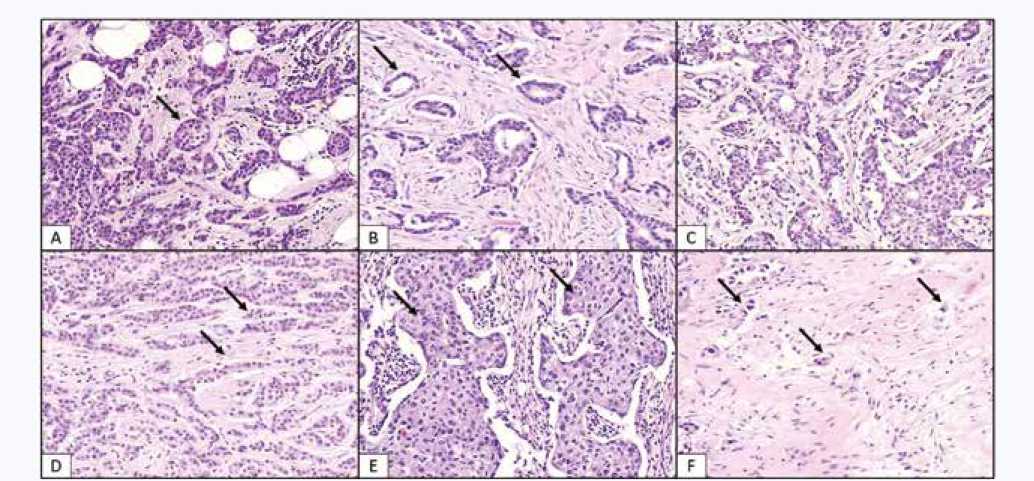
Рис. 1. Опухолевые структуры паренхиматозного компонента инвазивной карциномы неспецифического типа молочной железы. Окраска гематоксилином и эозином. Увеличение × 400. Стрелками указаны: A – альвеолярные структуры, B – тубулярные структуры, C – паренхиматозный компонент опухоли с разными структурами, D – трабекулярные структуры, E – солидные структуры, F – группы опухолевых клеток в строме опухоли
Fig. 1. Tumor structures in parenchymal component of nonspecific invasive breast carcinoma. Hematoxylin and eosin stain, × 400. Arrows indicate:
A – alveolar structures, B – tubular structures, C – parenchymal component of tumor with different structures, D – trabecular structures, E – solid structures, F – groups of tumor cells in the tumor stroma
Трабекулярные структуры представляли собой один ряд мелких относительно мономорфных клеток либо 2– 3 практически параллельно расположенных ряда клеток средних размеров с умеренно выраженной цитоплазмой, с округлыми нормохромными или гиперхромными ядрами.
Тубулярными считали однорядные по типу «замыкающих» опухолевые структуры с наличием просвета в центре, образованные достаточно мономорфными клетками с нормохромными округлыми ядрами. К солидным относили структуры, представляющие собой различные по размеру и форме поля, состоящие из мелких клеток с умеренно выраженной цитоплазмой и мономорфными ядрами или из крупных клеток с обильной цитоплазмой и полиморфными ядрами, плотно прилежащих друг к другу. Дискретно располагающиеся в строме новообразования скопления от 1 до 4 клеток, различные по своему строению, считали группами клеток.
В большинстве случаев паренхиматозный компонент первичной опухоли молочной железы имел смешанное строение, в котором отмечалось наличие вариаций в сочетании разных типов перечисленных выше структур (см. рис. 1). Кроме того, в каждом случае при оценке паренхиматозного компонента подсчитывали количество разных типов структур (от 1 до 5). При исследовании лимфатических узлов подсчитывали общее количество лимфоузлов, оценивали наличие в них метастатического поражения и количество лимфоузлов с метастазами.
Иммуногистохимическое исследование проводили с применением антител фирмы Abcam к интегрину β3 ab75872 (Сlone EPR2417Y; кроличьи моноклональные; 1 : 250) и к интегрину β1 ab3167 (Сlone 4B7R; мышиные моноклональные; 1 : 20) (рис. 2). Экспрессию исследуемых маркеров в структурах паренхиматозного компонента первичной опухоли инвазивной карциномы неспецифического типа молочной железы оценивали по следующим параметрам: наличие (позитивная экспрессия) или отсутствие (негативная экспрессия) экспрессии; процент опухолевых клеток с позитивной экспрессией маркера (в 10 полях зрения на 1000 клеток при увеличении × 400).
Исследование выполнялось с применением светового микроскопа Carl Zeiss Axio Lab.A1 (Германия). Статистическая обработка полученных данных выполнялась с использованием пакета программ STATISTICA 10.0. Применялись дисперсионный анализ и критерий χ2. Обсуждались результаты со статистической значимостью различий при р < 0,05 и с тенденцией к различиям при р < 0,1.
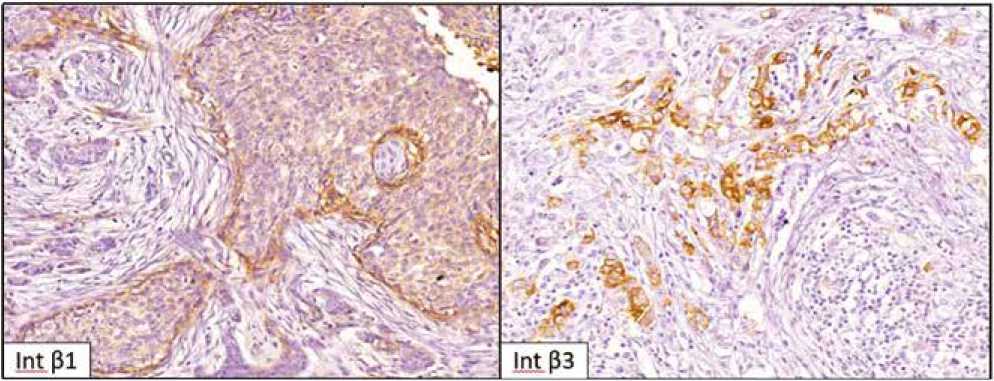
Рис. 2. Наличие позитивной экспрессии интегрина β1 и интегрина β3 в структурах паренхиматозного компонента инвазивной карциномы неспецифического типа молочной железы. Увеличение × 400
Fig. 2. Presence of positive β1 and β3 integrin expression in the structures of parenchymal component of nonspecific invasive breast carcinoma, × 400
Результаты и обсуждение
Морфологическое исследование образцов опухолевой ткани молочной железы показало следующие результаты. Оценка паренхиматозного компонента новообразования молочной железы выявила, что наименьшими по частоте встречаемости в опухоли являлись тубулярные структуры (49%), при этом альвеолярные (73%; р = 0,0002), трабекулярные (85%; р = 0,0000), солидные (65%; р = 0,009) структуры, в том числе группы клеток (75%; р = 0,0001), определялись значимо чаще и приблизительно с одинаковой частотой. Подсчет количества разных типов структур в паренхиматозном компоненте показал, что почти каждый образец характеризовался различным сочетанием опухолевых структур.
Наиболее часто выявлялись разнообразные по строению опухоли, паренхиматозный компонент которых включал до 4 типов структур. Представленные исключительно одним типом опухолевых структур мономорфные новообразования молочной железы диагностировали статистически значимо реже (1,87%; n = 2) по сравнению с карциномами, в которых присутствовали 2 (18,69%; n = 20; p = 0,0000), 3 (26,17%; n = 28; p = 0,0000), 4 (37,38%; n = 40; p = 0,0000) или 5 типов структур (15,89%; n = 17; p = 0,0002).
Следующим этапом с применением метода иммуногистохимии в опухолевой ткани проводили оценку экспрессии изучаемых маркеров с учетом морфологического строения карциномы молочной железы. Изучение особенностей экспрессии показало, что наличие пози- тивной экспрессии интегрина β1 чаще наблюдалось в солидных структурах (35%; n = 27) по сравнению с тубулярными (15%; n = 6; p = 0,01), трабекулярными (16%; n = 9; p = 0,008) структурами и группами опухолевых клеток (14%; n = 4; p = 0,01). При этом наиболее высокий процент позитивной экспрессии интегрина β1 отмечался в тубулярных структурах и в группах опухолевых клеток (таблица). Позитивная экспрессия маркера интегрина β3 статистически значимо чаще определялась в солидных структурах (72%; n = 68), а также в дискретных группах опухолевых клеток (65%; n = 64). При сопоставлении показателей частоты позитивной экспрессии маркера между структурами было отмечено наличие статистически значимых различий между солидными структурами и альвеолярными (19%; n = 11; p = 0,0000), тубулярными (25%; n = 9; p = 0,0000) и трабекулярными структурами (22%; n = 12; p = 0,0000). Аналогичного рода закономерность прослеживалась и в отношении групп опухолевых клеток, в которых значимо чаще регистрировалась позитивная экспрессия интегрина β3 нежели в альвеолярных, тубулярных и трабекулярных структурах (p = 0,0000). Наиболее высокий процент позитивной экспрессии интегрина β3 отмечался в трабекулярных и солидных структурах, при этом тубулярные структуры и группы опухолевых клеток характеризовались наименьшим процентом экспрессии маркера (см. табл.).
Таблица. Позитивная экспрессия интегрина β1 и β3 в разных структурах паренхиматозного компонента инвазивной карциномы неспецифического типа молочной железы, %
Table. Positive β1 and β3 integrin expression in different structures of parenchymal component of nonspecific invasive breast carcinoma, %
|
Локализация экспрессии Expression localization |
Экспрессия интегрина β1, М ± SD Percentage of β1 integrin expression, М ± SD |
Экспрессия интегрина β3, М ± SD Percentage of β3 integrin expression, М ± SD |
|
|
Альвеолярные структуры Alveolar structures |
1 |
38,8 ± 13,9 ( n = 15) |
13,6 ± 6,2 ( n = 11) |
|
Тубулярные структуры Tubular structures |
2 |
61,2 ± 10,1 ( n = 6) p 1 = 0,0010 p 3 = 0,0001 p 4 = 0,0300 |
7,5 ± 0,3 ( n = 9) p 1 = 0,0040 p 3 = 0,0020 p 4= 0,0000 |
|
Трабекулярные структуры Trabecular structures |
3 |
33,3 ± 10,7 ( n = 9) |
25,9 ± 16,3 ( n = 12) |
|
Солидные структуры Solid structures |
4 |
44,2 ± 19,9 ( n = 27) |
21,1 ± 7,0 ( n = 68) |
|
Группы клеток Groups of tumor cells |
5 |
70,5 ± 13,8 ( n = 4) p 1 = 0,0004 p 3 = 0,0001 p 4 = 0,0080 |
8,4 ± 1,9 ( n = 64) p 1 = 0,0000 p 3 = 0,0000 p 4= 0,0000 |
Сопоставление особенностей экспрессии маркеров интегрина β1 и интегрина β3 в структурах паренхиматозного компонента со степенью злокачественности опухоли позволило выявить следующую зависимость. Позитивная экспрессия интегрина β1 статистически значимо реже обнаруживалась при второй степени злокачественности, чем при первой (19%; n = 15 и 45,5%; n = 5; p = 0,03 соответственно). В отношении экспрессии интегрина β3 исследование показало диаметрально противоположные результаты. Позитивная экспрессия интегрина β3 значимо чаще определялась в опухолях, по морфологии соответствующих второй степени злокачественности, и значимо реже – при первой (77%; n = 61 и 45,5%; n = 5; p = 0,01 соответственно). В случаях опухолей с третьей степенью злокачественности отчетливых закономерностей обнаружено не было.
Морфологическое исследование и оценка паренхиматозного компонента инвазивной карциномы неспецифического типа молочной железы и последующее сопоставление полученных результатов с показателями лимфогенного метастазирования позволило выявить ряд взаимосвязей. Количество лимфатических узлов с наличием метастатического поражения не было ассоциировано с обнаружением в паренхиме конкретных опухолевых структур. Кроме того, количество разных типов структур в паренхиматозном компоненте новообразования не было связано ни с частотой, ни с выраженностью лимфогенного метастазирования.
Представляющие определенный интерес результаты были получены при сопоставлении особенностей экспрессии интегринов семейств β1 и β3 в структурах опухоли с показателями лимфогенной диссеминации. Очаги метастатического поражения в лимфатических узлах значимо реже определялись при наличии позитивной экспрессии интегрина β1 в альвеолярных (20%) и солидных (22%) структурах по сравнению со случаями с негативной экспрессией маркера в аналогичных структурах (48%; χ2 = 3,5; р = 0,05 и 48%; χ2= 4,8; р = 0,02 соответственно). Лимфогенные метастазы наблюдались статистически значимо чаще при наличии позитивной экспрессии инте-грина β3 в дискретных группах клеток по сравнению со случаями, в которых экспрессия изучаемого маркера в описанных структурах была негативной (47 и 23% соответственно; χ2 = 5,1; р = 0,02). Исследование продемонстрировало, что при наличии лимфогенных метастазов значимо чаще нежели при их отсутствии определялся более высокий процент экспрессии интегрина β3 в альвеолярных (22,5 ± 4,1; n = 6 и 3,0 ± 0,3; n = 5; р = 0,0000 соответственно), трабекулярных (43,8 ± 15,4; n = 6 и 8,0 ± 4,0; n = 6; р = 0,0000 соответственно), солидных структурах (31,4 ± 4,0; n = 27 и 14,2 ± 8,6; n = 41; р = 0,0000 соответственно) и дискретных группах опухолевых клеток
(12,6 ± 6,6; n = 30 и 4,8 ± 2,1; n = 34; р = 0,0000 соответственно). В тубулярных структурах процент экспрессии интегрина β3 при наличии в лимфатических узлах метастазов был минимальным (3,2 ± 0,8; n = 4).
Исследование зависимости экспрессионных характеристик ткани опухолей и клинико-морфологических параметров позволило определить ряд особенностей. Было установлено, что увеличение степени злокачественности карциномы молочной железы ассоциировано с уменьшением частоты случаев с наличием позитивной экспрессии интегрина β1 и с увеличением частоты случаев с позитивной экспрессией интегрина β3. Описанный вектор изменения экспрессионного профиля исследуемых маркеров сопряжен с увеличением частоты случаев метастатического поражения лимфоузлов. На основании полученных данных можно сделать предположение о том, что степень злокачественности выше при наличии в клетках опухоли инвазивных признаков, определяющих процессы лимфогенной диссеминации. При уточнении характера изменения экспрессии изучаемых параметров в различных структурах паренхиматозного компонента опухоли обнаружено, что экспрессия маркеров в дискретных опухолевых клетках также сопряжена со степенью злокачественности. Наибольший интерес в этом плане представляет усиление экспрессии интегринов β1 и β3. В литературе имеются сведения о том, что повышенная экспрессия в ткани опухоли интегрина β3 в случаях РМЖ, ассоциированная с высокой миграционной способностью злокачественно трансформированных клеток, определяет высокий злокачественный потенциал карциномы [11].
Данные, полученные в результате нашего исследования, также указывают на такую взаимосвязь. Наряду с этим, представленная в литературных источниках информация относительно экспрессии интегрина β1 подтверждает его значение и участие в процессах пролиферации клеток, миграции и инвазии, что, в свою очередь, определяет прогрессирование болезни. Авторы отмечают, что высокая экспрессия маркера интегрина β1 при протоковой карциноме in situ молочной железы может быть ассоциирована с агрессивным течением, а повышенный уровень данного показателя при инвазивных формах сочетается с низкой выживаемостью пациентов, короткими безрецидивным и безметастатическим периодами [1, 12, 13].
Заключение
Таким образом, полученные в результате нашего исследования данные относительно существования взаимосвязи между экспрессией интегринов семейства β1 и β3 при инвазивной карциноме молочной железы неспецифического типа в разных структурах опухоли с показателями лимфогенной диссеминации расширяют и дополняют известные ранее сведения. Так, N.E. Ramirez и соавт. в эксперименте на моделях РМЖ у мышей продемонстрировали, что интегрины семейства β1 скорее подавляют образование метастазов, подтверждая этот факт регистрацией высокой экспрессии маркера в клетках нормального эпителия молочной железы и его утратой при развитии карциномы. Эта закономерность позволила предположить, что интегрины семейства β1 могут являться функциональными ингибиторами возникновения метастатических очагов [14]. S. Havaki в своем исследовании связывает повышение миграционной способности клеток опухоли и усиление их инвазивных свойств с повышенной экспрессией интегрина β3 в опухолевых клетках при РМЖ, что впоследствии также может определять развитие метастазов [11]. Результаты работы демонстрируют потенциальную возможность получения дополнительных новых факторов прогностического значения в случаях инвазивной карциномы молочной железы, основанную на изучении молекулярно-биологического профиля опухоли с оценкой экспрессии интегриновых рецепторов семейства β1 и β3.
Список литературы Связь особенностей экспрессии интегринов 1 и 3 с лимфогенным метастазированием при инвазивной карциноме неспецифического типа молочной железы с учетом морфологической гетерогенности опухоли
- Blandin A.F., Renner G., Lehmann M., Lelong-Rebel I., Martin S., Don-tenwill M. ß1 Integrins as therapeutic targets to disrupt hallmarks of cancer. Front. Pharmacol. 2015;6:279. DOI: 10.3389/fphar.2015.00279.
- Romagnoli M., Bresson L., Di-Cicco A., Pérez-Lanzôn M., Legoix P., Baulande S. et al. Laminin-binding integrins are essential for the maintenance of functional mammary secretory epithelium in lactation. Development. 2020;147(4):dev181552. DOI: 10.1242/dev.181552.
- Smeland H.Y., Askeland C., Wik E., Knutsvik G., Molven A., Edelmann R.J. et al. Integrin allßl is expressed in breast cancer stroma and associates with aggressive tumor phenotypes. J. Pathol. Clin. Res. 2020;6(1):69-82. DOI: 10.1002/cjp2.148.
- Shen M., Jiang Y.Z., Wei Y., Ell B., Sheng X., Esposito M. et al. Tinagll suppresses triple-negative breast cancer progression and metastasis by simultaneously inhibiting Integrin/FAK and EGFR signaling. Cancer Cell. 2019;35(1):64-80.e7. DOI: 10.1016/j.ccell.2018.11.016.
- Acerbi I., Cassereau L., Dean I., Shi Q., Au A., Park C. et al. Human breast cancer invasion and aggression correlates with ECM stiffening and immune cell infiltration. Integr. Biol. (Camb.). 2015;7(10):1120-1134. DOI: 10.1039/c5ib00040h.
- Naik A., Al-Yahyaee A., Abdullah N., El-Sam J., Al-Zeheimi N., Yaish M. et al. Neuropilin-1 promotes the oncogenic Tenascin-C/integrin ß3 pathway and modulates chemoresistance in breast cancer cells. BMC Cancer. 2018;18(1):533. DOI: 10.1186/s12885-018-4446-y.
- Bui T., Rennhack J., Mok S., Ling C., Perez M., Roccamo J. et al. Functional redundancy between ß1 and ß3 Integrin in activating the IR/Akt/mTORCI signaling axis to promote ErbB2-driven breast cancer. Cell Rep. 2019;29(3):589-602.e6. DOI: 10.1016/j.celrep.2019.09.004.
- Maman S., Witz I.P. A history of exploring cancer in context. Nat. Rev. Cancer. 2018;18(6):359-376. DOI: 10.1038/s41568-018-0006-7.
- Nienhuis H.H., Gaykema S.B., Timmer-Bosscha H., Jalving M., Brouw-ers A.H., de Hooge. et al. Targeting breast cancer through its microenvironment: current status of preclinical and clinical research in finding relevant targets. Pharmacol. Ther. 2015;147:63-79. DOI: 10.1016/j. pharmthera.2014.11.004.
- Seguin L., Desgrosellier J.S., Weis S.M., Cheresh D.A. Integrins and cancer: Regulators of cancer sternness, metastasis, and drug resistance. Trends Cell Biol. 2015;25(4):234-240. DOI: 10.1016/j. tcb.2014.12.006.
- Havaki S., Kouloukoussa M., Amawi K., Drosos Y., Arvanitis L.D., Goutas N. et al. Altered expression pattern of integrin alphavbeta3 correlates with actin cytoskeleton in primary cultures of human breast cancer. Cancer Cell Int. 2007;7:16. DOI: 10.1186/1475-2867-7-16.
- Missan D.S., DiPersio M. Integrin control of tumor invasion. Crit. Rev. Eukaryot. Gene Expr. 2012;22(4):309-324. DOI: 10.1615/critreveukar-geneexpr.v22.i4.50.
- Nistico P., Di Modugno F., Spada S., Bissell M.J. ß1 and ß4 integrins: From breast development to clinical practice. Breast Cancer Res. 2014;16(5):459. DOI: 10.1186/s13058-014-0459-x.
- Ramirez N.E., Zhang Z., Madamanchi A., Boyd K.L., O'Rear L.D., Nashabi A. et al. The a2ß, integrin is a metastasis suppressor in mouse models and human cancer. J. Clin. Invest. 2011;121(1):226-237. DOI: 10.1172/JCI42328.


