Свойства штаммов Bacillus subtilis как продуцентов амилаз при производстве сахаросодержащей кормовой добавки
Автор: Донкова Н.В., Донков С.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 5, 2020 года.
Бесплатный доступ
Цель исследования - изучение сравнительной амилолитической активности у штаммов Bacillus subtilis как продуцентов амилаз при производстве сахаросодержащей кормовой добавки. В задачи исследования входило: 1) изучение амилолитической активности у трех штаммов микроорганизма Bacillus subtilis: штамма № 2-amylolytic, штамма № 9-amylolytic и штамма № 12-amylolytic; 2) установление количества спор каждого штамма, дающих максимальный амилолитический эффект. Приводятся результаты изучения амилолитической активности у различных штаммов микроорганизма Bacillus subtilis. Разрабатываемая технология предусматривает применение одного из штаммов микроорганизма Bacillus subtilis в качестве продуцента амилолитического фермента с целью получения из крахмала сахаросодержащей кормовой добавки, предназначенной для телят. Установлена амилолитическая активность различных штаммов микроорганизма Bacillus subtilis: № 2-amylolytic, № 9-amylolytic и № 12-amylolytic, - с определением количества спор в штаммах, дающего максимальный амилолитический эффект. Показано, что наивысшая амилолитическая активность определяется у штамма Bacillus subtilis № 12-amylolytic, средняя - у штамма Bacillus subtilis № 9-amylolytic и наименьшая - у штамма Bacillus subtilis № 2-amylolytic. Количество спор, дающее максимальный амилолитический эффект у разных штаммов, в среднем составило 125 000 спор/мл. Применение телятам сахаросодержащей кормовой добавки позволяет не только обеспечить их организм сахарами, но и повысить переваримость крахмала, который поступает в желудочно-кишечный тракт телят с растительным кормом. Кроме того, содержащиеся в сахаросодержащей кормовой добавке штаммы микроорганизмы Bacillus subtilis обладают антагонистической активностью по отношению к энтеропатогенным бактериям, т. е. такая добавка обладает пробиотическими свойствами, и потому ее применение будет не только устранять дефицит сахаров в рационе, но и профилактировать желудочно-кишечные заболевания у телят.
Сахаросодержащая кормовая добавка, пробиотик, амилолитическая активность
Короткий адрес: https://sciup.org/140250618
IDR: 140250618 | УДК: 579.66 | DOI: 10.36718/1819-4036-2020-5-136-141
Текст научной статьи Свойства штаммов Bacillus subtilis как продуцентов амилаз при производстве сахаросодержащей кормовой добавки
Введение. В нашей стране и за рубежом для производства пробиотических препаратов используются микроорганизмы, являющиеся представителями семейств Lactobacillus и Bifidobacterium . В последнее время в таком качестве стали использовать и спорообразующие бактерии, в основном из рода Bacillus .
Представители рода Bacillus отличаются высоким и разнообразным спектром биологической активности, обладая выраженным антаго- низмом к патогенным микроорганизмам, они способны продуцировать целый ряд ферментов, расщепляющих крахмал, целлюлозу, белки, жиры [1].
Способность спорообразующих бактерий оказывать пробиотическое действие привела к разработке на их основе препаратов, отнесенных к поколению так называемых биоэнтеросептиков – «самоэлиминирующихся антагонистов» (бактерии, которые не являются специфичными обитателями желудочно-кишечного тракта и которые, как правило, быстро выводятся из организма). К настоящему времени на основе спорообразующих бактерий в мире создано около пятидесяти таких препаратов, например, Bio-Vita, Miyarisan, Biosubtil и др. [2].
Российскими учеными на основе представителей рода Bacillus для медицины и ветеринарии разработано более двадцати пробиотических препаратов, к ним относятся «Бактиспо-рин», «Биоспорин», «Витаспорин», «Ветбакте-рин» и др. [3]. Эти пробиотики представляют собой различные штаммы живых бактерий Bacillus subtilis , подвергнутых либо лиофильному высушиванию и представляющие собой порошкообразную лекарственную форму, либо жидкую форму, являющуюся накопительной культуральной средой с микроорганизмами. Все они устойчивы к антибиотикам и обладают антагонистической активностью по отношению к энте-ропатогенным бактериям. Пробиотики применяют с целью восстановления микрофлоры желудочно-кишечного тракта при его дисфункциях различной этиологии и после применения антибиотиков. Кроме того, учеными разработаны споросодержащие пробиотики в виде мази для наружного применения для заживления ран («Биосептин»), а также пробиотики, применяемые для санации мест содержания животных («Субтилис») и коррекции микробиоценоза гениталий у коров («Сахабактисубтил»).
В своей работе [4], посвященной расшифровке геномных детерминант гидролиза крахмала у ряда микроорганизмов, авторы показали, что амилазная активность микробов является результатом сложного преобразования генетической программы клетки. При этом решающее значение для подтверждения способности того или иного микроорганизма расщеплять крахмал имеет значение не наличие гена α-амилазы в его геноме, а экспериментальное обнаружение амилазной активности. Данное наблюдение на- ходится в русле современной концепции [5] о приоритете функциональной активности белков над их генетической программой и обуславливает важность разработки экспресс-методов оценки экспрессии амилаз в микробных клетках.
Цель исследования: изучение сравнительной амилолитической активности у штаммов Bacillus subtilis как продуцентов амилаз при производстве сахаросодержащей кормовой добавки.
В задачи исследования входило: 1) изучение амилолитической активности у трех штаммов микроорганизма Bacillus subtilis : штамма № 2-amylolytic, штамма № 9-amylolytic и штамма № 12-amylolytic; 2) установление количества спор каждого штамма, дающего максимальный амилолитический эффект.
Материал и методы исследования. Экспериментальное исследование проведено в условиях научно-производственной лаборатории Института прикладной биотехнологии и ветеринарной медицины Красноярского ГАУ, а также в научно-исследовательском испытательном центре Красноярского ГАУ. Амилолитическую активность изучали у трех штаммов микроорганизма Bacillus subtilis : у штамма № 2-amylolytic, штамма № 9-amylolytic и штамма № 12-amylolytic. Микроорганизмы были выделены из предоставленного нами материала в ФГУП Гос-НИИгенетика (Москва) и приняты на национальное патентное депонирование во Всероссийскую коллекцию промышленных микроорганизмов (ВКПМ). Там же было установлено, что данные штаммы продуцируют амилолитический фермент, расщепляющий крахмал до глюкозы. Данные штаммы используются нами для получения сахаросодержащей кормовой добавки, которая содержит в своем составе до 70 % сахаров и предназначена для телят. Ее скармливание увеличивает привесы и повышает сохранность телят [6]. Лечебно-профилактический эффект обусловлен наличием в патоке обозначенных пробиотических штаммов Bacillus subtilis , которые обладают антагонистической активностью по отношению к ряду энтеропато-генных микроорганизмов [7].
Тест на продукцию штаммами амилазы проводили согласно методике, представленной в [8] в нашей модификации. Для этого готовили чашки Петри, в которые наливали горячую питательную среду, состоящую из 1,5 %-го агар-агара и 1 %-го крахмала. После застывания среды на ее поверхность наливали раствор Люголя. Среда при- обретала темно-синий цвет. Избыток раствора Люголя сливали, а после высыхания на поверхность среды накладывали 3 бумажных диска диаметром по 5 мм, на каждый диск накапывали по одной капле культуральной жидкости определенного штамма. Амилолитическую активность штаммов оценивали по величине диаметра зоны обесцвечивания йода вокруг бумажного диска. Чашки Петри на одни сутки помещали в термостат, в котором поддерживалась температура 39 ºС, на следующий день определяли диаметры зон обесцвечивания йода вокруг бумажных дисков. Параллельно ставили контрольную пробу, где вместо культуральной жидкости использовали дистиллированную воду.
Споры штаммов получали в условиях научнопроизводственной лаборатории кафедры. Определение количества спор каждого штамма, содержащихся в культуральных жидкостях, проводили согласно методике, изложенной в [9], с применением счетной камеры Горяева.
Для получения статистически достоверных результатов все исследования проводили с 3-кратной повторяемостью.
Микроскопию и фотографирование изучаемого материала проводили при помощи микроскопа МИКМЕД-6 с тринокулярной насадкой и цифрового фотоаппарата Canon-А520, имеющего программное обеспечение для компьютерной обработки получаемых изображений.
Для статистического анализа полученных данных использовали математические функции, заложенные в электронных таблицах Microsoft Excel. Различия между штаммами считались достоверными при р ≤ 5.
Результаты исследования. В контрольных чашках Петри вокруг капель дистиллированной воды не наблюдали зон обесцвечивания йода.
Данные по изучению амилолитической активности трех штаммов Bacillus subtili s представлены на рисунках 1, 2 и в таблице.
На рисунке 1 представлена чашка Петри, характеризующая амилолитическую активность у всех 3 штаммов Bacillus subtilis – штамма № 2-amylolytic, штамма № 9-amylolytic и штамма № 12-amylolytic. На плотную питательную среду, окрашенную йодом в синий цвет, помещены три бумажных диска, на каждый из которых были нанесены по одной капле культуральной жидкости определенного штамма, содержащей споры в количестве 125 000 спор/мл.
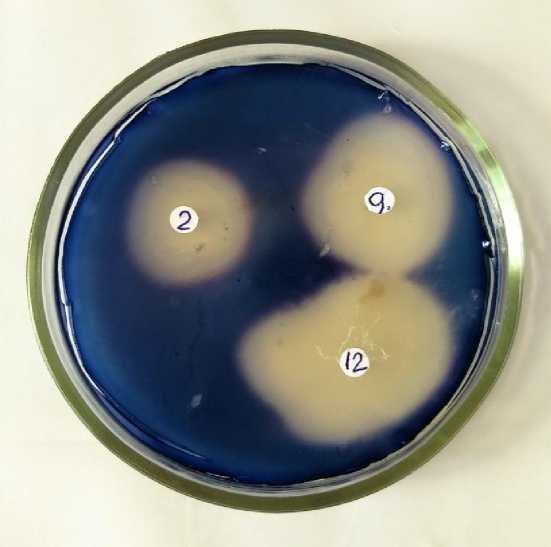
Рис. 1. Зоны обесцвечивания йода различными штаммами
Как видно из рисунка 1, зоны обесцвечивания йода у разных штаммов имели различный диаметр, что говорит о различной амилолитической активности фермента, продуцируемого каждым штаммом.
Результаты измерения диаметров зон обесцвечивания крахмала вокруг бумажных дисков в зависимости от количества спор Bacillus subtilis , содержащихся в культуральной жидкости, нанесенной на бумажные диски, представлены в таблице.
Размер диаметра зон обесцвечивания йода у разных штаммов, мм (M±m)
|
Кол-во внесенных спор (Mср) |
Диаметр зоны обесцвечивания йода |
||
|
№ 2-amylolytic |
№ 9-amylolytic |
№ 12-amylolytic |
|
|
50 000 спор/мл |
8±0,35 |
15±0,53 |
20±0,67 |
|
75 000 спор/мл |
17±0,30 |
24±0,50 |
31±0,60 |
|
100 000 спор/мл |
25±0,28 |
31±0,45 |
40±0,56 |
|
125 000 спор/мл |
29,5±0,20 |
37±0,35 |
46,3±0,40 |
|
150 000 спор/мл |
29,5±0,20 |
37±0,35 |
46,3±0,40 |
Из данных, представленных в таблице, видно, что максимальные зоны обесцвечивания йода были у всех изучаемых штаммов Bacillus subtilis при содержании в 1 мл культуральной жидкости 125 000 спор. При этом наибольший диаметр зоны обесцвечивания йода был у штамма № 12-amylolytic, он составил 46,3±0,40 мм, а наименьший – у штамма № 2-amylolytic (29,5±0,20). У штамма № 9-amylolytic диаметр зоны обесцвечи- вания йода составил 37±0,35 мм, что соответствует средней амилолитической активности.
Диаметр зоны обесцвечивания у всех трех штаммов зависел от количества спор, внесенных на бумажный диск. Зависимость диаметра зон обесцвечивания йода от количества спор, содержащихся в 1 мл культуральной жидкости, представлена на графике рисунка 2.
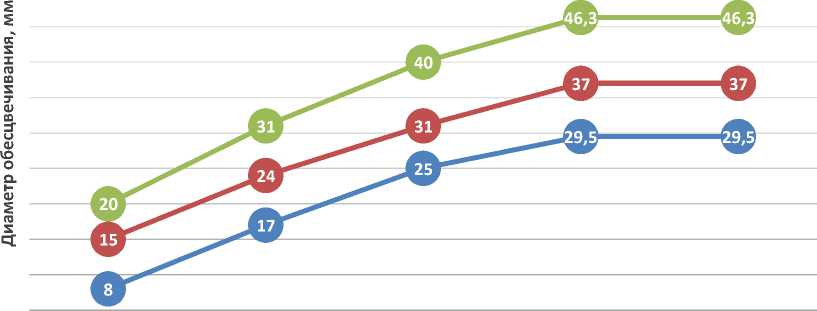
50 000 СПОР/МЛ 75 000 СПОР/МЛ 100 000 СПОР/МЛ 125 000 СПОР/МЛ 150 000 СПОР/МЛ
—•—Диаметр зон обесцвечивания йода, мм; ^^Диаметр зон обесцвечивания йода, мм;
■^«—Диаметр зон обесцвечивания йода, мм;
Рис. 2. Зависимость диаметра зон обесцвечивания йода от количества спор в 1 мл культуральной жидкости
Из графика, представленного на рисунке 2, следует, что с увеличением количества спор увеличивалась зона обесцвечивания йода.
Количество спор, дающее максимальные диаметры зон обесцвечивания йода, а значит и максимальный амилолитический эффект, у всех трех штаммов Bacillus subtilis было установлено в количестве 125 000 спор/мл, при этом с увеличением количества спор в культуральной жидкости с 50 000 спор/мл на каждые 25 000 спор/мл приводило к пропорциональному увеличению диаметра зон обесцвечивания йода у всех трех штаммов Bacillus subtilis : № 2-amylolytic, № 9-amylolytic, № 12-amylolytic. Увеличение количества вносимых спор свыше 125 000 спор на 1 мл не приводило к росту зоны обесцвечивания йода у всех исследуемых штаммов Bacillus subtilis .
Выводы. Сравнительный анализ трех исследуемых штаммов Bacillus subtilis показал, что они обладают различной амилолитической активностью. Наивысшей амилолитической активностью обладает штамм Bacillus subtilis № 12-amylolytic, средней – штамм Bacillus subtilis № 9-amylolytic и наименьшей – штамм Bacillus subtilis № 2-amylolytic.
Степень амилолитической активности зависит от количества спор в культуральной жидкости. Увеличение количества спор на каждые
25 000 спор/мл приводит к пропорциональному увеличению диаметра зон обесцвечивания йода у всех трех штаммов Bacillus subtilis: № 2- amylolytic, № 9-amylolytic, № 12-amylolytic. Количество спор, дающее максимальный амилолитический эффект, у всех трех исследуемых штаммов, составляет 125 000 спор/мл.
В качестве продуцента амилолитического фермента в технологии получения из крахмала сахаросодержащей кормовой добавки, предназначенной для телят, рекомендуется применение штамма Bacillus subtilis № 12-amylolytic с содержанием в культуральной жидкости не менее 125 000 спор/мл.
Список литературы Свойства штаммов Bacillus subtilis как продуцентов амилаз при производстве сахаросодержащей кормовой добавки
- Похиленко В.Д., Перелыгин В.В. Пробиотики на основе спорообразующих бактерий и их безопасность // Химическая и биологическая безопасность. 2007. № 2. С. 32-33.
- Нутрициологические, микробиологические, генетические и биохимические основы разработки и производства продуктов с пробиотиками: монография / И.С. Полянская [и др.]. Вологда-Молочное: Изд-во ВГМХА, 2013. 200 с.
- Овсянников Ю.С., Тихонов Г.И., Голунова О.В. Пробиотики в ветеринарии // Ветеринарная медицина. 2009. № 1-2. С. 66-68.
- Сравнительная характеристика амилолитической активности грамположительных бактерий / Н.Л. Бруслик [и др.] // Вестник ВГУ. Сер. Химия. Биология. Фармация, 2014. № 2. С. 47-51.
- Свердлов Е.Д. Микрокосм гена // Молекулярная биология. 1999. Т. 33. С. 917-940.
- Донкова Н.В., Донков С.А. Биотехнология получения легкоусвояемых сахаров из зерна для животноводства // Вестник КрасГАУ. 2018. № 1. С. 222-227.
- Донкова Н.В., Донков С.А. Изучение антагонистической активности амилолитических штаммов Bacillus subtilis // Международный вестник ветеринарии. 2016. № 2. С. 46-50.
- ОФС 42. Требования к штаммам микроорганизмов, используемые для производства пробиотиков для медицинского применения. URL: https://base.garant.ru/70457452/6aab82beaae3d4fd84e6a2f407788ed8 (дата обращения: 05.03.2020).
- ОФС.1.7.2.0008.15. Определение концентрации микробных клеток. URL: http://ivo.garant.ru/#/basesearch (дата обращения: 15.03.2020).


