Сывороточные уровни GM-CSF, CCL11, CCL22 и TRAIL у больных первичным инфарктом миокарда с подъемом сегмента ST и постинфарктное ремоделирование сердца
Автор: Николаева А. М., Кологривова И. В., Рябова Т. Р., Рябов В. В., Суслова Т. Е.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Цель: изучить сывороточные значения GM-CSF, TRAIL, CCL22, CCL11 у пациентов с первичным инфарктом миокарда с подъемом сегмента ST (ИМпST) в раннем и отдаленном постинфарктном периодах, а также исследовать их взаимосвязи с ремоделированием сердца через 12 мес. после ИМпST.Материал и методы. В исследование включены 84 пациента с ИМпST. Эхокардиография выполнена на 1-е сут и через 12 мес. после инфаркта миокарда (ИМ). Сывороточные уровни GM-GSF, CCL22, CCL11, TRAIL и CРБ, NT-proBNP, тропонина I, КФК МВ исследованы на 1-е (Т1) и 7-е сут (Т2) болезни, через 6 (T3) и 12 мес. (Т4). Через год в зависимости от типа ремоделирования выделено 2 группы пациентов: с дезадаптивным (1-я группа) и адаптивным (2-я группа) ремоделированием.Результаты. У пациентов 1-й группы маркеры повреждения миокарда (КФК МВ, тропонин I) в первые сут ИМ, а также NT-pro-BNP во всех точках исследования были достоверно выше, чем у больных 2-й группы, p
Инфаркт миокарда, постинфарктное ремоделирование сердца, хемокины
Короткий адрес: https://sciup.org/149142823
IDR: 149142823 | УДК: 616.127-005.8-021.3-06:616.124.2-008 | DOI: 10.29001/2073-8552-2023-38-2-104-113
Текст научной статьи Сывороточные уровни GM-CSF, CCL11, CCL22 и TRAIL у больных первичным инфарктом миокарда с подъемом сегмента ST и постинфарктное ремоделирование сердца
Актуальность
За последние 20 лет, благодаря внедрению в клиническую практику понятий и принципов доказательной медицины, повышению доступности своевременной высокотехнологичной помощи, госпитальная и 30-дневная летальность от всех причин острого инфаркта миокарда (ИМ) значимо снизилась [1]. Однако даже при полной ре- ализации всех условий, направленных на ограничение зоны инфаркта примерно у одной трети больных развивается патологическое (далее в тексте синонимы – неблагоприятное, дезадаптивное) ремоделирование сердца, являющееся основным предиктором развития сердечной недостаточности (СН), жизнеугрожающих нарушений ритма сердца и смертности [2, 3].
С другой стороны, объем инфаркта не является обязательным условием для развития и прогрессирования левожелудочкового ремоделирования (ЛЖР), что предполагает участие других факторов при постинфарктной восстановительной регенерации сердца [2]. Как бы это ни было парадоксально, процесс реперфузии миокарда может еще больше усиливать миокардиальное повреждение за счет микроваскулярной обструкции и воспаления [4]. Выраженность воспалительной реакции в ответ на ишемическое повреждение является одним из основных факторов в определении окончательного размера некроза ткани миокарда, степени постинфарктной дилатации ЛЖ, тяжести СН и прогноза жизни пациента [5].
Благодаря активному изучению на протяжении десятков лет механизмов хронического асептического воспаления при постинфарктном ремоделировании сердца, на сегодняшний день известно множество про- и противовоспалительных биомаркеров и клеток, показавших свое значение в прогрессировании дилатации ЛЖ. В частности, определена ключевая роль клеток гранулоцитарно-макрофагального ряда, фактора некроза опухоли α (TNFα), интерлейкина (IL)-1β, IL-1α, IL-6, IL-8 [6]. Однако сложности успешной трансляции экспериментальных данных в клиническую практику и амбивалентность результатов ранее проведенных исследований свидетельствуют о том, что знания об иммунных механизмах ремоделирования сердца раскрыты не полностью, и оно все еще остается актуальным исследовательским направлением [7].
Исходя из этого, необходимы дальнейший поиск и изучение новых биомаркеров, участвующих в совокупности с традиционными маркерами ИМ в определении характера воспаления и типа ЛЖР. Роль хемокинов при ИМ с подъемом сегмента ST (ИМпST) показана во многих исследованиях, но в немногих клинических исследованиях продемонстрирована их связь с неблагоприятным постинфарктным ремоделированием сердца. Наиболее изучаемыми новыми маркерами рассматриваются гранулоцитарно-макрофагальный фактор роста (GM-CSF), хемотаксический белок эозинофилов (CCL11), хемокин макрофагов (CCL22) и лиганд, индуцирующий апоптоз (TRAIL), показавшие в эксперименте свою провоспалительную активность и влияние на расширение зоны воспаления, некроза и систолическую дисфункцию сердца [8–11].
В настоящий момент времени высокопроизводительные лабораторные методы диагностики позволяют одновременно оценить комплекс различных биомаркеров в одном образце, что дает возможность изучить более широкий спектр показателей, отражающих степень иммунного воспаления и характер клеточных взаимодействий [12].
Цель исследования: изучение сывороточных уровней GM-CSF, TRAIL, CCL22, CCL11 с помощью мультиплексного иммуноанализа и определение их взаимосвязи с клинико-эхокардиографическими показателями в отдаленном постинфарктном периоде у пациентов с первичным ИМпST.
Материал и методы
В проспективное неконтролируемое исследование последовательно были включены 84 пациента с первичным ИМпST. Диагноз устанавливали в соответствии с четвертым универсальным определением острого ИМ (повышение уровня высокочувствительного тропонина I выше 99-го процентиля верхней границы нормы, элева- ция сегмента ST не менее чем в двух смежных отведениях, клинические симптомы острой ишемии миокарда) [13]. Всем пациентам через 240 (180–320) мин от манифестации симптомов выполнено чрескожное коронарное вмешательство с реваскуляризацией инфаркт-связанной артерии (ИСКА). Критерием включения в исследование являлся возраст пациентов, поступивших в блок интенсивной терапии в течение 24 ч от начала появления симптомов острой ишемии миокарда с диагнозом острый ИМпST, старше 18 лет. Критериями исключения из исследования считались тяжелые клапанные пороки, кардиогенный шок, терминальная стадия хронической почечной недостаточности (СКФ < 15 мл/мин), фибрилляция/ трепетания предсердий, постинфарктный кардиосклероз, время поступления в блок интенсивной терапии более 24 ч от начала появления симптомов болезни, выраженные когнитивные нарушения.
Работа была одобрена локальным этическим комитетом НИИ кардиологии Томского НИМЦ, всеми пациентами было подписано добровольное информированное согласие на участие в исследовании. Исследование зарегистрировано на сайте ClinicalTrial.gov с регистрационным номером NCT04296253. Дизайн клинического исследования представлен на рисунке 1.
Всем пациентам в 1-е сут болезни и через 12 мес. выполнена трансторакальная двухмерная (2D) и допплер-эхокардиография на сканере GE Vivid E9 c ЭКГ-синхронизацией и использованием матричного датчика с частотой 1,7–4,6 МГц (М5S). Все ультразвуковые изображения регистрировали как минимум в трех сердечных циклах, сохраняли на жесткий диск для последующего анализа. В режиме off-line оценивали показатели глобальной деформации ЛЖ в продольном (GLS), циркулярном (GCS) и радиальном (GRS) направлениях с помощью технологии speckle tracking echocardiography, используя soft-программы (Echopac PC, Version 113, GE Healthcare). Кроме того, проведена визуальная (полуколичественная) оценка нарушения локальной сократимости в 16 сегментах, расчет ударного объема ЛЖ в режиме импульсно-волнового допплера. Масса миокарда рассчитана линейным методом согласно рекомендациям ACE/EACI. Объемные параметры и фракция выброса (ФВ) ЛЖ оценены модифицированным методом Симпсона.
По приросту конечного диастолического объема (КДО) ЛЖ на > 15% [14] к 12-му мес. постинфарктного периода больные были разделены на две группы: с дезадаптив-ным (1-я группа; ЛЖР+) и адаптивным (2-я группа; ЛЖР-) ЛЖР.
В остром периоде ИМ (далее в тексте синоним – ранний постинфарктный период) и через 12 мес. всем больным проводилось рутинное лабораторное исследование общеклинического и биохимического анализов крови. Маркеры субклинического воспаления в раннем и отдаленном периодах ИМ исследованы у 60 (71,4%) пациентов. Забор крови проводили на 1-е и 7-е сут болезни, через 6 и 12 мес. после ИМ. В сыворотке крови определяли уровни пяти биомаркеров: GM-CSF, TRAIL, CCL11, CCL22 и натрийуретического пептида (NT-pro-BNP). Исследование биомаркеров проводили с использованием системы Multiplex Instrument FLEXMAP 3D (Luminex Corporation), диагностической панели MILLIPLEX map Human Cytokine/Chemokine Panel II и программного обеспечения MILLIPLEX Analyst 5.1 (MerckKGaA, Milliplex, Darmstadt, Germany).
Пациенты с ИМпST n = 84 Patients with STEMI
Оценка клинического течения ИМ
Забор крови для определения уровня биомаркеров TRAIL, GM-CSF, CCL11, CCL22, NT-pro-BNP, тропонина I, СРБ на 1-е, 7-е сут, через 6 и 12 мес. ИМ, 2D STE ЭхоКГ через 12 мес. после ИМ
Assessment of the clinical course of MI
Blood sampling to determine the level of biomarkers TRAIL, GM-CSF, CCL11, CCL22, NT-pro-BNP, CRP at 1th, 7th days of disease and after 6 and 12 month of MI 2D STE Echocardiography at 12 month MI
Неблагоприятное ремоделирование Adverse remodeling
Благоприятное ремоделирование Adaptive remodeling
Рис. 1. Дизайн исследования
Fig. 1. Study design
Примечание: ИМпST – инфаркт миокарда с подъемом сегмента ST, ИМ – инфаркта миокарда, СРБ – С-реактивный белок, TRAIL – лиганд, индуцирующий апоптоз, GM-CSF – гранулоцитарно-макрофагальный фактор роста, CCL11 – хемотаксический белок эозинофилов, CCL22 – хемокин макрофагов, NT-pro-BNP – натрий-уретический пептид, ЭхоКГ – эхокардиография.
Note: STEMI – ST-segment elevation myocardial infarction, MI – myocardial infarction, TRAIL – TNF related apoptosis-inducing ligand, GM-CSF – granulocyte-macrophage colony-stimulating factor, CCL11 – C-C motif chemokine ligand, eosinophil chemotactic protein, CCL22 – C-C motif chemokine ligand, macrophage chemokine, NT-pro-BNP – N-terminal pro brain natriuretic peptide, CRP – C-reactive peptide, STE – speckle tracking echocardiography.
Таблица 1. Основные клинико-демографические характеристики и лабораторно-инструментальные данные у пациентов с инфарктом миокарда с подъемом сегмента ST в раннем постинфарктном периоде
Table 1. Clinical and demographic characteristics, laboratory and instrumental data in patients with STEMI in the early post-MI period
|
Характеристики Characteristics |
Группа с ЛЖР- ( n = 44) Croup with LVR- ( n = 44) |
Группа ЛЖР+ ( n = 20) Croup with LVR- ( n = 20) |
P |
|
Клинико-демографическая характеристика пациентов |
|||
|
Clinical and demographic characteristic of patients |
|||
|
Возраст, лет / Age, years |
61,4 ± 11 |
58,7 ± 11,2 |
0,3 |
|
Мужской пол, n (%)/Male, n (%) |
25 (58) |
19 (95) |
0,003 |
|
Гипертония, n (%)/Hypertension, n (%) |
40 (93) |
18 (90) |
0,6 |
|
Сахарный диабет, n (%)/Diabetes mellitus, n (%) |
13 (30) |
4 (20) |
0,3 |
|
Курение (активное) , n (%)/Smoking, n (%) |
25 (61) |
11 (55) |
0,65 |
|
Дислипидемия, n (%)/Dyslipidemia, n (%) |
36 (84) |
17 (85) |
0,89 |
|
Индекс массы тела, кг/м2 / BMI, kg/m2 |
28,7 (26; 33,5) |
28,4 (24,7; 31,2) |
0,4 |
|
Общее время ишемии, мин / Total myocardial ischemic time, min |
232 (186; 315) |
209 (176,5; 267,5) |
0,24 |
|
Передний ИМ, n (%)/Anterior MI, n (%) |
19 (44) |
16 (80) |
0,014 |
|
Q – ИМ, n (%)/Q – MI, n (%) |
33 (77) |
20 (100) |
0,025 |
|
Многососудистое поражение КА, n (%)/Multivessel CAD, n (%) |
8 (40) |
7 (14) |
0,33 |
|
Данные общеклинического анализа крови в раннем постинфарктном периоде |
|||
|
Routine laboratory findings in the early post-infarction period |
|||
|
Лейкоциты, (1-е сут)/Leucocytes, (1st day) |
10,5 (8,2; 12,8) |
12.5 (9,4; 16) |
0,07 |
|
Нейтрофилы, % (1-е сут)/Neutrophils, % (1st day) |
64,5 (56,3; 73) |
75 (63; 81) |
0,009 |
|
Моноциты,% (1-е сут)/Monocytes,% (1st day) |
8,2 (6,2; 9,7) |
6 (5,3; 8,2) |
0,02 |
|
Моноциты,% (7-е сут)/Monocytes,% (7th day) |
9,9 (8,3; 12,1) |
9,6 (8,4; 10,8) |
0,6 |
|
Соотношение нейтрофилы/лимфоциты (1-е сут)/Neutrophils/lymphocytes |
2,5 (1,7; 3,7) |
4 (2,8; 6,4) |
0,009 |
|
ratio (1st day) |
|||
|
Эритроциты (1-е сут)/Erythrocytes (1st day) |
4.7 (4,4; 5,0) |
4,9 (4,7; 5,3) |
0,02 |
|
Гемоглобин, г/л (1-е сут)/Hemoglobin, g/l (1st day) |
141 (132; 152) |
150 (137; 160) |
0,05 |
|
Креатинин, мкмоль/л/Creatinine, µmol/l (1st day) |
88 (79; 98) |
102 (88; 121) |
0,01 |
|
Креатинин, мкмоль/л/Creatinine, µmol/l (7th day) |
88 (70; 100) |
103 (85; 120) |
0,01 |
|
АЛТ, ед/л (1-е сут)/ALT, u/l (1st day) |
30,5 (19,4; 53,4) |
70,1 (38; 101,7) |
0,001 |
|
АЛТ, ед/л (7-е сут)/ALT, u/l (7th day) |
40,3 (28,6; 62,6) |
64,9 (55,1; 84,1) |
0,001 |
|
АСТ, ед/л (1-е сут)/AST, u/l (1st day) |
52,3 (32; 130,3) |
240,5 (72,5; 509,5) |
0,001 |
|
АСТ, ед/л (7-е сут)/ AST, u/l (7th day) |
89 (59; 178) |
171 (76,2; 305,4) |
0,05 |
|
КФК МВ пиковое, ед/л/ CK-MV peak, u/l |
229 (170,9; 330) |
553 (456; 692) |
0,01 |
|
Тропонин I, нг/мл (1-е сут)/Troponin I, ng/ml (1st day) |
54,1 (18,3; 92,7) |
87,7 (56,5; 179,3) |
0,004 |
|
С-реактивный белок, мг/мл (1-е сут)/C-reactive protein, mg/ml (1st day) |
9,2 (2,9; 12,2) |
12 (8; 14,1) |
0,04 |
Примечание: ЛЖР – левожелудочковое ремоделирование, ИМ – инфаркт миокарда, КА – коронарные артерии, АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, КФК МВ – МВ-фракция креатинфосфокиназы.
Note: LVR – left ventricle remodeling, BMI – body mass index, MI – myocardial infarction, ALT – alanine aminotransferase, AST – aspartate aminotransferase, CK-MV – creatine kinase-MV.
При оценке медикаментозной терапии как в раннем, так и отдаленном постинфарктном периоде значимого различия в частоте применения препаратов, оказывающих влияние на процесс ремоделирования сердца, кроме антагонистов минералокортикоидных рецепторов ( p = 0,002), на амбулаторном этапе не было.
Анализ полученных данных проводили при помощи пакета STATISTICA 10.0. Полученные данные представлены в виде М ± SD , где М – среднее значение, SD – стандартное отклонение и Me ( Q 25– Q 75), где Me – медиана, Q 25 Q 75 – верхний и нижний квартили. Проверка нормал, ьности распределения количественных переменных осуществляли с помощью критерия Колмогорова – Смирнова. При отсутствии согласия с нормальным распределением, статистическую значимость различий количественных переменных в независимых группах оценивали с использованием критерия Манна – Уитни, а в случае нормального распределения использовали t -критерий Стьюдента для независимых групп. Категориальные переменные представляли абсолютными и относительными (в %) частотами, статистическую значимость различий между ними оценивали с помощью χ 2 -критерия Пирсона. Различия считали статистически значимыми при p < 0,05. Степень взаимосвязи между исследуемыми количественными переменными оценивали с помощью коэффициента корреляции Спирмена. Для определения предикторов развития позднего неблагоприятного ЛЖР была построена модель множественной линейной регрессии.
Результаты
Основные клинико-анамнестические характеристики пациентов и данные рутинных лабораторных исследований представлены в таблице 1. Количество лиц мужского пола, частота передней локализации и Q -образующего ИМ в 1-й группе были значимо больше, чем во 2-й. Достоверной разницы во времени реперфузии симптом-за-висимой артерии в группах не выявлено. У пациентов с неблагоприятным ремоделированием маркеры некроза миокарда в 1-е сут ИМ и маркер миокардиального стресса NT-pro-BNP на 1-е и 7-е сут, через 6 и 12 мес. были значимо выше (см. табл. 1, рис. 2).
NT-pro-BNP, пг/мл [pg/ml]
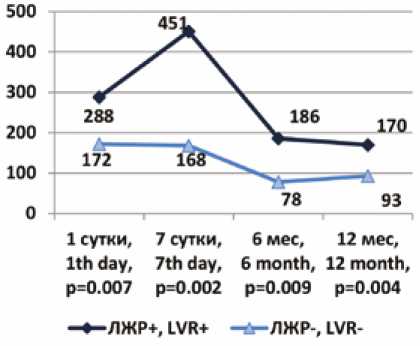
Рис. 2. Динамика NT-pro-BNP в сыворотке крови пациентов в ранние и отдаленные сроки инфаркта миокарда
Fig. 2. NT-pro-BNP dynamics in patients in the early and late post-MI period
В результатах рутинных лабораторных анализов у данной группы пациентов отмечены более высокие уровни гемоглобина, эритроцитов, лейкоцитов, нейтрофильно-лимфоцитарного соотношения и более низкие значения моноцитов в 1-е сут ИМ. При этом высокие показатели эритроцитов выявлены и к годовому визиту. Кроме того, на протяжении всего острого периода ИМ у больных 1-й группы были выше уровни печеночных трансаминаз и креатинина.
Годовой визит прошли 64 пациента (76%), из них ремоделирование по дезадаптивному варианту развилось у 20 больных (31%). Данные основных показателей эхокардиографии, выполненной через 12 мес. после индексного инфаркта миокарда представлены в таблице 2. У пациентов с дезадаптивным ремоделированием сердца были существенно больше индекс массы миокарда, объемные показатели ЛЖ: конечный систолический объем (КСО), КДО и их индексированные значения, хуже систолическая функция ЛЖ в виде низких значений ФВ ЛЖ, глобальной деформации ЛЖ в продольном, радиальном и циркулярном направлениях, а также большего значения индекса нарушения локальной сократимости. При этом достоверной разницы в параметрах насосной функции сердца не выявлено.
Таблица 2. Показатели эхокардиографии в отдаленном постинфарктном периоде
Table 2. Echocardiography parameters in the late post-MI period
|
Показатели Indicators |
Группа с ЛЖР-Group LVR-( n =44) |
Группа с ЛЖР+ Group LVR+ ( n =20) |
p |
|
КДО ЛЖ, мл / EDV LV, ml |
88,4 (73,6; 107) |
148,5 (123; 174,5) |
< 0,00001 |
|
КСО ЛЖ, мл/ ESV LV, ml |
31,5 (24,8; 44,5) |
80,4 (52,4; 98,3) |
< 0,00001 |
|
КДО/BSA, мл/м2/ EDV/BSA, ml/m2 |
47,5 (40; 55) |
75 (62,7; 87) |
< 0,00001 |
|
КСО/BSA, мл/м2/ EDV/BSA, ml/m2 |
17,5 (12,6; 22,5) |
37,4 (29,6; 48,5) |
< 0,00001 |
|
ФВ ЛЖ, %/ EF LV, % |
63 (56,1; 68,3) |
46,3 (41,5; 54,6) |
< 0,00001 |
|
ИНЛС/WMSI |
1,25 (1,06; 1,43) |
1,87 (1,62; 2,09) |
< 0,00001 |
|
GLS, % |
-17,2 (-18,7; -13,8) |
-10 (-13,5; -8,3) |
0,00006 |
|
GCS, % |
-12,4 (-14,7; -10,3) |
-10,6 (-12,5; -9) |
0,01 |
|
GRS, % ИММ, г/м2 / |
29,8 (22,9; 40,6) |
24,5 (20,2; 27,7) |
0,01 |
|
MMI, g/m2 УИ, мл/м2/ |
93,4 (81,4; 105,9) |
103,9 (95,2; 121,3) |
0,02 |
|
SI, ml/m2 |
33,5 (30; 37,2) |
32,5 (29,7; 42,9) |
0,8 |
|
СИ, л/м2/CI, l/m2 |
2,1 (1,9; 2,4) |
1,9 (1,7; 2,1) |
0,1 |
Примечание: ЛЖР – левожелудочковое ремоделирование, КДО – конечно-диастолический объем, КСО – конечно-систолический объем, ФВ – фракция выброса, ЛЖ – левый желудочек, BSA – площадь поверхности тела, ИНЛС – индекс нарушения локальной сократимости, ИММ – индекс массы миокарда, GLS – глобальная продольная деформация, GCS–глобальная циркулярная деформация, GRS– глобальная радиальная деформация, УИ – ударный индекс, СИ – сердечный индекс.
Note: LVR – left ventricle remodeling, EDV LV – end diastolic volume, ESV – end systolic volume, LV – left ventricle, BSA – body surface area, WMSI – wall motion systolic index, MMI – myocardial mass index, GLS – global longitudinal strain, GCS – global circular strain, GRS – global radial strain, SI – stroke index, CI – cardiac index.
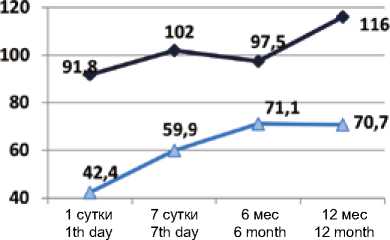
У всех пациентов как в раннем, так и в отдаленном периодах ИМ уровни всех исследованных провоспали-тельных цитокинов находились в пределах референсных значений. У больных с неблагоприятным ремоделированием сердца сывороточные уровни провоспалительного хемокина GM-CSF на 7-е сут, через 6 и 12 мес., а также цитокина TRAIL на 1-е сут и через 12 мес. были достоверно выше, чем у больных с адаптивным ЛЖР. Напротив, значения хемокинов CCL11 и CCL22 на 1-е, 7-е сут, через 6 мес., а также CCL22 через 12 мес. показали более низкие значения относительно 2-й группы. Кривые изменения средних значений во времени и уровни значимости их различий представлены в виде диаграмм на рисунках 3–6.
При проведении корреляционного анализа исследованные биомаркеры показали статистически значимую умеренной силы взаимосвязь друг с другом: GM-CSF с TRAIL, CCL22, а также ССL11 с CCL22 на 1-е и 7-е сут, 6-й мес. и 12-й мес. болезни. Кроме этого, изученные белки достоверно коррелировали с основными эхокардиографическими параметрами ЛЖ. Результат корреляционного анализа представлен в таблице 3.
GM-CSF, пг/мл [pg/ml]
TRAIL, пг/мл [pg/ml]
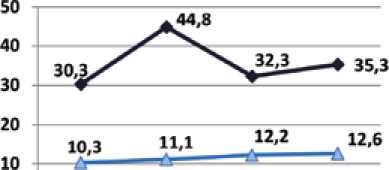
1 сутки 7 сутки 6 мес 12 мес 1th day 7th day 6 month 12 month p = 0,1 p = 0,005 p = 0,029 p = 0,01
p = 0,03 p = 0,06 p = 0,23 p = 0,01

Рис. 3. Динамика GM-CSF в сыворотке крови пациентов в ранние и отдаленные сроки инфаркта миокарда
Fig. 3. GM-CSF dynamics in patients in the early and late post-MI period
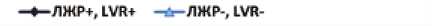
Рис. 4. Динамика TRAIL в сыворотке крови пациентов в ранние и отдаленные сроки инфаркта миокарда
Fig. 4. TRAIL dynamics in patients in the early and late post-MI period
CCL22, nr/мл [pg/ml]
CCL11, пг/мл [pg/ml]
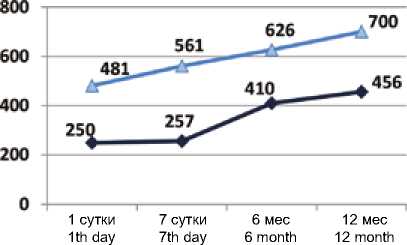
p = 0,001 p = 0,002 p = 0,015 p = 0,004
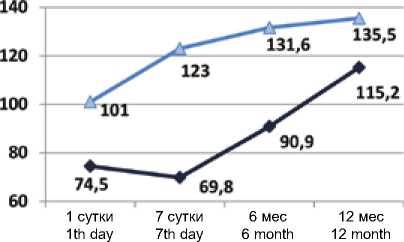
p = 0,02 p = 0,0001 p = 0,01 p = 0,11
-*-ЛЖР , LVR- -Р-ЛЖР+, LVR+
Рис. 6. Динамика CCL11 в сыворотке крови пациентов в ранние и отдаленные сроки инфаркта миокарда
Fig. 6. CCL11 dynamics in patients in the early and late post-MI period
Рис. 5. Динамика CCL22 в сыворотке крови пациентов в ранние и отдаленные сроки инфаркта миокарда
Fig. 5. CCL22 dynamics in patients in the early and late post-MI period
Таблица 3. Корреляционный анализ взаимосвязей сывороточных уровней цитокинов/хемокинов в разные временные точки с основными показателями эхокардиографии на 12-м месяце постинфарктного периода
Table 3. Correlation analysis of serum levels of cytokines/chemokines at different time points and main parameters of echocardiography at the 12th month of the post-MI period
|
Сывороточные уровни цитокинов/хемокинов в разные временные точки Serum levels of cytokines/chemokines at different time points |
КДИ ЛЖ EDV LV |
КСИ ЛЖ ESV LV |
ФВ ЛЖ EF LV |
GLS ЛЖ GLS LV |
|
TRAL 1 сут/1st day |
0,37 |
0,35 |
–0,28 |
0,44 |
|
TRAIL 12 мес./12 month |
0,13* |
0,09* |
–0,03* |
–0,18* |
|
GM-CSF 1 сут/1st day |
0,35 |
0,37 |
–0,32 |
0,38 |
|
GM-CSF 7 сут/7th day |
0,34 |
0,36 |
–0,33 |
0,42 |
|
GM-CSF 6 мес./6 month |
0,28 |
0,29 |
–0,22* |
0,30 |
|
GM-CSF 12 мес./12 month |
0,29 |
0,27 |
–0,20 |
0,36 |
|
CCL22 1 сут/1st day |
–0,39 |
–0,38 |
0,32 |
–0,36 |
|
CCL22 7 сут/7th day |
–0,42 |
–0,45 |
0,43 |
–0,51 |
|
ССL22 6 мес/6 month |
–0,33 |
–0,39 |
0,42 |
–0,46 |
Примечание: *– статистически незначимое значение, КДИ – конечно-диастолический индекс, КСИ – конечно-систолический индекс, ФВ – фракция выброса, ЛЖ – левый желудочек, TRAIL - лиганд, индуцирующий апоптоз, GM-CSF - гранулоцитарно-макрофагальный фактор роста, CCL11 - хемотаксический белок эозинофилов, CCL22 - хемокин макрофагов.
Note: *– statistically insignificant, EDV – end diastolic volume, ESV – end systolic volume, EF – ejection fraction, LV – left ventricle, GLS – global longitudinal strain, TRAIL – TNF related apoptosis-inducing ligand, GM-CSF – granulocyte-macrophage colony-stimulating factor, CCL11 – C-C motif chemokine ligand, eosinophil chemotactic protein, CCL22 – C-C motif chemokine ligand, macrophage chemokine.
С целью выявления наиболее значимых предикторов неблагоприятного ремоделирования в отдаленном постинфарктном периоде проведен множественный регрессионный анализ с пошаговым включением показателей уровня хемокинов, TRAIL, NT-pro-BNP в раннем постинфарктном периоде, пикового значения тропонина I и возраста пациентов. Полученная модель показала связь дилатации полости ЛЖ через год после первичного ИМ-пST с уровнем GM-CSF ( p = 0,004), NT-pro-BNP ( p = 0,009) на 7-е сут ИМ и возрастом ( p = 0,005). Результаты регрессионного анализа представлены в таблице 4.
Таблица 4. Модель множественного регрессионного анализа с включением показателей хемокинов, TRAIL, NT-pro-BNP в раннем постинфарктном периоде, тропонина и возраста больных
Table 4. Model of multiple regression analysis with the inclusion of chemokines, TRAIL, NT-pro-BNP in the early post-MI period, troponin and age of patients
|
Показатели Indicators |
β |
Т |
р |
|
GM-CSF 1-е сут/1st day |
–0,3 |
1,7 |
0,09 |
|
GM-CSF 7-е сут/7th day |
–0,53 |
–3,1 |
0,004 |
|
CCL22 1-е сут/1st day |
–0,1 |
–0,52 |
0,6 |
|
CCL22 7-е сут/7th day |
–0,09 |
–0,43 |
0,6 |
|
TRAIL 1-е сут/1st day |
–0,1 |
–0,79 |
0,4 |
|
NT-pro-BNP 1-е сут/1st day |
0,19 |
1,06 |
03 |
|
NT-pro-BNP 7-е сут/7th day |
0,57 |
28 |
0,009 |
|
Тропонин I пиковое/Troponin I peak, |
0,01 |
01 |
09 |
|
ng/ml |
–0,44 |
–3 |
0,005 |
|
Возраст/Age |
Обсуждение
Исследуемые группы по среднему возрасту и основным факторам риска сердечно-сосудистых заболеваний были сопоставимы, кроме гендерного соотношения в виде преобладания лиц мужского пола в группе деза-даптивного ЛЖР. Позднее постинфарктное ремоделирование сердца по дезадаптивному типу было ассоциировано с большим объемом ишемического повреждения миокарда и характеризовалось существенно высокими цифрами тропонина I, МВ КФК, NT-pro-BNP в 1-е сут ИМ и более выраженной системной воспалительной реакцией организма, что проявлялось лейкоцитозом, нейтрофиле-зом, повышением С-реактивного белка и нейтрофильно-лимфоцитарного соотношения. Связь перечисленных маркеров с неблагоприятным постинфарктным ремоделированием сердца ранее доказана результатами многих исследований [15]. Кроме этого, в течение первых 7 сут болезни у больных с патологическим ремоделированием сердца имела место более выраженная дисфункция внутренних органов, в частности, печени и почек, проявляющаяся значимо высокими цифрами печеночных трансаминаз и креатинина сыворотки. Последнее, вероятно, объясняется преобладанием у данной когорты больных более выраженных структурно-функциональных нарушений сердца с изменением внутрисердечной и системной гемодинамики с развитием ишемии внутренних органов.
В целях оценки цитокинового профиля у пациентов с ИМпST были выбраны и проанализированы сывороточные уровни следующих биомаркеров: GM-CSF, TRAIL, CCL22 и CCL11, место которых в патофизиологии постинфарктного ремоделирования сердца полностью не раскрыто. Изучение роли GM-CSF при ИМ и дезадаптив-ном ремоделировании сердца проводилось преимуще- ственно в эксперименте на модели животных. GM-CSF – провоспалительный цитокин, участвующий во многих клеточных процессах, основными из которых является активация и пролиферация миелоидных клеток, дифференцировка моноцитов в макрофаги и их поляризация по М1-фенотипу [10, 11]. При этом активированные GM-CSF макрофаги являются источником синтеза TNFα, IL-1,IL-1β, IL-23 и IL-12 [16].
Подобная нашим результатам связь данного провос-палительного цитокина со структурными изменениями сердца показана в работах зарубежных исследователей. Так, A. Anzai и соавт. (2017) на крысиной модели выявили ассоциацию GM-CSF с ухудшением процессов постишемической регенерации миокарда, дилатацией камер сердца и систолической дисфункцией ЛЖ вследствие увеличения макрофагальной инфильтрации в участке некроза [10]. Другими исследователями показано улучшение функции сердца в результате введения антител к GM-CSF и снижения количества активированных тканевых макрофагов [11]. На сегодняшний день данный биомаркер является одним из центральных цитокинов при COVID-19 и изучается в качестве потенциальной терапевтической мишени при данном заболевании в исследовании MASHCOVID-19 [16]. Последнее подтверждает мощные провоспалительные свойства GM-CSF.
Одним из недостаточно изученных маркеров при постишемическом ремоделировании сердца является представитель семейства фактора некроза опухоли – TRAIL. Cвязывание TRAIL с соответствующими рецепторами in vitro инициирует внутриклеточный сигнальный каскад каспазы-8, что запускает терминальную фазу апоптоза [8]. По последним данным на модели животных также показано как прямое повреждающее действие TRAIL на кардиомиоциты, так и опосредованное, через активацию рекрутирования лейкоцитов, миграции макрофагов, экспрессии и секреции провоспалительных цитокинов при реперфузионно-ишемическом повреждении миокарда и усиление интенсивности асептического воспаления в ин-фарцированном участке миокарда [9].
В нашей работе у пациентов с дезадаптивным ремоделированием сердца содержание TRAIL в сыворотке крови в течение первых 7 сут и через год было значимо выше по сравнению с больными с адаптивным ремоделированием ЛЖ. Была выявлена положительная корреляция TRAIL на 1-е сут ИМ с объемными параметрами, ФВ ЛЖ и глобальной деформацией миокарда в продольном направлении через год после индексного события. Однако в результатах ранее проведенных исследований демонстрируются данные, где показано, что, напротив, низкая концентрация TRAIL в сыворотке крови является предиктором неблагоприятного прогноза у лиц пожилого возраста с сердечно-сосудистыми заболеваниями [17], острым коронарным синдромом [8] и СН [18].
Некоторые авторы объясняют низкие значения TRAIL в крови у пациентов с более благоприятным течением болезни после перенесенного ИМ возможным протектив-ным действием данного цитокина на ткань сердца. Однако последнее противоречит повреждающему и проапоп-тотическому механизму действия цитокина в отношении клеток и тканей. Связь высокого уровня TRAIL и большего конечно-диастолического размера, низкой ФВ ЛЖ описывается у пациентов с неишемической кардиомиопатией [19]. Также в недавно опубликованной работе Y. Wang и соавт. (2020) выявлена ассоциация TRAIL с патологическим постинфарктным ремоделированием сердца на модели животных. Блокирование TRAIL предотвращало гибель кардиомиоцитов и воспаление, тем самым приводило к уменьшению зоны инфаркта [9].
В периферической крови концентрации CCL11 и CCL22 у пациентов с дезадаптивным ремоделированием сердца в раннем и отдаленном постинфарктном периодах были статистически значимо ниже. При этом достоверность разницы в уровне CCL22 наблюдалась и на 12-й мес. ИМ. Корреляция со структурно-функциональными параметрами ЛЖ как в раннем, так и в отдаленном периодах ИМ получена только c ССL22. Данный белок синтезируется преимущественно моноцитарными M2-макрофагами, способствует миграции и рекрутированию моноцитов в зоне воспаления. Также описано, что GM-CSF является ключевым индуктором синтеза CCL22 [20]. В исследованиях высокие сывороточные уровни CCL22 были выявлены у пациентов с прогрессирующим течением коронарной болезни сердца и у больных, имеющих факторы риска, ассоциированные с коронарной болезнью сердца: дислипидемию и ожирение [21]. В работе F. Noori и соавт. (2018) предполагается возможная связь полиморфизма генов CCL22 с увеличением риска ИМ [22]. Исследований, затрагивающих взаимосвязь CCL22 с ремоделированием ЛЖ, не найдено.
CCL11 секретируется в ответ на действие TNFα и IL-1β и, взаимодействуя с соответствующими рецепторами CCL11, стимулирует миграцию эозинофилов, Th2-клеток, нейтрофилов и макрофагов. Связь хемокина CCL11 установлена с такими клиническими состояниями, как бронхиальная астма, нейродегенеративные заболевания, онкологические и аутоиммунные заболевания [20].
Влияние CCL11 на течение ИМ на сегодняшний день изучено недостаточно, а исследования при патологическом ремоделировании сердца вовсе отсутствуют. В нашем исследовании у пациентов с дезадаптивным ремоделированием в раннем постинфарктном периоде и на 6-й мес. визита уровень CCL11 был достоверно ниже. При этом с 1-х по 7-е сут ИМ происходило снижение содержания CCL11, а затем постепенный рост его сывороточной концентрации к 6-му и 12-му мес. ИМ. При анализе литературы удалось найти лишь одну работу, в которой оценивается связь CCL11 с течением ИМ, осложненным кардиогенным шоком. Тем не менее, в исследовании показана подобная динамика изменения уровня CCL11 в раннем постинфарктном периоде [23].
Связь CCL11 c ССЗ также продемонстрирована у пациентов с ишемическим инсультом, где более низкое значение CCL11 обладало прогностическим значением более тяжелого течения инсульта и грубых функциональных нарушений в отдаленном периоде [24]. Снижение количества уровня CCL11 в периферической крови в 1-е сут ИМ может быть обусловлено мобилизацией хемокина из периферического русла в зону некроза. В последнее время предметом научного интереса являются эозинофилы при постинфарктном воспалении и репарации. В нескольких работах выявлена ассоциация низких значений эозинофилов в крови в 1-е сут ИМ с неблагоприятными исходами [25]. Иными словами, учитывая то, что CCL11 является основным хемоаттрактантом, участвующим в регуляции мобилизации и транспорта эозинофилов, его связь с процессами заживления ИМ может иметь большое значение.
Таким образом, принимая во внимание основные механизмы действия изученных биомаркеров, результаты настоящей работы не только подтверждают ключевое значение клеток гранулоцитарно-макрофагального ряда при постинфарктном воспалении миокарда, но и косвенно свидетельствуют о важной роли клеток микроокружения макрофагов, которые способствуют изменению их фенотипа и характера воспалительной реакции.
Учитывая, что GM-CSF оказался единственным цитокином в нашем исследовании, для которого была продемонстрирована взаимосвязь с дилатацией ЛЖ к 12-му мес. ИМ, его можно рассматривать как потенциальную терапевтическую мишень для предотвращения неблагоприятного постинфарктного ремоделирования миокарда. Однако следует проявлять осторожность в связи с важной ролью GM-CSF в поддержании мукозального иммунитета и возможностью тяжелых инфекционных осложнений, ассоциированных с его блокадой [26]. Противоречивые результаты исследований, в частности по цитокину TRAIL, свидетельствуют о необходимости дальнейшего изучения молекулярно-клеточного аспекта постинфарктного ремоделирования сердца.
Выводы
У больных с поздним дезадаптивным постинфарктным ЛЖР, наряду с высокими значениями кардиоспеци-фических ферментов, на протяжении всего периода наблюдения выявлены высокие уровни GM-CSF, TRAIL и низкие значения CCL11, CCL22.
В условиях множественного регрессионного анализа GM-CSF показал себя единственным воспалительным биомаркером, связанным с патологическим ремоделированием сердца, наряду с такими известными факторами, как уровень NT-pro-BNP и возраст.
Список литературы Сывороточные уровни GM-CSF, CCL11, CCL22 и TRAIL у больных первичным инфарктом миокарда с подъемом сегмента ST и постинфарктное ремоделирование сердца
- Szummer K., Wallentin L., Lindhagen L., Alfredsson J., Erlinge D., Held C. et al. Improved outcomes in patients with ST-elevation myocardial infarction during the last 20 years are related to implementation of evidence-based treatments: experiences from the SWEDEHEART registry 1995-2014. Eur. Heart J. 2017;38(41):3056-3065. https://doi.org/10.1093/eurheartj/ehx515.
- Westman P.C., Lipinski M.J., Luger D., Waksman R., Bonow R.O., Wu E. et al. Inflammation as a driver of adverse left ventricular remodeling after acute myocardial infarction. J. Am. Coll Cardiol. 2016;67(17):2050-2060. https://doi.org/10.1016/j.jacc.2016.01.073.
- Рябов В.В., Гомбожапова А.Э, Роговская Ю.В., Ребенкова М.С., Алексеева Я.В., Кжышковска Ю.Г. Воспаление как универсальное патогенетическое звено повреждения, репарации и регенерации при остром коронарном синдроме. От эксперимента к клинике. Кардиология. 2019;59(8S):15-23. https://doi.org/10.18087/cardio.2668.
- Алексеева Я.В., Вышлов Е.В, Павлюкова Е.Н., Усов В.Ю., Марков В.А., Рябов В.В. Влияние разных фенотипов микрососудистого повреждения миокарда на сократительную функцию левого желудочка у пациентов с инфарктом миокарда с подъемом сегмента ST. Кардиология. 2021;61(5):23-31. https://doi.org/10.18087/cardio.2021.5.n1500.
- Kologrivova I., Shtatolkina M., Suslova T., Ryabov V. Cells of the Immune System in Cardiac Remodeling: Main players in resolution of inflammation and repair after myocardial infarction. Front. Immunol. 2021;12:664457. https://doi.org/10.3389/fimmu.2021.664457.
- Ong S.-B., Hernandez-Resendiz S., Crespo-Avilan G.E., Mukhametshina R.T., Kwek X.Y., Cabrera-Fuentes H.A. et al. Inflammation following acute myocardial infarction: Multiple payers, dynamic roles, and novel therapeutic opportunities. Pharmacol. Ther. 2018;186:73-87. https://doi.org/10.1016/j.pharmthera.2018.01.001.
- Huang S., Frangogiannis N.G. Anti-inflammatory therapies in myocardial infarction: failures, hopes and challenges. Br. J. Pharmacol. 2018;175(9):1377-1400. https://doi.org/10.1111/bph.14155.
- Osmanchik P., Teringova E., Tousek P., Paulu P., Widimsky P. Prognostic value of TNF-related apoptosis inducing ligand (TRAIL) in acute coronary syndrome patients. PLoS One. 2013;8(2):e53860. https://doi.org/10.1371/journal.pone.0053860.
- Wang Y., Zhang H., Wang Z., Wei Y., Wang M., Liu M. et al. Blocking the death checkpoint protein TRAIL improves cardiac function after myocardial infarction in monkeys, pigs, and rats. Sci. Transl. Med. 2020;12(540):eaaw3172. https://doi.org/10.1126/scitranslmed.aaw3172.
- Anzai A., Choi J.L., He Sh., Fenn A.M., Nairz M., Rattik S. et al. The infarcted myocardium solicits GM-CSF for the detrimental oversupply of inflammatory leukocytes. J. Exp. Med. 2017;214(11):3293-3310. https://doi.org/10.1084/jem.20170689.
- Kellar R.S., Lancaster J.J., Thai H.M., Juneman E., Johnson N.M., Byrne H.G. et al. Antibody to granulocyte macrophage colony-stimulating factor reduces the number of activated tissue macrophages and improves left ventricular function after myocardial infarction in a rat coronary artery ligation model. J. Cardiovasc. Pharmacol. 2011;57(5):568-574. https://doi.org/10.1097/FJC.0b013e318213258b.
- Гусакова А.М., Суслова Т.Е, Рябов В.В., Керчева М.А. Использование мультиплексного анализа на платформе Luminex в комплексной оценке динамики сердечно-сосудистых биомаркеров у пациентов с острым инфарктом миокарда. Клиническая лабораторная диагностика. 2019;64(9).525-529. https://doi.org/10.18821/0869-2084-2019-64-9-525-529.
- Thygesen K., Alpert J.S., Jaffe A.S., Chaitman B.R., Bax J.J., Morrow D.A. et al. Fourth universal definition of myocardial infarction (2018). Eur. Heart J. 2019;40(3):237-269. https://doi.org/10.1093/eurheartj/ehy462.
- Reindl M., Reinstadler S.J., Tiller C., Feistritzer H.J., Kofler M., Brix A. et al. Prognosis-based definition of left ventricular remodeling after ST-elevation myocardial infarction. Eur. Radiol. 2019;29(5):2330-2339. https://doi.org/10.1007/s00330-018-5875-3.
- Berezin A.E., Berezin A.A. Adverse cardiac remodeling after acute myocardial infarction: old and new biomarkers. Dis. Markers. 2020:1215802. https://doi.org/10.1155/2020/1215802.
- Cremer P., Abbate A., Hudock K., McWilliams C., Mehta J., Chang S.Y. et al. Mavrilimumab in patients with severe COVID-19 pneumonia and systemic hyper inflammation (MASH-COVID): an investigator initiated, multicentre, double-blind, randomized, placebo-controlled trial. Lancet Rheumatol. 2021;3(6):e410-e418. https://doi.org/10.1016/S2665-9913(21)00070-9.
- Volpato S., Ferrucci L., Secchiero P., Corallini F., Zuliani G., Fellin R. et al. Association of tumor necrosis factor-related apoptosis-inducing ligand with total and cardiovascular mortality in older adults. Atherosclerosis. 2011;215(2):452-458. https://doi.org/10.1016/j.atherosclerosis.2010.11.004.
- Richter B., Koller L., Hohensinner P.J., Zorn G., Brekalo M., Berger R. et al. A multi-biomarker risk score improves prediction of long-term mortality in patients with advanced heart failure. Int. J. Cardiol. 2013;168(2):1251-1257. https://doi.org/10.1016/j.ijcard.2012.11.052.
- Lula J.F., Rocha M.O., Nunes M. do C., Ribeiro A.L., Teixeira M.M., Bahia M.T. et al. Plasma concentrations of tumor necrosis factor-alpha, tumor necrosis factor-related apoptosis-inducing ligand, and Fas Ligand/CD95L in patients with Chagas cardiomyopathy correlate with left ventricular dysfunction. Eur. J. Heart Fail. 2009;11(9):825-831. https://doi.org/10.1093/eurjhf/hfp105.
- Piseddu I., Rohrle N., Knott M.M.L., Moder S., Eiber S., Schnell K. et al. Constitutive expression of CCL22 is mediated by T cell-derived GM-CSF. J. Immunol. 2020;205(8):2056-2065. https://doi.org/10.4049/jimmunol.2000004.
- Safa A., Rashidinejad H.R., Khalili M., Dabiri S., Nemati M., Mohammadi M.M. et al. Higher circulating levels of chemokines CXCL10, CCL20 and CCL22 in patients with ischemic heart disease. Cytokine. 2016;83:147-157. https://doi.org/10.1016/j.cyto.2016.04.006.
- Noori F., Naeimi S., Zibaeenezhad M.J., Gharemirshamlu F.R. CCL22 and CCR4 gene polymorphisms in myocardial infarction: risk assessment of rs4359426 and rs2228428 in Iranian Population. Clin. Lab. 2018;64(6):907-913. https://doi.org/10.7754/Clin.Lab.2018.171106.
- Cuinet J., Garbagnati A., Rusca M., Yerly P., Schneider A.G., Kirsch M. et al. Cardiogenic shock elicits acute inflammation, delayed eosinophilia, and depletion of immune cells in most severe cases. Sci. Rep. 2020;10(1):7639. https://doi.org/10.1038/s41598-020-64702-0.
- Roy-O’Reilly M., Ritzel R.M., Conway S.E., Staff I., Fortunato G., McCullough L.D. CCL11 (Eotaxin-1) levels predict long-term functional outcomes in patients following ischemic stroke. Transl. Stroke Res. 2017;8(6):578-584. https://doi.org/10.1007/s12975-017-0545-3.
- Toor I.S., Rückerl D., Mair I., Ainsworth R., Meloni M., Spiroski A.M. et al. Eosinophil deficiency promotes aberrant repair and adverse remodeling following acute myocardial infarction. JACC Basic Transl. Sci. 2020;5(7):665-681. https://doi.org/10.1016/j.jacbts.2020.05.005.
- Mindur J.E., Swirski F.K. Growth factors as immunotherapeutic targets in cardiovascular disease. Arterioscler. Thromb. Vasc. Biol. 2019;39(7):1275-1287. https://doi.org/10.1161/ATVBAHA.119.311994.


