Таксономическая структура микробных сообществ в почвах различных типов по данным высокопроизводительного секвенирования библиотек гена 16S-рРНК
Автор: Чирак Е.Л., Першина Е.В., Дольник А.С., Кутовая О.В., Василенко Е.С., Когут Б.М., Мерзлякова Я.В., Андронов Е.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробиология почвы
Статья в выпуске: 3 т.48, 2013 года.
Бесплатный доступ
Особенности почвенного микробиома могут послужить универсальным и очень чувствительным индикатором состояния почвы, в том числе при оптимизации и биологизации систем земледелия. Однако для применения такого подхода необходимо предварительно изучить состав микробиомов, приуроченных к различным типам почв. Ранее подобные таксономические исследования представляли собой трудновыполнимую задачу и требовали больших материальных и временных затрат. С внедрением в молекулярную экологию методов секвенирования нового поколения стало возможным увеличить число не только выявляемых видов микроорганизмов, но и исследуемых местообитаний. Мы выполнили первичный анализ микробных сообществ с использованием пиросеквенирования почвенного метагенома. Для проведения исследования была создана коллекция почв, отобранных в различных регионах России (20 образов), а также в Крыму (Украина, 1 образец). В микробном сообществе доминировали бактерии из фил Proteobacteria (до 59,3 %), Actinobacteria (до 55,4 %), Acidobacteria (до 26,5 %), Verrucomicrobia (до 13,6 %), Bacteroidetes (до 10,5 %), Firmicutes (до 8,2 %), Gemmatimonadetes (до 6,9 %), Chloroflexi (до 5,7 %) и археи из филы Crenarchaeota. Сравнение таксономической структуры микробных сообществ указывает на то, что физико-химические факторы, такие как кислотность/щелочность и увлажненность территории, влияют на биоразнообразие прокариот в большей степени, чем другие (например, тип почвы или место отбора проб). Так, в почвах южных регионов, характеризующихся более низким гидротермическим коэффициентом (ГТК), отмечено преобладание актинобактерий, в то время как в северных почвах с высоким ГТК превалировали протеобактерии. Для почв с низким рН характерно увеличение доли ацидобактерий.
Почва, ампликонные библиотеки, 16s-ррнк, микробиом, таксономия
Короткий адрес: https://sciup.org/142133402
IDR: 142133402 | УДК: 631.417.2:579.64:579.8:577.21.06
Текст научной статьи Таксономическая структура микробных сообществ в почвах различных типов по данным высокопроизводительного секвенирования библиотек гена 16S-рРНК
До самых недавних пор определение таксономического состава микробного сообщества представляло собой трудноразрешимую задачу, требующую больших материальных и временных затрат. Трудоемкость процедур клонирования и последующего секвенирования нуклеотидных последовательностей ограничивала число не только выявляемых видов микроорганизмов, но и исследуемых местообитаний (1). Ситуация существенно изменилась с внедрением в молекулярную экологию методов нового поколения, в частности технологии пиросеквенирования (2, 3). Применение этих подходов повысило производительность секвенирования с сотен (метод Сэнджера) до нескольких тысяч нуклеотидных последовательностей, что способствовало максимально точному описанию даже таких сложных многокомпонентных систем, как почвенное микробное сообщество. В настоящее время реализуется несколько международных проектов, направленных на характеристику глобального микробного сообщества Земли. Один из них — Earth Microbiome Project , в рамках которого уже собрана информация о таксономической структуре микробиомов различных экологических ниш, полученная с использованием секвенаторов нового поколения. В рамках указанного проекта к настоящему времени проанализировано более 9000 образцов, или свыше 800 млн нук- леотидных последовательностей. Однако по России в упомянутой базе данных имеется лишь около десятка образцов, относящихся к вечной мерзлоте. Настоящая работа призвана восполнить существующий пробел. Поставленная задача особенно важна в связи с тем, что на территории России представлено фактически все известное почвенное разнообразие, и в этом отношении она может считаться одной из самых интересных экспериментальных площадок планеты. Кроме того, исследование почвенных микробиомов с использованием современных приемов секвенирования весьма перспективно с практической точки зрения, так как открывает возможности для создания совершенно новых подходов к оптимизации технологий земледелия. Основой таких подходов может стать использование особенностей почвенного микробиома как универсального и очень чувствительного индикатора состояния почвы.
Реализация подобных проектов должна начинаться с обзорного исследования почвенных микробиомов, приуроченных к различным типам почв. Именно эта цель была поставлена в нашем исследовании.
Методика . Для проведения экспериментов создали коллекцию проб, представляющих наиболее распространенные почвенные типы (всего 20 образцов). Пробы почвы отбирали в разных регионах России и в Украине в сентябре 2011 года, после чего образцы транспортировали в лабораторию, где хранили при - 70 ° C.
ДНК выделяли из 0,5 г замороженной почвы после механического разрушения с использованием стеклянных шариков в экстрагирующем буфере, состоящем из следующих компонентов: 350 мкл раствора А (натрийфосфатный буфер — 200 мM; изотиоцианат гуанидина — 240 мM; pH 7,0), 350 мкл раствора Б (Tрис-HCl — 500 мМ; SDS — 1 % по массе к объему; pH 7,0) и 400 мкл смеси фенола с хлороформом (1:1). Разрушение образца проводили в течение 1 мин при максимальной мощности на приборе FastPrep 24 (« MP Medicals», США ). Полученный препарат центрифугировали при максимальной скорости в течение 5 мин. Водную фазу отбирали и повторно экстрагировали хлороформом. ДНК осаждали, добавляя равный объем изопропилового спирта. После центрифугирования осадок промывали 70 % этанолом и растворяли в воде при 65 ° C в течении 5-10 мин. Очистку ДНК проводили с помощью электрофореза в 1 % агарозном геле с последующим выделением ДНК из геля методом сорбции на оксиде кремния (4, 5).
При конструировании и секвенировании ампликонных библиотек очищенный препарат ДНК (по 10-15 нг) использовался в качестве матрицы в реакции ПЦР (температурный профиль: 95 ° C — 30 с, 50 ° C — 30 с, 72 ° C — 30 с; всего 30 циклов) с добавлением полимеразы Encyclo («Евроген», Россия) и универсальных праймеров к вариабельному участку V4 гена 16S-рРHК — F515 (GTGCCAGCMGCCGCGGTAA) и R806 (GGACT-ACVSGGGTATCTAAT) (6). Кроме того, в праймеры вводили олигонуклео-тидные идентификаторы для каждой пробы (20 идентификаторов) и служебные последовательности, необходимые для пиросеквенирования по протоколу фирмы «Roche» (Швейцария). Подготовку проб и секвенирование выполняли на приборе GS Junior («Roche», Швейцария) согласно рекомендациям производителя.
Таксономический анализ нуклеотидных последовательностей ампликонных библиотек осуществляли с помощью программы QIIME (7). В процессе анализа выполнялись следующие действия: разделение библиотек по идентификаторам, проверка качества секвенирования и фильтрация нуклеотидных последовательностей, объединение последовательностей в операционные таксономические единицы (ОТЕ) с использованием 97 % порога сходства, выравнивание нуклеотидных последовательностей методом Uclust, построение матрицы генетических дистанций и филогенетического древа по методу Fasttree. Таксономическую идентификацию ОТЕ проводили с использованием банка данных RDP . На основе результатов анализа представленности ОТЕ в пробах рассчитывали индексы биоразнообразия Шеннона и Chaol: H = -Spilnpi (pi — доля i-го вида в сообществе), Sest(ChaoI) = Sobs + a2/2b (Sest — оцениваемое число ОТЕ, Sobs — наблюдаемое число ОТЕ, a — число ОТЕ, выявленных один раз, b — число ОТЕ, выявленных ровно два раза). Кроме того, выполняли тест Rarefaction, характеризующий динамику накопления ОТЕ в зависимости от числа секвенированных последовательностей, а также кластерный анализ образцов с применением метода UPGMA и определением значимости кластеров по алгоритму Bootstrap.
Результаты . Образцы почвы имели разное происхождение (табл. 1).
-
1. Коллекционное описание почвенных образцов, отобранных в разных географических точках (Россия, Украина; время отбора — сентябрь 2011 года)
Организация
Место отбора
№ пробы
Обозначение
Почвенный таксон
Биогеоценоз
Координа ты GPS
Прикаспийский Астраханская
19
BURSOL19 Бурая солонцева-Целина N 47’88'7.49"
НИИАЗ, г. Астрахань обл.
тая E 46’12'2.94"
Прикаспийский Астраханская
НИИАЗ, г. Астрахань обл.
37
SOLONC37 Солонец мелкий Целина N 47’88'5.07"
солончаковый E 46’12'6.01"
Воронежский НИИСХ Воронежская обл.
59
CHERNZ59 Чернозем типич- Залежь косимая N 51’09'16.24" ный E 40’47'09.08"
Воронежский НИИСХ Воронежская обл.
86
CHERNZ86 Лугово- Залежь с 1892 года N 51’09'16.24"
черноземная E 40’47'09.08"
Центральный музей Ленинград-почвоведения ская обл.
им. В.В. Докучаева, г. Санкт-Петербург
108
PODZOL108 Подзол Залежь N 60’32'33.45"
E 33’9'6.75"
ВНИИМЗ, г. Тверь, Тверская обл. агроландшафтный стационар «Губино»
124
PODZOL124 Дерново- Луг у леса N 56’46'25.38"
подзолистая E 36’04'50.61"
Ставропольский НИИСХ,Ставрополь-г. Михайловск ский край
187
CHERNZ187Чернозем обык- Целина N 56’25'24.40"
новенный E 59’06'40.25"
Татарский НИИСХ, Республика г. Казань Татарстан
195
SERLES195 Серая лесная Залежь N 55’40'15"
E 52’08'28"
Богдинская НИАГЛОС, Астраханская Харабалинский р-н обл.
202
POJMEN202 Пойменная аллю- Целина N 47’24'20.38"
виально-слоистая E 47’14'50.47"
Новосильская опытная Орловская станция, г. Мценск обл.
235
SERLES235 Серая лесная Луг N 53’17'
E 33’33'
ВНИИОУиУТ, Судо- Владимир-годский р-н ская обл.
253
PODZOL253 Дерново-сильно- Смешанный лес N 56’03'7'' подзолистая E 40’29'52"
ВНИИЗиЗПЭ, Курская обл.
г. Курск
279
CHERNZ279 Чернозем типич- Центрально-Черно- N 51’34'27.8" ный земный заповедик E 36’05'67.2"
им. В.В. Алехина
Клетский опытно- Волгоград-
овражный опорный ская обл.
пункт ВНИАЛМИ
294
KASHTM294 Темно- Целина N 49’13'29"
каштановая E 42’56'32"
ВНИАЛМИ, Волгоград-
г. Волгоград ская обл.
312
KASHSV312 Светло- Залежь N 48о38'49"
каштановая E 44о22'57"
Калмыцкая научно-ис- Республика следовательская лесная Калмыкия опытная станция
326
KASHSV326 Светло- Целина N 46’17'09"
каштановая со- E 44’15'11"
лонцеватая
ФГУП Котласское Архангель
ская обл.
345
SUGLSV345 Дерновая сугли- Залежь N 61’8'50"
нистая E 46’32'55"
ФГУП Холмогорское Архангельская обл.
357
ALLDER357 Аллювиальная Пойма, сенокос N 63’45'17"
дерновая Е 41’56'19"
ФГУП Архангельское Архангельская обл.
384
ALLDER384 Аллювиальная Центральная пой- N 64’30'13.0" дерновая ма, залежь, сенокосE 40’26'45.1"
КИАПП, Крым, Крым
пос. Клепинино
399
KRASZM399 Чернозем южный Целина N 45’32'21.74"
E 34’12'6.24"
Орловский ГАУ Орловская
обл.
404
SERLES404 Темно-серая Залежь N 52’59'34.94''
лесная E 36’0'29.92''
2. Число секвенированных последовательностей гена 16S-pPHK, операционных таксономических единиц
(ОТЕ)
и рассчитанные индексы биоразнообразия Шеннона и ChaoI для почвенных образцов из разных географических точек
(Россия, Украина)
Продолжение таблицы 1 Примечание. НИИАЗ — НИИ аридного земледелия, НИИСХ — НИИ сельского хозяйства, ВНИ-ИМЗ — Всероссийский НИИ сельскохозяйственного использования мелиорированных земель, НИА-ГЛОС — Научно-исследовательская агролесомелиоративная опытная станция, ВНИИОУиТ — Всероссийский НИИ органических удобрений и торфа, ВНИИЗиЗПЭ — Всероссийский НИИ земледелия и защиты почв от эрозии, ВНИАЛМИ — Всероссийский НИИ агролесомелиорации, КИАПП — Крымский институт агропромышленного производства, ГАУ — государственный аграрный университет.
Анализ нуклеотидных последовательностей. Используемые в работе праймеры были сконструированы на основе последовательностей гена 16S-рРHК как бактерий, так и архей, что позволяет проводить комплексный анализ прокариотного сообщества.
|
Образец |
Индекс Шеннона (H) |
Индекс ChaoI |
Число ОТЕ |
Секвенировано последовательностей |
|
BURSOL19 |
8,48 |
1841 |
740,8 |
3857 |
|
SOLONC37 |
8,70 |
2068 |
824,2 |
4435 |
|
CHERNZ59 |
8,61 |
2365 |
830,0 |
4594 |
|
CHERNZ86 |
8,37 |
1927 |
759,2 |
4433 |
|
PODZOL108 |
7,45 |
1193 |
513,6 |
4101 |
|
PODZOL124 |
8,87 |
1926 |
857,9 |
2011 |
|
CHERNZ187 |
8,28 |
1662 |
697,3 |
2181 |
|
SERLES195 |
8,50 |
1775 |
735,9 |
3952 |
|
POJMEN202 |
8,09 |
1735 |
681,1 |
3877 |
|
SERLES235 |
8,84 |
2289 |
844,6 |
4113 |
|
PODZOL253 |
8,15 |
1681 |
693,6 |
4113 |
|
CHERNZ279 |
8,12 |
1696 |
733,6 |
5010 |
|
KASHTM294 |
8,29 |
1954 |
725,7 |
4209 |
|
KASHSV312 |
6,42 |
848 |
469,6 |
5029 |
|
KASHSV326 |
8,25 |
2034 |
729,6 |
3935 |
|
SUGLSV345 |
9,18 |
3422 |
1010,3 |
5704 |
|
ALLDER357 |
8,68 |
2210 |
815,4 |
4124 |
|
ALLDER384 |
7,77 |
1139 |
565,5 |
2783 |
|
KRASZM399 |
7,47 |
1370 |
535,9 |
3218 |
|
SERLES404 |
8,62 |
2287 |
837,7 |
5089 |
Примечание. Число ОТЕ указано в расчете на 2011 сиквенсов.
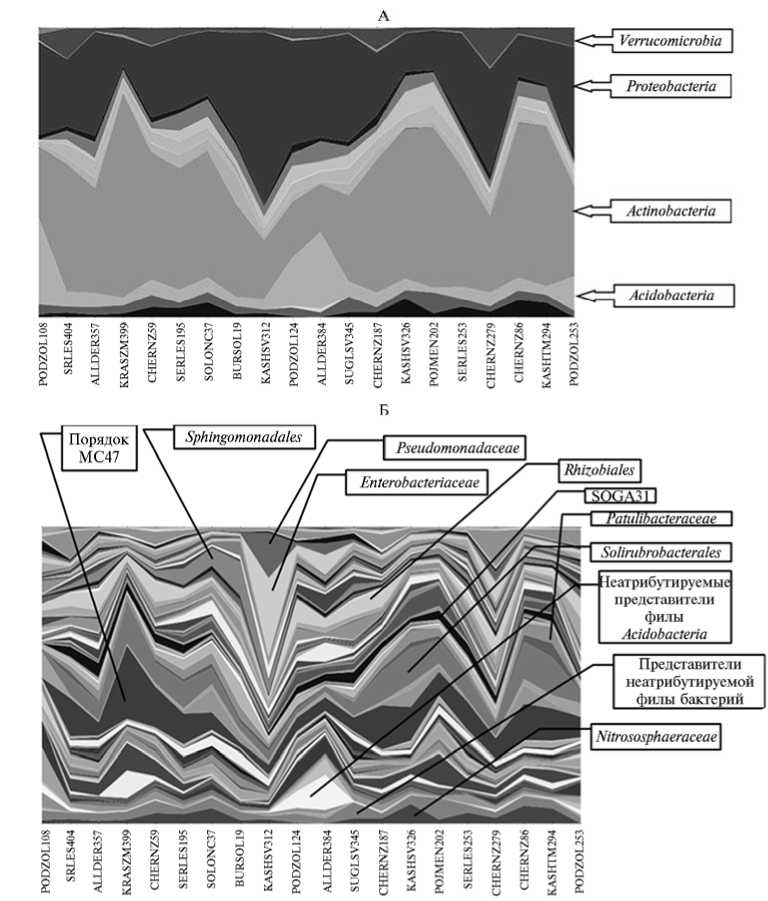
Всего было секвенировано 100 589 последовательностей, из которых после процедуры проверки качества (QALITY > 25) и фильтрации для дальнейшего анализа отобрали 62 977 последовательностей длиной 270 нуклеотидов. Число последовательностей в каждой пробе варьировало от 2011 до 5704 (в среднем 4059,5) (табл. 2). Общее число ОТЕ (последовательности гена 16S-рРHК, имеющие 97 % сходства, что примерно соответствует таксономической категории вида) в пробах составило 10 891. Их объединили в 42 филы (рис. 1, А, см. табл. 2) и 350 семейств (см. рис. 1, Б, табл. 2). Таксономическую принадлежность значительной части последовательностей не удалось установить как на уровне вида и рода, так и на более высоких таксономических уровнях, включая филы. Наличие неатрибутируемых (НА) последовательностей обусловлено неполнотой имеющихся баз данных и характерно для метагеномных исследований.
На уровне доменов преобладали бактерии (93,3-99,9 %), доля архей оказалась значительно ниже (от 0,01 % в пробе PODZOL253 до 6,7 % — в KASHSV326). В ряде образцов имелись нуклеотидные последовательности, не атрибутируемые на уровне домена. Качественный состав бактериальных и археотных фил был сходным для всех рассматриваемых образцов. Положение доминирующих групп бактерий занимали представители фил Proteobacteria (до 59,3 %), Actinobacteria (до 26,5 %), Verrucomicrobia (до 13,6 %), Bacteroidetes (до 10,5 %), Firmicutes (до 8,2 %), Gemmatimonadetes
Acidobacteria
Sphingomonadaks ]
Enterobacteriaceae
Порядо!
MC47
Actinobacteria
Ё § 5 8
5 2
Verrucomicrobia
Proteobacteria
Я
<
" | Pseudomonadaceae\
Solimbrobacterales |
Nitrososphaeraceae |
Представители неатрибутируемой филы бактерий
Д/ЩоТ/Т/ёП
I SOGA31 I
| | PatuUbacteraceae 1
5 £
8 Я |
3 i i
^атрибутируемые представители филы
Acidobacteria
Рис. 1. Представленность фил (А) и семейств (Б) микроорганизмов (по данным секвенирования последовательностей гена 16S-pPHK) в почвенных образцах из разных географических точек (Россия, Украина; отмечены соответственно преобладающие филы и семейства).
(до 6,9 %), Chloroflexi (до 5,7 %). Археи были представлены филой Crenar-chaeota . Подобное распределение весьма характерно для почвенных сообществ (8, 9). Решающую роль при сравнении таксономической структуры микробного сообщества в почвенных образцах играет соотношение бактериальных фил. Так, представители филы Actinobacteria заметно увеличивали численность в образцах KRASZM399, SOLONC37, KASHSV326, POJMEN202, CHERNZ86, KASHTM294 и KASHSV326. Все эти образцы были отобраны на территории южных регионов России и в Крыму (см. табл. 1, рис. 2), которые характеризуются наличием длительного засушливого периода. Поэтому доминирование актинобактерий в указанных образцах вполне объяснимо и может быть связано с их повышенной устойчивостью к низкому содержанию влаги в среде. Интересно, что в упомянутый список не попали еще два «южных» образца — KASHSV312 и CHERNZ279 (см. табл. 1, рис. 2), в которых актинобактерии оказались в значительной степени
На уровне семейств мы наблюдали крайне сложную структуру сообщества с отсутствием четко выраженных доминирующих групп бактерий. Такие группы появлялись лишь в ряде образцов: например, в образце KASHSV 312 значительно увеличилась численность семейств Enterobacteri-acea и Pseudomonadacea (соответственно 26,43 % и 15,11 %), в образцах PODZOL124 и ALLDER 384 возрастала доля не атрибутируемых на уровне семейства ацидобактерий, в образце KRASZM399 отмечалось повышение численности не атрибутируемых на уровне семейства бактерий из класса Actinobacteria (см. рис. 1, Б). И в то же время значительное число се- мейств бактерий были достаточно равномерно представлены во всех типах почв — прежде всего, это не атрибутируемые на уровне семейства бакте
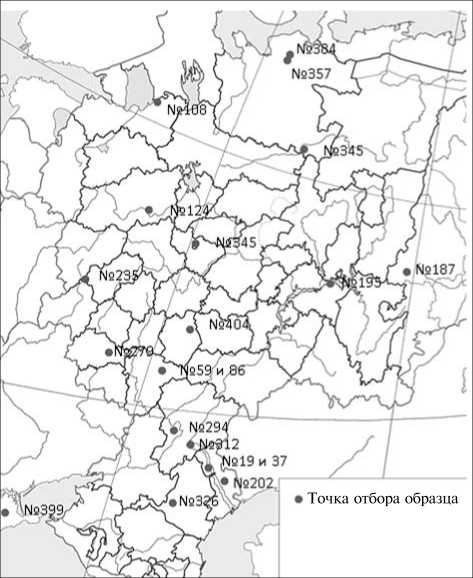
Рис. 2. Положение точек отбора изученных почвенных образцов в разных географических зонах (Россия, Украина) .
рии из порядка МС47 (Actinobacteria), семейства Solirubrobacteriaceae, Pa-tulibacteraceae из порядка Solirubrobacteriales (Actinobacteria ), различные семейства протеобактерий из порядков Rhizobiales и Sphin-gomonadales, а также семейства SOGA31 (Chloroflexi) и Gemmatimonadaceae (Gem-matimonadetes) (см. рис. 1, Б). Интересно, что похожий набор бактериальных семейств мы наблюдали при изучении засоленных почв Казахстана (12), о присутствии бактерий из ряда вышеупомянутых семейств в различных почвах также сообщают другие авторы (8). Описанная тенденция характерна и для архей: так, во всех почвах доминировали археи из семейства Ni-trososphaeraceae. Повсемест- ное присутствие микроорганизмов этой группы можно объяснить их активным участием в первых стадиях процесса нитрификации (13). Наличие таких бактериальных и археотных космополитов свидетельствует о присутствии в почве корового и акеессорного компонентов почвенного микробиома (по аналогии с коровым и аксессорным компонентами геномов микроорганизмов). Присутствие корового компонента еще раз указывает на высокую степень экологической пластичности почвенного сообщества, связанной как с адаптивными возможностями отдельных микроорганизмов, так и с «генетическим потенциалом» самой почвы, основанным, в частности, на поддержании в ней огромного пула внеклеточной ДНК (14).
Анализ a -разнообразия. Все изученные образцы подразделялись на три группы (рис. 3), причем в первую входил только один обра-
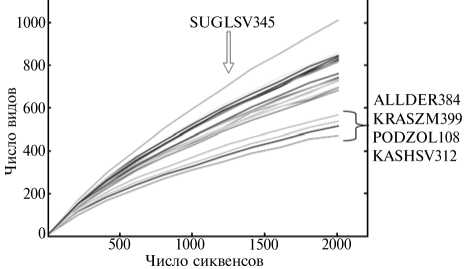
Рис. 3. Данные анализа a -разнообразия (по числу выявленных видов микроорганизмов) на основании результатов секвенирования последовательностей гена 168-рРНК в почвенных образцах из разных географических точек (России, Украина).
зец SUGLSV345 с наибольшим разнообразием по всем критериям, в среднюю — почти все оставшиеся образцы, в том числе все серые лес ные почвы и все черноземы (в основном представлены необрабатываемые
A
.CHERN Z86,
HERNZ18
рн
6.73
6.55
6.71
7,39
6.22
7,55
7,53
7.64
5,35
7.34
7,21
7.61
6.88
6.28
7,51
7.51
5,35"
6.00
5.34
4.10
Образец
KASHSV312
HERNZ27T
KASHTM294
KASHSV326
KRASZM399
ALLDER384
PODZOL124
PODZOL253
PODZOL108
SERLES195
ALLDER357
SUGLSV345 SERLES235 SOLONC37 BLRSOL19 POJMEN202 Б
Рис. 4. Данные анализа
в
-разнообразия
(на основании результатов секвенирования последовательностей гена 16S-pPHK) (А — дендрограмма родства, 1 — кластер 1; Б — двумерный график)
в почвенных образцах из разных географических точек
(Россия, Украина)
.
почвы, индекс Шеннона от 8,08 до 8,87) (см. табл. 2), и последнюю представляли образцы ALLDER384, KRASZM399, PODZOL108 и KASHSV312, в которых наблюдался сдвиг биоразнообразия в пользу одной из фил. В образцах ALLDER384 и PODZOL108 преобладали ацидобактерии, что, скорее всего, связано с повышенной кислотностью почвы. В образце KRASZM399 было выявлено максимальное число актинобактерий (70,48 % от общего числа бактерий). Образец KASHSV312 характеризовался наименьшим биоразнообразием: особенность этой почвы заключается в абсо- лютном преобладании в ней бактерий из филы Proteobacteria (см. рис. 1, А). Существует мнение, что доминирование протеобактерий типично для нарушенных почвенных местообитаний (15).
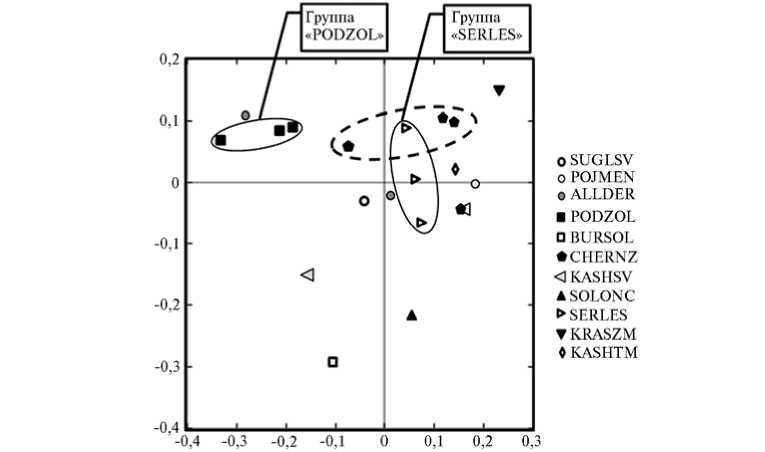
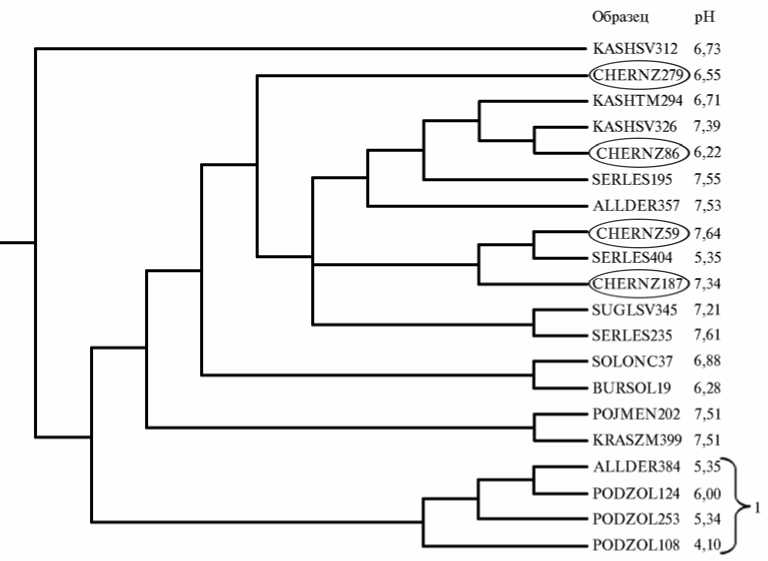
Анализ
в
-р а з н о о б р а з и я. Часть образцов группировались друг с другом в соответствии с типом почвы (PODZOL и SERLES) (рис. 4. Б), также сильной была тенденция в образовании кластеров в соответствии с определенными физико-химическими параметрами почвы, такими, например, как значения pH (см. рис. 4, А). В этой связи представляет интерес группа CHERNZ, в которой образцы с близким географическим положением (№ 59 и № 86) имели различную структуру микро биома (находились в разных кластерах), а два других образца, отобранных соответственно в южной и западной части страны (№ 59 и № 187), кластеризовались вместе (см. рис. 2, рис. 4, А). Вероятной причиной, определяющей в этом случае сходство или различие в структуре микробиомов, могут быть показатели рН — сходные (для образцов № 59 и № 187 рН соответственно 7,64 и 7,34) или, наоборот, различающиеся (для образцов № 59 и № 86 рН соответственно 7,64 и 6,22). Из приведенных фактов можно заключить, что на структуру микробиома оказывает воздействие не только (и не столько) тип почвы, сколько значения физико-химических показателей среды, в частности ее кислотность/щелочность. Полученный результат хорошо согласуется с данными ряда исследований, в которых авторам удалось показать, что pH среды — наиболее сильный, а иногда и единственный фактор, определяющий таксономический состав микробиома (16).
Таким образом, появление методов проточного секвенирования произвело существенный сдвиг в понимании истинных масштабов природного генетического разнообразия микробных сообществ и поставило перед почвенной микробиологией ряд принципиально новых научных проблем. В частности, по результатам проведенного нами исследования выявлена связь между абиотическими факторами (рН и увлажненность территории) и таксономическим составом микробного сообщества. Безусловно, для подтверждения обнаруженных закономерностей, а также включения в анализ всего спектра экологических факторов должны быть изучены несколько сотен образцов. Однако, как показали наши эксперименты, в состав почвенного микробиома входят сотни и даже тысячи видов, что затрудняет его анализ с использованием традиционных экологических подходов, а при большом числе тестируемых образцов делает его практически невозможным. Поэтому вместе с увеличением объемов выборки необходима разработка качественно новых методов анализа данных высокопроизводительного секвенирования, что позволило бы перейти от описательной экологии к функциональной. Очевидно, что требуется внедрение принципиально новых интегральных подходов, когда микробное сообщество рассматривается как некое функциональное единство, которое, с одной стороны, полностью зависит от условий среды, с другой — выступает основным фактором ее формирования.