Тактика ведения пациентов с псевдомиксомой брюшины при продолженном росте опухоли. Клиническое наблюдение
Автор: Абдуллаев Амир Гусейнович, Давыдов Михаил Михайлович, Козлов Николай Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.18, 2019 года.
Бесплатный доступ
Псевдомиксома брюшины представляет собой редкую разновидность перитонеального канцероматоза, обладает медленным ростjv и высокой частотой рецидивирования. Первичные хирургические вмешательства у больных с псевдомиксомой брюшины отличаются большим объемом и травматичностью, что ухудшает условия выполнения повторных операций и может повышать риск послеоперационных осложнений. Все перечисленное формирует проблему в выборе тактики лечения пациентов с рецидивной псевдомиксомой. Описание клинического случая. Пациентка 62 лет в ноябре 2006 г. впервые отметила появление болей внизу живота. При обследовании выявлена опухоль в проекции правых придатков. По месту жительства 28.12.06 выполнена экстирпация матки с придатками, аппендэктомия, резекция большого сальника; проведено 6 курсов химиотерапии (cap). В мае 2007 г. и июне 2009 г. проводились повторные циторедуктивные операции, 12 курсов полихимиотерапии. В 2012 г. в связи с рецидивом заболевания в НМИЦ онкологии им. Н.Н. Блохина выполнено комбинированное лечение: циторедуктивная операция в объеме удаления опухолевых узлов в правом и левом поддиафрагмальных пространствах с резекцией обоих куполов диафрагмы, спленэктомией, удалением оставшейся части большого сальника, а также гипертермическая интраперитонеальная химиоперфузия цисплатина. Непосредственных осложнений не отмечено. Через 14 мес при КТ и УЗИ выявлено прогрессирование. В 2013 г. была проведена попытка повторного хирургического вмешательства, при ревизии в брюшной полости обнаружен массивный спаечный процесс. Учитывая паллиативный характер вмешательства и высокий риск прогрессирования, объем операции ограничен биопсией опухоли. В дальнейшем было проведено 4 курса химиотерапии. На фоне лечения отмечен продолженный рост опухолевых узлов по брюшине с развитием частичной тонкокишечной непроходимости, которая не требовала экстренного вмешательства. В настоящее время, через 26 мес после комбинированного лечения, состояние пациентки удовлетворительное, без признаков кишечной непроходимости. Заключение. Выполнение повторных хирургических вмешательств при псевдомиксоме представляет собой достаточно сложную задачу в связи с тем, что при продолженном росте сложнее добиться оптимальной циторедукции. К основным условиям к повторному хирургическому вмешательству следует отнести исходный опти-мальный уровень циторедукции и длительный безрецидивный период.
Псевдомиксома брюшины, циторедукция, рецидив, интраперитонеальная химиоперфузия, химиотерапия, брюшная полость
Короткий адрес: https://sciup.org/140254031
IDR: 140254031 | УДК: 616.381-006.325.03-036.65-08 | DOI: 10.21294/1814-4861-2019-18-2-109-114
Текст научной статьи Тактика ведения пациентов с псевдомиксомой брюшины при продолженном росте опухоли. Клиническое наблюдение
Проблема продолженного роста опухоли при псевдомиксоме брюшины недостаточно освещена в мировой литературе, однако отмечается, что частота рецидивов достигает 80–90 % в сроки до 2 лет, даже после оптимальной циторедуктивной операции [1–3]. Известно, что псевдомиксома брюшины является разновидностью канцерома-тоза брюшины, сопровождающаяся выраженным слизеобразованием, и всегда является следствием распространения в просвет брюшной полости муцин-продуцирующей злокачественной опухоли. Степень дифференцировки и злокачественности псевдомиксомы может быть различной и определяется аналогичным показателем в первичном очаге [4–6]. Частая высокая дифференцировка опухоли (Low grade), низкая клеточность псевдомиксомы предопределяют резистентность к системной химиотерапии. С другой стороны, первичные хирургические вмешательства, выполняемые в специализированных медицинских учреждениях, отличаются большим объемом и травматичностью, что ухудшает условия выполнения повторных операций и теоретически повышает риск послеоперационных осложнений. Все перечисленное формирует проблему в выборе тактики лечения пациентов с псевдомиксомой при продолженном росте опухоли.
С 2010 по 2016 г. в торакальном отделении ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России повторные операции были выполнены у 11 из 43 пациентов с псевдомиксомой после ранее проведенных этапных циторедуктивных операций. Повторная интраперитонеальная химиоперфузия с гипертермией проведена у шести больных. Ниже приводим клиническое наблюдение успешного лечения рецидива болезни.
Описание клинического случая
Пациентка Р., 62 года. В ноябре 2006 г. больная впервые отметила появление болей внизу живота. При обследовании выявлена опухоль в проекции правых придатков, 28.12.06 по месту жительства
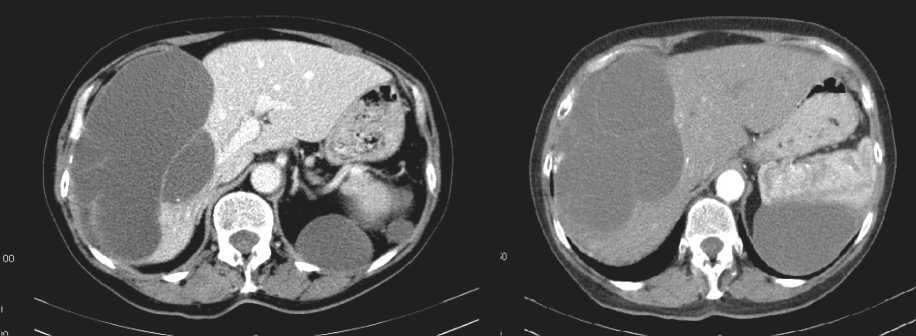
Рис. 1. КТ брюшной полости. Продолженный рост опухоли в правом поддиафрагмальном пространстве и у нижнего полюса селезенки, компрессия правой доли печени
выполнена экстирпация матки с придатками, аппендэктомия, резекция большого сальника. В последующем проведено 6 курсов химиотерапии (CAP). В мае 2007 г. и июне 2009 г. проводились повторные циторедуктивные операции, 12 курсов полихимиотерапии. При возобновлении роста опухоли больная обратилась в НМИЦ онкологии им. Н.Н. Блохина. При пересмотре гистологических препаратов в стенке аппендикса отмечены разрастания муцинозной опухоли низкой степени злокачественности, прорастающей всю толщу стенки отростка с формированием псевдомиксомы брюшины с поражением серозного покрова тела матки и яичника.
КТ органов брюшной полости (30.01.12): по брюшине определяются множественные опухолевые узлы пониженной плотности, по диафрагмальной поверхности правой доли печени размерами 17,5×10 см, по заднему контуру селезенки размерами 10,8×5,8 см, в правой подвздошной области размерами 8,7×6,0 см; печень не увеличена, плотность паренхимы в пределах нормы, структура однородная (рис. 1, 2).
Больной было выполнено комбинированное лечение (24.02.12): циторедуктивная операция в сочетании с гипертермической интраперитонеальной химиоперфузией. При интраоперационной ревизии (рис. 3–6): в брюшной полости массивный спаечный процесс с фиксацией тонкой и толстой кишки к париетальной и висцеральной брюшине.
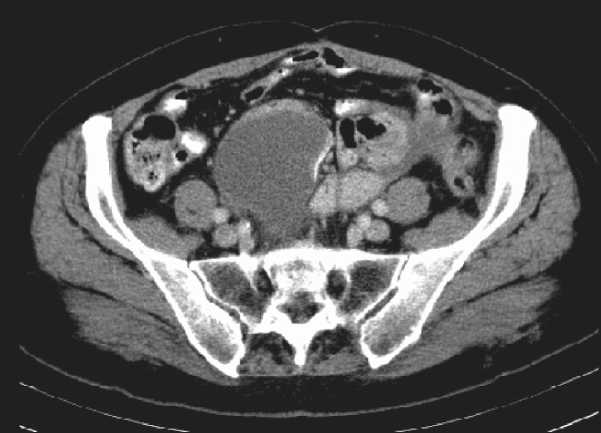
Рис. 2. КТ брюшной полости. Продолженный рост опухоли в малом тазу
Спайки частично рассечены острым путем. При дальнейшей ревизии правая доля печени сдавлена массивным опухолевым узлом до 20 см в диаметре, который плотно сращен с последней и правым куполом диафрагмы. Выполнена резекция правого купола диафрагмы в зоне врастания. Опухоль удалена с резекцией большой поясничной мышцы. Края диафрагмы ушиты отдельными узловыми швами. При дальнейшей ревизии отмечено, что селезенка спаяна с опухолевым узлом до 8–10 см в диаметре с врастанием в левый купол диафрагмы; желудочно-селезеночная связка инфильтрирована.
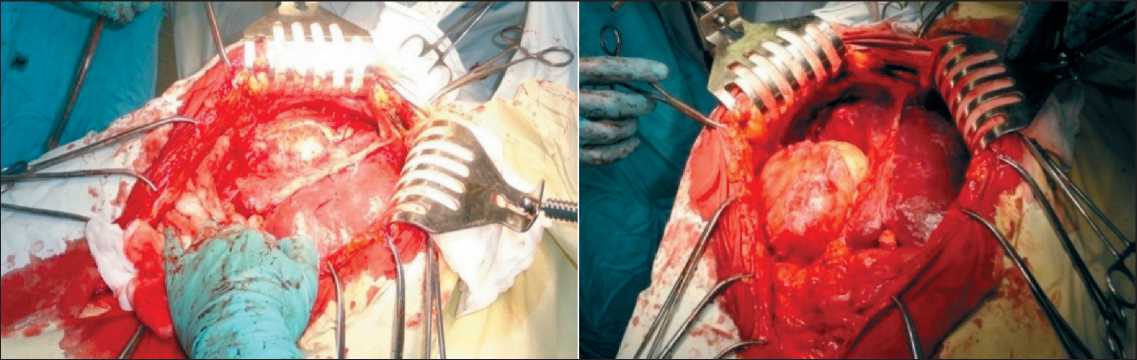
Рис. 3. Этапы операции. Удаление опухоли в правой поддиафрагмальной зоне
Дистальнее хвоста поджелудочной железы выделены, перевязаны и пересечены селезеночные сосуды. Выполнено удаление опухолевого узла с резекцией левого купола диафрагмы и спленэктомией. Края диафрагмы сведены и ушиты отдельными узловыми швами. Начата мобилизация опухолевого узла, располагающегося над входом в малый таз за
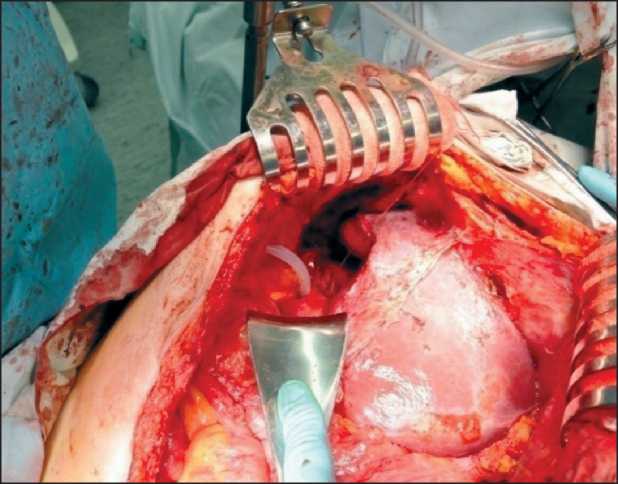
Рис. 4. Этапы операции. Удаление опухоли в правой поддиафрагмальной зоне брыжейкой тонкой кишки. В этой же зоне отмечается массивный спаечный процесс с фиксацией петель тонкой и сигмовидной кишки друг к другу, спайки местами хрящевой плотности. Выполнено удаление опухолевого узла с визуализацией пред-позвоночной фасции, правого мочеточника. Проведена гипертермическая интраперитонеальная химиотерапия в открытом контуре цисплатином в дозе 100 мг/м2, при температуре 43–44 °С в течение 60 мин. Непосредственных осложнений не отмечено. Осложнений хирургического лечения не было. Швы сняты на 11-е сут.
Морфологическое исследование операционного материала (№ 6404/2012): псевдомиксома брюшины с единичными пластами эпителия, состоящими преимущественно из бокаловидных клеток.
В последующем, через 14 мес после операции, при КТ и УЗИ продолженный рост опухоли. По данным КТ органов брюшной полости (21.02.13): вдоль левого латерального канала определяется узел пониженной плотности размером до 2,3×1,5 см, аналогичные узлы определяются в полости таза вдоль прямой и сигмовидной кишки (от уровня S1) 4,8×3,8 см, протяженностью до 6,3 см (рис. 7).
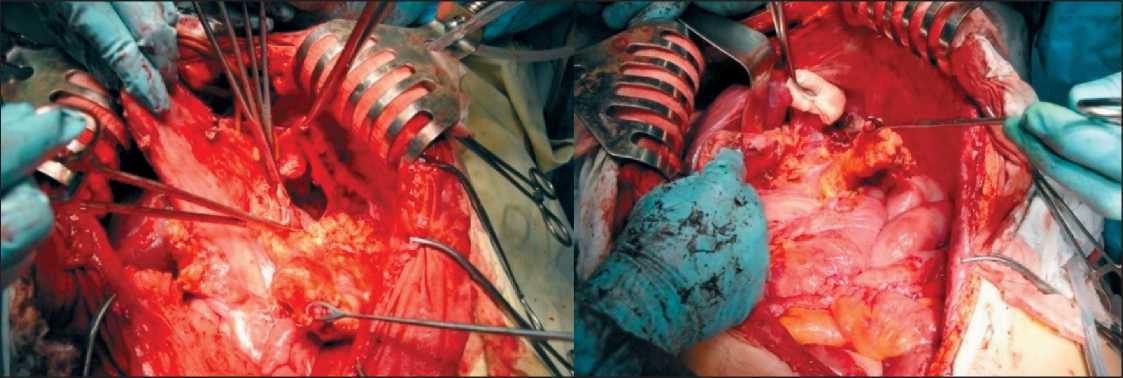
Рис. 5. Этапы операции. Спленэктомия, удаление опухоли в левой поддиафрагмальной зоне
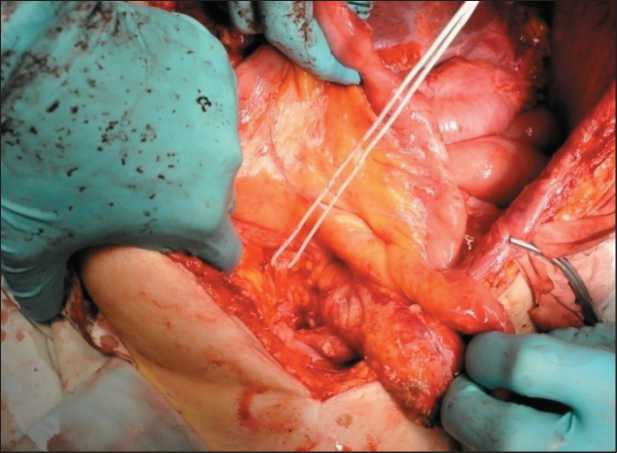
Рис. 6. Этапы операции. Мобилизация правого мочеточника в зоне рецидива опухоли в малом тазу
Была предпринята попытка повторного хирургического вмешательства (24.04.13): при интраоперационной ревизии в брюшной полости выявлен массивный спаечный процесс с фиксацией тонкой и толстой кишки к париетальной брюшине. В левой половине брюшной полости определяется конгломерат, состоящий из левой половины ободочной кишки, петель тощей кишки, опухолевых узлов, размером до 6 см; в корне брыжейки тонкой кишки, забрюшинно, над мысом крестца пальпируется опухолевый конгломерат, размером до 7–8 см; вдоль правой половины ободочной кишки выявляются отдельные опухолевые очаги, размером до 2–3 см. Учитывая паллиативный характер вмешательства, невозможность оптимального удаления опухоли, высокий риск последующего
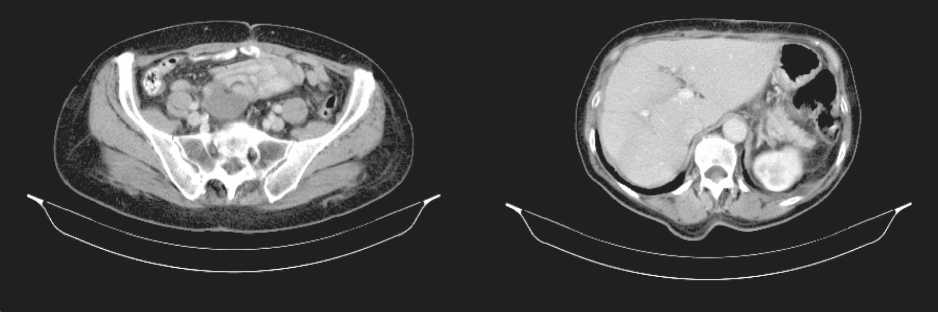
Рис. 7. КТ брюшной полости. Продолженный рост опухоли
прогрессирования, объем операции был ограничен биопсией.
В последующем проведено 4 курса химиотерапии по схеме XeLox: оксалиплатин – 130 мг/м2 в 1-й день внутривенно, кселода – 200 мг/м2 в сут. Однако на фоне лечения отмечен продолженный рост опухолевых узлов по брюшине с развитием частичной тонкокишечной непроходимости, которая не требовала экстренного вмешательства.
В настоящее время, через 26 мес после комбинированного лечения, пациентка жива, состояние относительно удовлетворительное. Признаков завершенной кишечной непроходимости нет.
Список литературы Тактика ведения пациентов с псевдомиксомой брюшины при продолженном росте опухоли. Клиническое наблюдение
- Deraco M., Baratti D., Inglese M.G., Allaria B., Andreola S., Gavazzi C., Kusamura S. Peritonectomy and intraperitoneal hyperthermic perfusion (IPHP): a strategy that has confirmed its efficacy in patients with pseudomyxoma peritonei. Ann Surg Oncol. 2004 Apr; 11 (4): 393-8. DOI: 10.1245/ASO.2004.07.002
- Bryant J., Clegg A.J., Sidhu M.K., Brodin H., Royle P., Davidson P. Systematic review of the Sugarbaker procedure for pseudomyxoma peritonei. Br J Surg. 2005 Feb; 92 (2): 153-8. DOI: 10.1002/bjs.4862
- Smeenk R.M., Verwaal V.J., Antonini N., Zoetmulder F.A. Progression of Pseudomyxoma Peritonei after Combined Modality Treatment: Management and Outcome. Ann Surg Oncol. 2007; 14 (2): 493-499. DOI: 10.1245/s10434-006-9174-x
- Misdraji J., Yantiss R.K., Graeme-Cook F.M., Balis U.J., Young R.H. Appendiceal mucinous neoplasms: a clinicopathologic analysis of 107 cases. Am J Surg Pathol. 2003; 27 (8): 1089-1103.
- Moran B.J., Cecil T.D. The etiology, clinical presentation, and management of pseudomyxoma peritonei. Surg Oncol Clin N Am. 2003 Jul; 12 (3): 585-603.
- Nakakura E.K. Pseudomyxoma peritonei: more questions than answers. J Clin Oncol. 2012 Jul 10; 30 (20): 2429-30. DOI: 10.1200/JCO.2012.42.3764


