Температурные условия начала формирования шлаковых отложений при их факельном сжигании
Автор: Гладков В.Е., Афлятунов Ж.З., Викторов В.В.
Рубрика: Химия
Статья в выпуске: 7 (62), 2006 года.
Бесплатный доступ
Представлены результаты физико-химического анализа процессов взаимодействия и фазообразования в минеральной части углей, определяющих агрегатное состояние аэродинамического золового потока несущих дымовых газов с t ≤ 1300 °С. Показано, что температура несущих дымовых газов, при которой формируются шлаковые отложения и условия закрепления (налипания) золовых частиц, связана с температурным интервалом существования жидкой фазы, образующейся при взаимодействии сульфидного и силикатного расплавов.
Короткий адрес: https://sciup.org/147158498
IDR: 147158498 | УДК: 541.1
Текст краткого сообщения Температурные условия начала формирования шлаковых отложений при их факельном сжигании
Температура начала шлакования - основной экспериментально определяемый параметр, используемый для обеспечения бесшлаковочного режима при факельном сжигании углей. В практике за температуру начала шлакования принимают температуру несущих газов аэродинамического эолового потока, при которой на неохлаждаемом металлическом зонде формируются шлаковые отложения, валовый химический состав которых соответствует таковому для летучей золы и близок к составу золы исходного угля.
Основываясь на статистической обработке результатов систематического прогнозирования температуры начала шлакования (?ш) при факельном сжигании углей с кислым составом золы предложено эмпирическое уравнение [1]:
^=930+11^ (±19 °C), (1)
где С^к = %Al2O3+%SiO2+%TiO2, a C^o=%CaO+%Na2O+%K2O+%MgO. Суммарное содержание кислых (УС) и основных (£0) оксидов (мол.%) в валовом составе золы исходного угля, пересчитанного на бессульфатную массу и определяемого из равенства:
Су< + CZ° + СРе2О3 = 10°0//° ■ (2)
Из (1) и (2) следует, что содержание Fe2O3 в составе золы углей при аппроксимации экспериментальных результатов не учитывали. Такое положение авторы [1] объясняют амфотерностью оксидов железа (Fe2O3 - кислый, FeO - основной), а их концентрационное соотношение, определяемое пирометрическим уровнем сжигания, коэффициентом избытка воздуха и исходным составом минеральной части, однозначно не установлено. Однако это не является основанием для исключения роли оксидов железа на температуру начала шлакования и условия формирования шлаковых отложений. Уравнение (1) с учетом (2) сводится к виду:
,ш=920+-1!-а-Сг=2Оз). (3)
Из соотношения (3) следует, что для золы углей, у которых содержание основных оксидов одинаковое, температура начала шлакования тем меньше, чем больше СрегОз. Поскольку среднее содержание оксида железа в составе золы анализируемых в [1] углей составляет величину Сре2о3 ~ 0,038, то её влиянием можно пренебречь и для аппроксимации принять уравнение
/ш= 920+ ^(±20 °C), (4)
описывающее экспериментальные результаты с такой же точностью, как и уравнения (1) и (3).
Для специалистов по факельному сжиганию энергетических углей в России и странах СНГ уравнение (1) является фундаментальным для прогнозирования 1щ и шлакующих свойств золы в целом. Однако до настоящего времени анализа физико-химического смысла зависимости /ш от состава выражаемого через соотношение С-^к /С^о и, в итоге, определяющего агрегатное состояние золовых частиц и условия их закрепления (налипания) в момент формирования отложений, не проводилось. В ряде работ неоднократно отмечено только то, что величина температуры начала шлакования, устанавливаемая в условиях факельного сжигания меньше (на 150-200 °C) температур, определяемых в лабораторных условиях по деформационным характеристикам образцов золы (плавкость по методу пирометрических конусов, спекаемость и др.) [1-3]. Такое несоответствие связано с тем, что температуры сравнения, определяемые по резким изменениям в ходе зависимостей «деформация - температура», регистрируемых при скоростях нагрева менее 0,3 °С/с, отвечают образованию в составе образцов равновесной жидкой фазы. Её появление и увеличение количества с ростом температуры связано с последовательностью плавления эвтектических составов, реализующихся в многокомпонентной системе из кислых и основных оксидов в валовом составе золы, пересчитанном на бессульфатную массу.
В реальных условиях факельного сжигания сульфидная и органическая сера является неотъемлемым компонентом в процессах взаимодействия железосодержащих минералов с силикатными. В [4] показано, что с увеличением скорости нагрева до 1,1-1,8 °С/с деформация образцов золы резко возрастает, и на кривых её зависимости от температуры появляются максимумы, связанные с расслоением образующегося расплава на две жидкие фазы: сульфидную (FeS-FeO) и силикатную. При этом скорость деформации образцов характеризуется наличием максимумов, температуры которых хорошо согласуются с температурой начала шлакования, определенной в промышленных условиях. В связи с этим считаем целесообразным провести сопоставление температурных интервалов устойчивости сульфидно-силикатного расплава с результатами систематических исследований температуры начала шлакования в [1].
Появление максимумов на зависимостях «скорость деформации - температура» связано с взаимодействием кислых и основных оксидов с расплавом эвтектического состава FeS-FeO, образующегося при / > 920 °C. В процессах взаимодействия изменяется количество сульфидного расплава за счет его эвакуации из объема образцов и окисления FeS и FeO до оксидов РезО4 и РегОз. Начало эвакуации из золы кислого состава в интервале 6 < С^ /С^о < 20 наблюдали [4] при температурах, соответствующих максимуму скорости деформации по появлению пятна на
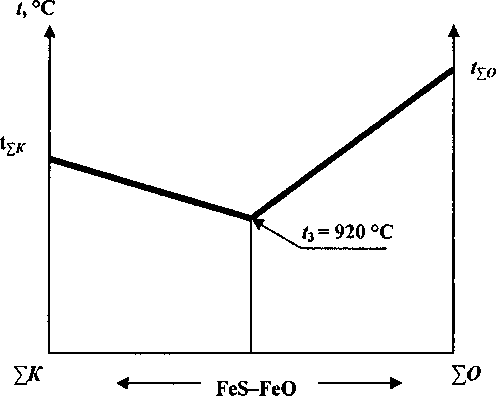
Псевдобинарная диаграмма, иллюстрирующая взаимодействие эвтектических составов подложках и сильного приваривания к ним образцов. Полное расслоение расплава в составе образцов происходило при более высокой температуре, отвечающей началу расширения (вспучивания) образцов за счет выделения газов, образующихся при окислении FeS.
Зависимость скорости деформации от температуры для образцов золы основного состава (С^к/С-^о < б ) также характеризуется наличием максимума, но эвакуации сульфидного расплава (появление пятна на подложках) не наблюдали [4]. Вспучивание образцов с ростом температуры не происходило.
Различное дилатометрическое поведение образцов и их взаимодействие с подложкой связано с противоположным влиянием кислых и основных оксидов на устойчивость FeS и FeO в составе образующегося расплава в объеме образцов, которое можно описать с помощью квазибинарной диаграммы (см. рисунок). Растворение только кислых оксидов в составе расплава эвтектического состава (FeS-FeO) приводит к улучшению условий десульфации [5]. Мольная доля серы в расплаве уменьшается, а, следовательно, уменьшается концентрация FeS в его составе. Напротив, с увеличением содержания кислых оксидов устойчивость FeO в составе расплава увеличивается. Следовательно, температура ликвидуса расплава по мере растворения кислых оксидов и десульфации будет повышаться и стремиться к температуре /^, соответствующей температуре эвтектики, реализующейся в системе FeO- SiO- А12О3 [9].
При растворении только основных оксидов мольная доля серы в составе образующегося расплава хотя и возрастает, но мольная доля двухвалентного железа очень резко снижается [5], а следовательно, уменьшается концентрация FeS и FeO. В связи с этим по мере растворения основных оксидов температура ликвидуса образующегося расплава будет возрастать более круто и стремиться к температуре плавления эвтектики ^0, реализующейся в системе £О-Ре2Оз.
В процессе совместного растворения основные оксиды поставляют ионы кислорода, а кислые их потребляют. В таком представлении на диаграмме EA7^O-(FeS-FeO)] температура ликвидуса образующегося расплава согласно [6] слабо зависит от природы химических элементов, а определяется только концентрацией ионов кислорода, вносимых основными оксидами при их растворении. Для такой системы связь между инвариантными точками и составом согласно теплового баланса для одного моля расплава можно определить из равенства [7]:
где Q - долевые теплосодержания кислых и основных оксидов в составе сульфидно-силикатного расплава при температурах плавления /э (920 °C) - эвтектики FeS-FeO; t^ - кислых и tw - ос новных оксидов. После подстановки в (5) долевых теплосодержаний, выраженных через теплоёмкость и концентрацию, и соответствующих преобразований получаем:
С^о
J Ср^
J Cp^KdT
Принимая независимость теплоемкости кислых и основных оксидов от температуры и учитывая, что Ср^Ср^о ~ 1, получим тождество:
С^к , (7)
с^о ^к-1э решение которого относительно t^o с учетом, что t3 = 920 °C, приводит к уравнению
/уо=920 + ^-920)-Д
описывающему зависимость температуры ликвидуса сульфидно-силикатного расплава от его химического состава.
Граничные значения параметров tyc и Су зависят от микрохимического состава минеральной части исходного угля [8]. Величина параметра Су определяет количество кислых оксидов, растворяющихся в составе образующегося расплава при взаимодействии их с железосодержащими минералами. Железо в минеральной части углей входит в состав пирита FeS2 либо содержит РеСОз. По данным микрохимического анализа углей [8] индивидуальных включений данных минералов, как правило, не наблюдается. В общем случае они входят в сростки (минеральные композиции) с алюмосиликатами. Это позволяет оценить максимальную величину Су по стехиометрическому соотношению для реакции взаимодействия в таких сростках:
2FeS2 + 5 SiO2 + 2А12О3 + 5О2 = 2FeO 2А12О3 5SiO2 + 4SO2, (9) из которого следует, что при образовании железистого кордиерита 1 моль FeO связывает 3,5 моль кислых оксидов и в пересчете на Fe2O3 С^к < 3,14CFe2o3, где CFc2q3 - содержание оксида Fe2O3 в составе золы угля. Если в исходном угле железосодержащие минералы находятся в сростках с чисто алюмосиликатными (каолинит Al2O3-2SiO2-2H2O), то максимальная величина параметра /у будет соответствовать эвтектической композиции с ^ = 1088 °C в системе FeO-SiO2-Al2O3 [9], реализующейся при нестехиометрическом развитии реакции (9) и полной десульфурации образующегося расплава. При наличии в минеральных композициях глин, насыщенных катионами К, Са, Na, а также в сростках железосодержащих минералов с полевым шпатом (альбит, апортит, ортоклаз) величина параметра уменьшается до минимального значения /у = 990 °C, отвечающего температуре плавления эвтектики в системе Al2O3SiO2-FeO-K2O [6, 9].
Считаем необходимым отметить, что предельные значения 990 °C <^к< 1083 °C, соответствующие полной десульфурации расплава, не зависят от исходной природы железосодержащих минералов. В реальном процессе кратковременного взаимодействия органическая сера и минеральные компоненты в составе угля являются неотъемлемыми компонентами при образовании сульфидно-силикатного расплава даже при отсутствии пирита. В [4] показано, что при скоростях нагрева 1,1-1,8 °С/с образцов золы образование сульфидно-силикатного расплава при t> 920 °C и его расслоение на две жидкие фазы происходит вне зависимости от фазового состава железосодержащих минералов в исходном угле, а определяется валовым химическим составом золы с учетом сульфатной массы.
В таблице представлены результаты расчетов температуры ликвидуса оксидно-сульфидного расплава по уравнению (8) в сравнении с величиной температуры начала шлакования, определенной в реальных условиях факельного сжигания и рассчитанной по уравнению аппроксимации (1) [1]. Для расчетов по уравнения (8) параметр /у принимали как температуры плавления эвтектических композиций (см. таблицу), состав которых устанавливали по результатам анализа микрохимического состава образцов исходного угля и утвердившихся положений о фазовом составе их минеральной части и сопутствующей породы.
Сопоставление показывает, что /л и 1Ш, определяемое экспериментально, различаются в среднем на 3-5 °C. Исключение наблюдается только для кызылкийского угля, которое объясняется следующим. Пирит в составе данного угля входит в минеральные композиции, в которых обнаруживается до 8-12 мол.% калия [8]. Взаимодействие в таких композициях приводит к одновременному присутствию в составе аэродинамического эолового потока двух жидких фаз: на основе FeS-FeO с (, = 949 °C и на основе эвтектической композиции KAlSi3O8-KFeSi3O8 с 1Л = 1004 °C. Следовательно, реальная величина /ш должна находиться в пределах 949-1004 °C. С учетом этого среднее значение данного интервала (л = 976 °C находится в хорошем согласии с tw = 970 °C, определенной экспериментально.
Сопоставление величины температуры начала шлакования, установленной экспериментально [1], с температурой ликвидуса, рассчитанной по данным о валовом составе золы и микрохимического состава минеральных композиций в исходном угле
|
№ |
Месторожде-ние угля |
Химический состав, мол.% |
/ш по уравнени-ям в тексте, °C |
Расчет t„ с учетом микрохимического состава углей по уравнению (8) |
°C (эксп) |
||||
|
Qk |
Qo |
CZFe2O3 |
1№ °C |
Эвтектика в системе |
G>°C |
||||
|
1 |
Сибергинский |
87,01 |
10,62 |
2,83 |
1020 |
1088 |
FeO-Al2O3-SiO2 |
1038 |
1040 |
|
2 |
Анжуйский |
87,85 |
9,47 |
2,48 |
1032 |
1088 |
FeO-Al2O3-SiO2 |
1058 |
1060 |
|
3 |
Ангренский |
76,59 |
20,18 |
3,4 |
971 |
1050 |
CaO-FeO-SiO2-Al2O3 |
989 |
995 |
|
4 |
Черемховский |
88,54 |
9,21 |
2,21 |
1036 |
1050 |
CaO-FeO-Al2O3-S iO2 |
1018 |
1020 |
|
5 |
Ирша- Борьдинский |
58,26 |
38,68 |
3,2 |
946 |
1040 |
CaO-FeO-Fe2O3- Al2O3-SiO2 |
951 |
950 |
|
6 |
Экибастузс-кий |
93,33 |
3,81 |
2,83 |
1201 |
1040 |
CaO-FeO-Fe2O3-A12O3—SiO2 |
1209 |
1205 |
|
7 |
Азейский |
86,89 |
10,9 |
2,19 |
1018 |
1040 |
CaO-FeO-Fe2O3-A12O3—SiO2 |
992 |
995 |
|
8 |
Челябинский |
85,32 |
9,98 |
4,71 |
1024 |
990 |
Al2O3-FeO-K2O-SiO2 |
1026 |
1030 |
|
9 |
Минусинский |
77,7 |
17,19 |
5,12 |
980 |
990 |
A12O3-FeO-K2O-SiO2 |
985 |
980 |
|
10 |
Приозёрный |
85,14 |
11,26 |
3,62 |
1013 |
990 |
Al2O3-FeO-K2O-SiO2 |
990 |
990 |
|
11 |
Кызыл-кийский |
77,22 |
16,49 |
6,33 |
981 |
990 |
A12O3—FeO-K2O—SiO2 |
949/ 1004 |
970 |
В заключение считаем необходимым отметить, что для практических оценок температуры начала шлакования по химическому составу золы выбор уравнения не имеет принципиального значения, поскольку они все приводят к результатам, достаточным для организации бесшлаково-го режима при факельном сжигании. Однако для анализа шлакующих свойств углей в целом, агрегатного состояния золовых частиц в составе аэродинамического потока и условий их закрепления выбор вида функциональной зависимости является определяющим. Уравнение (8) при статистическом усреднении параметров /^к и С^к легко преобразуется в уравнение (3), что позволяет сделать следующее заключение о физико-химическом смысле температуры начала шлакования и её зависимости от валового химического состава угля.
По физико-химическому смыслу температура начала шлакования для углей с кислым составом золы соответствует температуре ликвидуса (устойчивости) сульфидно-силикатного расплава в составе формирующихся шлаковых отложений. Закрепление (налипание) частиц при формировании отложений с химическим составом золы, адекватным золе исходного угля, связано не с их агрегатным состоянием в целом, а с взаимодействием с сульфидно-силикатным расплавом, играющим роль «клея» в связи с его уникальными реологическими свойствами, отмеченными в [4]. Количество сульфидно-силикатного расплава в составе аэродинамического эолового потока, необходимое для формирования отложений, по оценке среднего значения не превышает 7 мол.%.
Работа выполнена при поддержке гранта губернатора Челябинской области Ур. Чел. №104-03-96072.
Список литературы Температурные условия начала формирования шлаковых отложений при их факельном сжигании
- Алехнович А.Н., Богомолова В.В. Температурные условия начала шлакования при сжигании углей с кислым составом золы//Теплоэнергетика. -1988. -№ 1. -С. 34-38.
- Алехнович А.Н., Богомолова В.В., Гладков В.Е. Шлакование и отложения в газовом тракте котлов//В кн.: Развитие технологий подготовки и сжигания топлива на электростанциях. -М.: ВТИ, 1996.-С. 111-123.
- Алехнович А.Н., Богомолов В.В., Гладков В.Е. Прогнозирование шлакующих и загрязняющих свойств углей//Электрические станции. -1988. -№ 4. -С. 2-6.
- Афлятунов Ж.З., Гладков В.Е., Викторов В.В. Влияние скорости нагрева на деформацию образцов из золы углей//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2005. -Вып. 6.-№6(46). -С. 129-134.
- Кожеуров В.А. Термодинамика металлургических шлаков. -Свердловск, 1958. -160 с.
- Бережной А.С. Многокомпонентные системы окислов. -Киев: Наукова Думка, 1970. -544 с.
- Васильев М.В. К вопросу о положении эвтектической точки на диаграмме состояния бинарных систем//Известия вузов (цветная металлургия). -1969. -№ 6. -С. 90-95.
- Афлятунов Ж.З., Гладков В.Е., Викторов В.В. Особенности микрохимического состава энергетических углей//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2005. -Вып. 6. -№6(46).-С. 135-138.
- Минералы: Справочник.-М.: Наука, 1974.-Вып. 1-2.


