Теоретические аспекты взаимодействия растительных полифенолов с макромолекулами в функциональных пищевых системах
Автор: Фаткуллин Ринат Ильгидарович, Потороко Ирина Юрьевна, Калинина Ирина Валерьевна
Рубрика: Питание и здоровье
Статья в выпуске: 1 т.9, 2021 года.
Бесплатный доступ
Выполнен обзор мировой практики в области теории взаимодействия между растительными полифенолами и макромолекулами пищевых систем: белками, липидами и углеводами. В значительном количестве исследований показано, что взаимодействия между полифенолами и компонентами пищевой системы преимущественно основаны на нековалентных взаимодействиях, включая гидрофобное, ван-дер-ваальсовое взаимодействие, возникновение водородных мостиков, ионные взаимодействия. Реже возможно формирование ковалентных связей. Взаимодействие полифенолов с белками и углеводами преимущественно основано на возникновении водородных связей. Установлено, что многие макромолекулы оказывают существенное влияние на биодоступность и биоактивность полифенолов, причем это влияние может носить как положительный, так и отрицательный характер. В частности, белки, липиды и углеводы способны формировать защитную оболочку для полифенольных биологически активных веществ, обеспечивая тем самым их сохранность в процессе желудочно-кишечного переваривания пищи. Однако в ряде случаев взаимодействие полифенолов с макромолекулами пищевой системы может приводить к значительной биотрансформации первых и, как следствие, снижению или полной потере их биологической активности. Представлены данные, свидетельствующие о взаимном влиянии полифенолов и макромолекул пищевых систем, в частности полифенольные вещества способны блокировать отдельные аминокислоты, снижая степень их усвоения. Кроме того, полифенолы, взаимодействуя с ферментами, способны снижать степень ферментации белков, липидов и углеводов, тем самым, замедляя или блокируя их усвоение в организме человека. Таким образом, взаимодействие между полифенолами и макромолекулами пищевой системы очень важно и должно учитываться при разработке обогащенных, функциональных и специализированных продуктов на основе биологически активных веществ полифенольной природы. Многочисленные исследования, проводимые учеными разных стран, показывают необходимость понимания принципов встраивания полифенолов в пищевую систему продукта, а также оценки сохранения их биодоступности и биоактивности с учетом физических и химических свойств пищи.
Растительные полифенолы, макромолекулы пищевых систем, типы и направления взаимодействия
Короткий адрес: https://sciup.org/147234337
IDR: 147234337 | УДК: 66.098 | DOI: 10.14529/food210109
Текст научной статьи Теоретические аспекты взаимодействия растительных полифенолов с макромолекулами в функциональных пищевых системах
Разработка функциональных пищевых продуктов, способных быть источниками биологически активных веществ (БАВ) и реальным инструментом немедикоментозной коррекции и профилактики неифекционных заболеваний, является востребованной задачей для предприятий пищевых производств, укладывается в Стратегию повышения качества пищевой продукции в Российской Федерации до 2030 г. (распоряжение Правительства РФ от 29 июня 2016 г. № 1364-р) и согласуется с Основами государственной политики в области здорового питания населения.
Растительные полифенолы - огромная группа натуральных соединений, обладающих выраженными фармакологическими свойствами, среди которых хорошо известны и изу- чены антиоксидантное, противовоспалительное, капилляропротекторное, онкопротектив-ное, иммуномодулирующее и другие. Часто предполагается, что обогащение пищевых продуктов растительными полифенолами позволит обеспечить выраженное благоприятное воздействие на здоровье человека, однако это не всегда так. Использование растительных полифенолов в качестве функциональных пищевых ингредиентов зачастую ограничено рядом барьерных факторов, среди которых их низкая растворимость в воде, плохая проницаемость через мембраны клеток, низкая химическая и термостабильность. Кроме того, многочисленные исследования, проводимые учеными разных стран, показывают необходимость установления принципов встраивания БАВ в пищевую систему продукта, а так- же оценки сохранения их биодоступности и биоактивности с учетом физических и химических свойств пищи.
Известно, что пищевые продукты представляют собой сложные с точки зрения химии системы, компоненты которой (как макро-, так и микронутриенты) могут оказывать существенное влияние на биодоступность и биоактивность полифенолов. Понимание механизмов взаимодействия полифенолов с соединениями, присутствующими в пищевых продуктах, такими как углеводы, белки, липиды, минеральные элементы и др., позволит регулировать биодоступность и биоактивность полифенольных соединений в их составе.
Так в ряде исследований показано, что взаимодействия между полифенолами и компонентами пищевой системы преимущественно основаны на нековалентных гидрофобных взаимодействиях, реже возможно формирование ковалентных связей [13, 30, 34]. Водородные связи формируются преимущественно в случае взаимодействия между полифенолами и белками, а также полифенолами и углеводами [5, 8, 23].
Установлено, что многие макромолекулы, имея сложную структуру, активные реакционноспособные центры способны улавливать полифенолы и, как следствие, изменять их доступность для поглощения в организме человека. Кроме того, эти взаимодействия с компонентами пищевой системы могут дать полифенолам совершенно иную роль. Компоненты пищевой системы могут защищать полифенолы от окисления во время их прохождения через желудочно-кишечный тракт и доставлять их в кишечник более неповрежденными [22, 29].
С целью развития теории и установления принципов встраивания растительных полифенолов, как БАВ, в макромолекулы пищевой системы, была поставлена задача систематизации имеющейся информации. В качестве объектов изучения были определены взаимодействия полифенолов с протеинами, углеводами, липидами разнокомпонентных пищевых систем.
Взаимодействия в системе «полифенол – протеины»
Сложная структура протеинов, их многоуровневая организация молекул с разной степенью устойчивости в условиях пищевой системы обусловливают неоднородность меха- низмов взаимодействия с растительными полифенолами.
Большинство исследований, представленных в литературе, показывает, что белок-полифенольные взаимодействия преимущественно обусловлены возникновением обратимых нековалентных гидрофобных связей, которые впоследствии могут быть стабилизированы водородными [4, 8, 9, 11, 19, 27, 28, 34].
Исследования других авторов доказывают, что полифенолы способны вступать в реакции с остатками аминокислот, образуя по-лифенол-белковые ассоциации и блокируя доступность аминокислот для усвоения организмом человека [9]. В работах Kroll с соавторами показано, что белки и полифенолы могут также связываться посредством ковалентных взаимодействий, которое является необратимыми и приводят к образованию трудноусвояемых соединений [13]. Ali и соавторы продемонстрировали появление ковалентных связей между кофеоилхиновой кислотой и запасными белками кофейных зерен [3]. Rohn и соавторы предположили существование ковалентного взаимодействия полифенолов с ферментами (α-амилаза, трипсин и лизоцим) [21].
В белок-полифенольных взаимодействиях важную роль играют структура и молекулярная масса полифенолов. Было установлено, что высокомолекулярные полифенолы (например, танины) способны более активно взаимодействовать с белками [8, 16–20], а порядок связывания с белками увеличивается с увеличением количества ОН-групп в молекуле полифенола [9, 11, 12].
Рассматривая белок-полифенольные взаимодействия с точки зрения влияния на биологические эффекты комплексов, Yuksel в соавторстве с другими учеными отмечает, что полифенол-белковые взаимодействия могут привести к возможному изменению укладки белка и его функциональности [35].
В комплексах с ферментами, в частности с α-амилазой, полифенолы могут и изменять их активность. В исследованиях Rohn с соавторами, было продемонстрировано ингибирование активности фермента полифенолами. Фермент α-химотрипсин ингибировался после взаимодействия с полифенолами, как следствие, гидролиз пищевых белков происходил медленнее [21].
В некоторых исследованиях изучалось влияние полифенол-белковых комплексов на биодоступность полифенолов. Единого мнения на этот счет нет, описываются как положительные, так или отрицательные эффекты. В своих научных работах Duarte и Farah показали, что взаимодействие между белковыми компонентами молока и полифенолами, выделенными из кофе, может оказывать негативное влияние на биодоступность последних [6].
Обобщая представленный аналитический материал, проведена систематизация возможных направлений взаимодействия в системе «полифенол – белок», которая приведена ниже (рис. 1).
Представленная схема содержит основные типы связей в системе формирующегося комплекса, их дуальность, которую при внесении растительных полифенолов в пищевую систему необходимо учитывать.
Взаимодействия в системе «полифенол – липиды»
Пищевые липиды на начальном этапе пищеварительного процесса – при пережевывании – формируют эмульсии, которые в дальнейшем подвергаются воздействию липазы. В результате процесса липолиза происходит расщепление липидов и их адсорбция. На процесс липолиза значительное влияние оказывают специфические свойства эмульсии, такие как размер жировых капель и поверхностное натяжение. По этой причине любая молекула, которая может воздействовать на свойства эмульсии или активность липазы, потенциально может повлиять и на процесс абсорбции липидов [26].
Некоторые исследования показывают, что полифенолы при взаимодействии с липидами приводят к увеличению размера жировых ка- пель. Такой эффект, как правило, обусловлен двумя типами взаимодействий: полифенолы могут выступать в качестве связующего звена между липидными комплексами, приводя к процессу агломерации; другой причиной может быть включение полифенолов в липидный слой. В свою очередь, увеличение размера жировых капель может стать причиной снижения активности липазы и абсорбции жира [2, 10, 12, 26, 32, 33].
Исследования других авторов также подтверждают ингибирование активности липазы и снижение процесса абсорбции жира в результате полифенол-липидных взаимодействий [28]. В исследованиях Uchiyama с соавторами, было изучено влияние полифенолов на ожирение крыс, которое показало, что полифенолы ингибируют активность липазы, замедляют процесс всасывания липидов в кишечнике, а также подавляют повышение уровня триглицеридов в плазме крыс [31].
Рассматривая полифенол-липидные взаимодействия с точки зрения их влияния на биологические эффекты комплексов, большинство исследований доказывают, что взаимодействия между липидами и полифенолами лишь незначительно снижают доступность полифенолов для абсорбции. В исследованиях Schramm и соавторов изучено влияние пищи, богатой липидами, на поглощение флаванолов у людей. Они установили, что липиды практически не снижают абсорбцию флаванолов [24].
Более того, в результате полифеноллипидного взаимодействия вокруг полифенолов может формироваться защитная липидная оболочка, которая способствует сохранности БАВ при прохождении через желудочнокишечный тракт. Таким образом, липиды мо-
--------------------------------------------------------------------------------------------------------------------------------------------------------------------- , I
Полифенол (БАВ)I
Образование устойчивых комплексов, снижение биодоступности (БД) и биоактивности (БА)
Защита от преждевременной деградации БАВ, повышение БД и БА
Доставка БАВ в нижние отделы ЖКТ, увеличение БД и БА
I ^ Белок (Б)
I ' _______________________________________________________________________________________________________
Изменение структуры белка и его усвояемости
Снижение активности ферментов, снижение степени переваривания Б
Блокировка отдельных аминокислот, снижение их БД
Рис. 1. Возможные взаимодействия в системе «полифенол – белок»
гут помочь в доставке полифенолов в нижние отделы желудочно-кишечного тракта. В исследованиях Ortega и соавторов изучена in vitro переваримость полифенолов в составе липидной матрицы. Они подтвердили защитное действие липидов на полифенолы путем агрегации мицелл, которые снижают потери и предотвращают окислительную деградацию полифенолов во время пищеварения [20].
Некоторые исследования также показывают возможность ингибирования процессов окисления липидов в результате полифеноллипидного взаимодействия. Положительные эффекты установлены для кверцетина, рутина, кофейной и хлорогеновой кислот [7, 14, 15].
Анализ информации в области взаимодействия полифенолов и липидов доказывает целесообразность использования последних для получения наноносителей полифенолов через желудочно-кишечный тракт. Липидные нанокапсулы могут быть эффективны при доставке нерастворимых в воде и чувствительных к внешним факторам полифенольных соединений.
Систематизация возможных направлений дуального взаимодействия в системе «полифенолы – липиды», которые необходимо учитывать при формировании функциональных пищевых систем на основе растительных полифенолов и липидов приведена ниже (рис. 2).
Углеводы, выполняя роль фундамента пирамиды питания, являются превалирующими макромолекулами в рационах людей. Анализ научной литературы свидетельствует о том, что взаимодействия полифенолов с углеводами были преимущественно исследованы экспериментально в модели in vitro . Огромная роль в полифенол-углеводных взаимодействиях отводится наличию полостей в молекулах сложных углеводов.
Взаимодействия в системе «полифенол – углеводы»
В основе полифенол-углеводных взаимодействий, как правило, лежит образование слабых водородных связей, которые образуются между гидроксильными группами полифенолов и атомами кислорода гликозидных связей полисахаридов. Ковалентные связи могут формироваться только между фенольными кислотами и полисахаридами.
Большинство исследований, представленных в литературе, показывает, что результаты полифенол-углеводных взаимодействий могут быть множественными. Прежде всего, это влияние на биодоступность полифеноль-ных соединений. Некоторые исследования показали, что биодоступность полифенолов снижается из-за образования конъюгатов с углеводами, которые фактически захватывают полифенолы в свою структуру. Adam и соавторы провели оценку биодоступности полифенолов из сложного зернового матрикса на модели крыс и установили, что зерновой матрикс ограничивает биодоступность феруловой кислоты [1].
Другие исследования, напротив, показали возможность использования углеводов пищевой системы для увеличения поглощения некоторых полифенолов. В исследовании Schramm и соавторов, проведенном на людях-добровольцах, показано, что потребление пищевых продуктов, богатых углеводами, в частности хлеба, значительно увеличивало адсорбцию флаванолов. Этот эффект может быть обусловлен как специфическим воздействием углеводов на физиологию желудочнокишечного тракта (например, усиление перистальтики кишечника и (или) секреции желудочно-кишечного сока) или специфической ролью углеводов, как переносчиков флавано-
Полифенолы (БАВ) I
Образование устойчивых комплексов, снижение БД и БА
Защита от преждевременной деградации БАВ, повышение БД и БА
Доставка БАВ в нижние отделы ЖКТ, увеличение БД и БА
I Липиды (Л)
Изменение свойств эмульсии и усвояемости Л
Снижение активности ферментов, снижение степени абсорбции Л
Ингибирование процесса окисления Л
Рис. 2. Возможные эффекты взаимодействия в системе «полифенолы – липиды»
лов [24]. Serra и соавторы также показали в исследовании in vitro , что богатая углеводами пищевая система увеличивает биодоступность мономерных проантоцианидинов. Вместе с тем, биодоступность димера и тримера проан-тоцианидинов снижалась [25].
Биодоступность полифенолов, вероятно, зависит от высвобождения последних из комплексных соединений с углеводами и определяется такими факторами, как структура и свойства полифенолов, сложность структуры комплекса полифенол-углевод, его доступностью для ферментов. Вместе с тем, многочисленными исследованиями установлено, что комплексы полифенол-углевод также могут играть потенциально положительную роль в организме человека. Исследования последних лет подтверждают, что многие сложные усвояемые углеводы и пищевые волокна способны выступать в качестве «системы доставки» для антиоксидантов полифенольной природы и эффективно использоваться в технологиях инкапсуляции последних [23, 29].
Систематизация возможных направлений дуального взаимодействия в системе «полифенол - углеводы» приведена ниже (рис. 3).
ваний доказывает, что взаимодействие полифенолов с макромолекулами пищевой системы может оказывать значительное влияние на метаболизм и роль полифенолов в организме человека. В основе этих взаимодействий лежат преимущественно нековалентные гидрофобные связи, хотя водородные и ковалентные связи также могут возникать и становиться причиной образования различных устойчивых комплексов. Их биологическая активность может в значительной мере отличаться от активности любого из этих соединений в отдельности.
Наиболее изученной следует признать способность таких макромолекул, как липиды, белки и углеводы, выступать в качестве защитных систем для полифенолов при прохождении через пищеварительный тракт. Неоспорим тот факт, что взаимодействие между полифенолами и пищевыми ингредиентами очень важно и должно учитываться при разработке обогащенных, функциональных и специализированных продуктов на основе БАВ полифенольной природы. Понимание механизмов и принципов встраивания полифенолов в сложную пищевую систему позво-
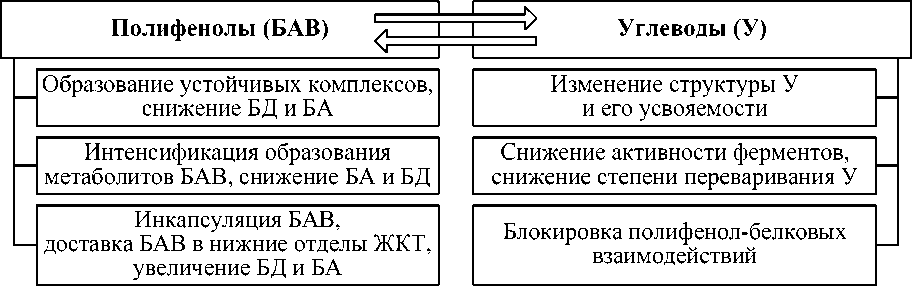
Рис. 3. Возможные эффекты взаимодействия в системе «полифенол – углеводы»
Представленная схема отражает основные направления возможного взаимодействия между углеводами и полифенолами, которые могут играть важную роль в формировании функциональных пищевых систем при использовании в их составе БАВ полифеноль-ной природы.
Вышеизложенный материал указывает на возрастающий интерес исследователей к изучению поведения полифенолов в сложных пищевых системах. Большой объем исследо- лит наиболее эффективно управлять ее свойствами.
Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011, при финансовой поддержке гранта Президента РФ для молодых ученых для государственной поддержки молодых российских ученых – кандидатов наук МК-3690.2021.5.
Список литературы Теоретические аспекты взаимодействия растительных полифенолов с макромолекулами в функциональных пищевых системах
- Adam A., Crespy V., Levrat-Verny M.A., Leenhardt F., Leuillet M. et al. The bioavailability of ferulic acid is governed primarily by the foodmatrix rather than its metabolism in intestine and liver in rats. The Journal of Nutrition, 2002, vol. 132, pp. 1962-1968. DOI: 10.1093/jn/132.7.1962
- Aguié-Béghin V., Sausse P., Meudec E., Cheynier V., Douillard R. Polyphenol-b-casein complexes at the air/water interface and in solution: Effects of polyphenol structure. Journal of Agricultural and Food Chemistry, 2008, vol. 56, pp. 9600-9611. DOI: 10.1021/jf801672x
- Ali M., Homann T., Kreisel J., Khalil M., Puhlmann R. et al. Characterization and modeling of the interactions between coffee storageproteins and phenolic compounds. Journal of Agricultural and Food Chemistry, 2012, vol. 60, pp. 11601-11608. DOI: 10.1021/jf303372a
- Beart J.E., Lilley T.H., Haslam E. Polyphenol interactions. Part 2. Covalent binding of procyanidins to proteins during acid-catalysed decomposition; observations on some polymeric proanthocyanidins. Journal of the Chemical Society Perkin Transactions, 1985, vol. 2, pp. 1439-1443. DOI: 10.1039/p29850001439
- Bellion P., Digles J., Will F., Dietrich H., Baum M. et al. Polyphenolic apple extracts: Effects of raw material and production method onantioxidant effectiveness and reduction of DNA damage in Caco-2 cells. Journal of Agricultural and Food Chemistry, 2010, vol. 58, pp. 6636-6642. DOI: 10.1021/jf904150x
- Duarte G.S., Farah A. Effect of simultaneous consumption of milk and coffee on chlorogenic acids' bioavailability in humans. Journal of Agricultural and Food Chemistry, 2011, vol. 59, pp. 7925-7931. DOI: 10.1021/jf201906p
- Failla M.L., Chitchumronchokchai C., Ferruzzi M.G., Goltz S.R., Campbell W.W. Unsaturated fatty acids promote bioaccessibility and basolateral secretion of carotenoids and alpha-tocopherol by caco-2 cells. Food & Function, 2014, vol. 5, pp. 1101-1112. DOI: 10.1039/c3fo60599j
- Frazier R.A., Deaville E.R., Green R.J., Stringano E., Willoughby I. et al. Interactions of tea tannins and condensed tannins with proteins. Journal of Pharmaceutical and Biomedical Analysis, 2010, vol. 51, pp. 490-495. DOI: 10.1016/j.jpba.2009.05.035
- Hasni I., Bourassa P., Hamdani S., Samson G., Carpentier R., Tajmir-Riahi H.A. Interaction of milk a and P-casein with tea polyphenols. Food Chemistry, 2011, vol. 126, pp. 630-639. DOI: 10.1016/j.foodchem.2010.11.087
- Jakobek L. Interactions of polyphenols with carbohydrates, lipids and proteins. Food Chemistry, 2015, vol. 175, pp. 556-567. DOI: 10.1016/j.foodchem.2014.12.013
- Kanakis C.D., Hasni I., Bourassa P., Tarantilis P.A., Polissiou M.G. Milk P-lactoglobulin complexes with tea polyphenols. Food Chemistry, 2011, vol. 127, pp. 1046-1055. DOI: 10.1016/j.foodchem.2011.01.079
- Karas M., Jakubczyk A., Szymanowska U., Zlotek U., Zielinska E. Digestion and bioavailability of bioactive phytochemicals International. Journal of Food Science and Technology, 2017, vol. 52(2), pp. 291-305. DOI: 10.1111/ijfs.13323
- Kroll J., Rawel H.M., Rohn S. Reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds. Food Science and Technology Research, 2003, vol. 9, pp. 205-218. DOI: 10.3136/fstr.9.205
- Lorrain B., Dangles O., Genot C., Dufour C. Chemical modeling of heme-induced lipid oxidation in gastric conditions and inhibition by dietary polyphenols. Journal of Agricultural and Food Chemistry, 2010, vol. 58, pp. 676-683. DOI: 10.1021/jf903054e
- Lorrain B., Dangles O., Loonis M., Armand M., Dufour C. Dietary iron-initiated lipid oxidation and its inhibition by polyphenols in gastric conditions. Journal of Agricultural and Food Chemistry, 2012, vol. 60, pp. 9074-9081. DOI: 10.1021/jf302348s
- Morales-De La Peña M., Salvia-Trujillo L., Rojas-Graü A., Martín-Belloso O. Effects of high intensity pulsed electric fields or thermal treatments and refrigerated storage on antioxidant compounds of fruit juice-milk beverages. Part II: Carotenoids. Journal of Food Processing and Preservation, 2017, vol. 41(5), art. e13143. DOI: 10.1111/jfpp.13143
- Muta H., Kawauchi S., Satoh M. Ion effects on hydrogen-bonding hydration of polymer an approach by 'induced force model'. Journal of Molecular Structure (Theochem), 2003, vol. 620, pp. 65-76. DOI: 10.1016/S0166-1280(02)00585-7
- Muta H. , Miwa M., Satoh M. Ion-specific swelling of hydrophilic polymer gels. Polymer, 2001, vol. 42, pp. 6313-6316. DOI: 10.1016/S0032-3861(01)00098-2
- Nagy K., Courtet-Compondu M.C., Williamson G., Rezzi S., Kussmann M., Rytz A. Non-covalent binding of proteins to polyphenols correlates with their amino acid sequence. Food Chemistry, 2012, vol. 132, pp. 1333-1339. DOI: 10.1016/j.foodchem.2011.11.113
- Ortega N., Reguant J., Romero M.P., Macia A., Motilva M.J. Effect of fat content on the digestibility and bioaccessibility of cocoa polyphenol by an in vitro digestion model. Journal of Agricultural and Food Chemistry, 2009, vol. 57, pp. 5743-5749. DOI: 10.1021/jf900591q
- Rohn S., Rawel H.M., Wollenberger U., Kroll J. Enzyme activity of a-chymotrypsin after derivatization with phenolic compounds. Food Nahrung, 2003, vol. 47, pp. 325-329. DOI: 10.1002/food.200390075
- Sarni-Manchado P., Canals-Bosch J.M., Mazerolles G., Cheynier V. Influence of the glycosyl-ation of human salivary proline-rich proteins on theirinteractions with condensed tannins. Journal of Agricultural and Food Chemistry, 2008, vol. 56, pp. 9563-9569. DOI: 10.1021/jf801249e
- Saura-Calixto F. Dietary fiber as a carrier of dietary antioxidants: An essential physiological function. Journal of Agricultural and Food Chemistry, 2011, vol. 59, pp. 43-49. DOI: 10.1021/jf1036596
- Schramm D.D., Karim M., Schrader H.R., Holt R.R., Kirkpatrick N.J. et al. Food effects on the absorption and pharmacokinetics of cocoa flavanols. Life Sciences, 2003, vol. 73, pp. 857-869. DOI: 10.1016/S0024-3205(03)00373-4
- Serra A., Macià A., Romero M.P., Valls J., Bladé C. et al. Bioavailability of procyanidin dimmers and trimers and food matrix effect in vitro and in vivo models. British Journal of Nutrition, 2010, vol. 103, pp. 944-952. DOI: 10.1017/s0007114509992741
- Shishikura Y., Khokhar S., Murray B.S. Effects of tea polyphenols on emulsification of olive oil in a small intestine model system. Journal of Agricultural and Food Chemistry, 2006, vol. 54, pp. 1906-1913. DOI: 10.1021/jf051988p
- Soares S., Mateus N., de Freitas V. Interaction of different classes ofsalivary proteins with food tannins. Food Research International, 2012, vol. 49, pp. 807-813. DOI: 10.1016/j.foodres. 2012.09.008
- Sugiyama H., Akazome Y., Shoji T., Yamaguchi A., Yasue M. et al. Oligomeric procyanidins in apple polyphenol are main active components for inhibition of pancreatic lipase and triglyceride absorption. Journal of Agricultural and Food Chemistry, 2007, vol. 55, pp. 4604-4609. DOI: 10.1021/jf070569k
- Tomâs-Barberân F.A., Andrés-Lacueva C. Polyphenols and health: Current state and progress. Journal of Agricultural and Food Chemistry, 2012, vol. 60, pp. 8773-8775. DOI: 10.1021/jf300671j
- Tyukavkina N.A., Lapteva K.I., Pentegova V.A. Flavonoids of Larix Dahurica. I. Khimiya Prirodnykh Soedinenii, 1967, vol. 3(4), pp. 278-279.
- Uchiyama S., Taniguchi Y., Saka A., Yoshida A., Yajima H. Prevention of diet-induced obesity by dietary black tea polyphenols extract in vitro and in vivo. Nutrition, 2011, vol. 27, pp. 287-292. DOI: 10.1016/j.nut.2010.01.019
- Tuohy K.M., Conterno L., Gesperotti M., Viola R. Up-regulating the human intestinal microbiome using whole plant foods, polyphenols, and/or fiber. Journal of Agricultural and Food Chemistry, 2012, vol. 60, pp. 8776-8782. DOI: 10.1021/jf2053959
- Verma B., Hucl P., Chibbar R.N. Phenolic acid composition and antioxidant capacity of acid and alkali hydrolysed wheat bran fractions. Food Chemistry, 2009, vol. 116, pp. 947-954. DOI: 10.1016/j.foodchem.2009.03.060
- Yi W., Akoh C.C., Fischer J., Krewer G. Absorption of anthocyanins from blueberry extracts by Caco-2 human intestinal cell monolayers. Journal of Agricultural and Food Chemistry, 2006, vol. 54, pp. 5651-5658. DOI: 10.1021/jf0531959
- Yuksel Z., Avci E., Erdem Y.K. Characterization of binding interactions between green tea flavonoids and milk proteins. Food Chemistry, 2010, vol. 121, pp. 450-456. DOI: 10.1016/j.foodchem. 2009.12.064


