Теоретическое обоснование и экспериментальное подтверждение антибактериальных и противогрибковых свойств природного пептида
Автор: Тихонов С.Л., Мерзлякова Н.В., Шихалев С.В., Тихонова Н.В., Смирнова А.В., Тихонова М.С.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 2 (89), 2023 года.
Бесплатный доступ
Статья посвящена теоретическому обоснованию антибактериальной и противогрибковой активности природного пептида mpR2, выделенного из пепсинового гидролизата молозива коров, и экспериментальному подтверждению его эффективности in vitro. Выделенный полипептид состоит из 60 аминокислотных остатков и имеет молекулярную массу 23 кДа. Моделирование показало, что пространственная структураmpR2 представлена α-спиралью. Пептид имеет гидрофобный домен, его суммарный заряд составляет +2, а изоэлектрическая точка находится на уровне 8,9. Полученные физические характеристики позволили предположить, что выделенный пептид обладает антибактериальной и противогрибковой активностью, что было подтверждено в эксперименте in vitro. Установлено, что идентифицированный пептид mpR2 обладает антибактериальной активностью в отношении тест-штаммов бактерий грамотрицательной бактерии E. coli ATCC 25922 и грамположительной бактерии B. Subtilis, противогрибковой активностью в отношении дрожжевого диплоидного грибка C. Albicans, но более низкой в сравнении с активностью антибиотика и противогрибкового препарата.
Пептиды, молозиво коров, антимикробная активность, противогрибковая активность, структура пептидов, α-спиральная пространственная структура
Короткий адрес: https://sciup.org/142238242
IDR: 142238242 | УДК: 543.645.6 | DOI: 10.53980/24131997_2023_2_40
Текст научной статьи Теоретическое обоснование и экспериментальное подтверждение антибактериальных и противогрибковых свойств природного пептида
Антимикробные пептиды (AMП) представляют собой разнообразный класс молекул, встречающихся в природе и экспрессирующихся во всех организмах, включая млекопитающих [1]. Они являются незаменимыми компонентами врожденного иммунитета и обладают широким спектром активности против бактерий, грибков, дрожжей, вирусов, а также онкоклеток [2]. Как правило, АМП имеют относительно небольшую длину - от 10 до 100 остатков аминокислот, являются катионными, могут быть амфифильными, гидрофобными и гидрофильными [3]. АМП кодируются в геноме в виде препропептидов, где сигнальный пептид находится на N -конец, а домен антимикробного пептида находится на С -конце [4]. АМП являются альтернативой традиционным антибиотикам, так как обладают широким спектром действия и у микроорганизмов не развивается резистентность к пептидам. Первый АМП-препарат грамицидин А, выделенный из почвенных бактерий Bacillus subtilis , был произведен промышленным способом в 1940-х гг. Низин из Lactococcus lactis впервые был представлен в 1953 г. в качестве противомикробного средства и сейчас находит широкое применение в качестве безопасного пищевого биоконсерванта. Биоинженерные варианты низина эффективны при инфекционных заболеваниях, вызванных S. pneumoniae, энтерококками , C. Difficile , а также они выступают синергетиками по отношению к антибиотикам, таким как ципрофлоксацин и ванкомицин [5]. Пептиды полимиксин B (открытый в 1955 г.), полимиксин E (более известный как колистин, открытый в 1962 г.) и даптомицин (открытый в 2003 г.) используются в качестве антимикробных препаратов [6].
АМП классифицируют на основе их происхождения, свойств последовательности, структурных свойств, биологической активности и молекулярных мишеней воздействия [7]. Поскольку структурная организация АМП играет важную роль в механизме их действия [8], то целесообразно рассмотреть классификацию на основе структуры пептидов. АМП можно разделить на 4 класса в зависимости от их конформационной организации: 1) а-спираль; 2) в-слой; 3) одновременно а-спираль и в-слой (т. е. смешанный тип); 4) без а-спирали и в-слоя [9].
Процентное соотношение существующих пептидов с 1) а-спиралью, 2) в-слоем, 3) а-спи-ралью и в-слоем и 4) без а-спирали и в-слоя пептиды среди известных 3D-структур составляет 69, 12, 16 и 3 % соответственно. Большинство известных АМП являются катионными, незначительное число пептидов несет нейтральный или анионный заряд. Так, АМП с а-спиралью, в-слоем в структуре имеют средний заряд от +2 до +3,60, смешанные пептиды имеют более высокий средний заряд - на уровне + 5,40 [9].
В части структуры аминокислотной последовательности а-спиральные пептиды имеют в составе лизин, лейцин и аланин, тогда как пептиды с в-слоем имеют в составе цистеин и аргинин. Примечательно, что все 4 класса содержат высокие доли глицина, что позволяет предположить, что он важен как для структурной поддержки, так и для гибкости пептидов для выполнения антимикробных функций. а-спиральные пептиды представляют собой самый большой класс АМП и являются наиболее изученными [10].
Ввиду того что в статье описаны результаты исследования а-спиральных противомик-робных пептидов, целесообразно остановиться на механизме их действия.
Многие а-спиральные противомикробные пептиды линейны и амфипатичны, состоят из катионных и гидрофобных аминокислот, пространственно разделенных на противоположных сторонах спирали [10]. Яркими примерами этого класса являются кателицидины млекопитающих [11]. Эти пептиды проявляют сильное сродство к мембранам, тем самым ставя под угрозу стабильность β-слоя, нарушая организацию мембраны и (или) формируя поры. Первоначально пептиды находятся параллельно поверхности мембраны клетки, затем при увеличении концентрации вращаются вокруг мембраны, чтобы внедриться в мембрану под определенным углом наклона. Человеческий кателицидин LL-37 может принимать частично спиральную структуру в растворе, следовательно, заставляя его олигомеризоваться с другими пептидами, чтобы скрыть гидрофобную поверхность. Помимо индивидуальной активности, спиральные пептиды с различными последовательностями могут действовать синергически, что приводит к усилению цитолитического и антибактериального эффектов [12].
Путем посттрансляционной модификации зрелый (активный) биопептид образуется путем протеолитического расщепления белка [13].
Молочные белки являются легкодоступным источником ценных пептидов с разнообразными типами биологической активности, такими как антимикробная, гипотензивная, антиоксидантная, антитромботическая и иммуномодулирующая [14].
Так, авторами [15] в результате двустадийного гидролиза соевого белка пепсином и трипсином получены пептиды с антиоксидантными свойствами, установлены оптимальные параметры гидролиза соевого белка для каждого фермента. Ученые [16] доказали, что биопептиды могут быть выделены из мяса и мясопродуктов. В исследовании авторов [17] установлены оптимальные параметры гидролиза яичного альбумина для выделения биопептидов.
Цель работы – теоретически обосновать антимикробную и противогрибковую активность природного пептида, выделенного из пепсинового гидролизата молозива коров, и подтвердить его эффективность в эксперименте in vitro .
Материалы и методы исследования
В качестве объекта исследований использован пептид, выделенный из пепсинового гидролизата молозива коров. Пептиду дано условное название mpR2 . Молекулярно-массовое распределение пептида оценивали масс-спектрометрическим методом и идентифицировали методами MALDI-TOF и MS масс-спектрометрии на MALDI-времяпролетном масс-спектрометре Ultraflex («Bruker», Германия). Масс-спектры анализировали с помощью программы Mascot, опция Peptide Fingerprint («Matrix Science», США) с использованием базы данных Protein NCBI. Микросеквенирование осуществляли при помощи секвенатора MiSeq (Illumina, США) и системы для высокопроизводительного секвенирования (PGM Ion Torrent, США).
Моделирование пространственной структуры выделенного пептида осуществляли с помощью программы молекулярного моделирования Schrodinger Maestro (США).
Антимикробную активность пептида исследовали диско-диффузионным методом на грамположительных и грамотрицательных бактериях. В качестве тест-штаммов использовали Escherichia coli и грамположительную бактерию Bacillus subtilis .
Культивирование штаммов бактерий проводили на плотной питательной среде LB (агар – 1,5 %, триптон – 1, дрожжевой экстракт – 0,5, NaCl – 1 %) и жидкой питательной среде LB (триптон – 1 %, дрожжевой экстракт – 0,5, NaCl – 1 %) при температуре 37 ºC.
Диффузионный метод определения антимикробной активности гидролизатов заключался в следующем. Тест-штамм высевали на агаризованную питательную среду газоном, и одновременно на газон помещали пептид. В качестве контроля использовался бумажный диск с питательной средой, в качестве препарата сравнения – диск с антибиотиком (канамицин из стандартного набора). Чашки Петри инкубировали при температуре, соответствующей оптимальной температуре роста каждого тест-штамма микроорганизма, в течение 24,0 ± 0,5 ч. Результаты учитывались по наличию и размеру (в мм) прозрачной зоны отсутствия роста микроорганизмов вокруг диска.
Результаты исследования и их обсуждение
На рисунке представлены двухмерная (а) и трехмерная (б) структуры пептида mpR2 .

а
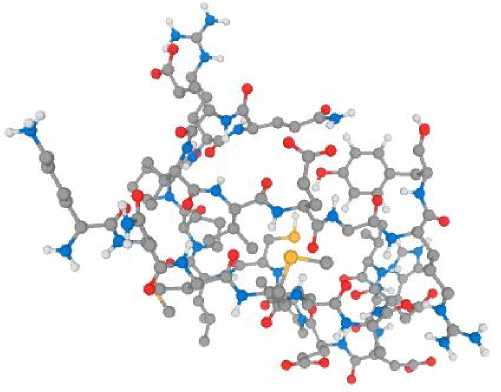
б
Рисунок – Двухмерная (a) и трехмерная (б) структуры пептида mpR2
При исследовании первичной структуры пептида с условным названием mpR2 установлено, что он состоит из 60 аминокислот и в следующей последовательности: LRQLSVVVAYKGKDVGLNDCEEADRHKSSHRDEVSSFRRNSYSIYENHGP SAKCAREVGR, и имеет молекулярную массу 23 кДа. Согласно базе данных, Protein NCBI сходен с пептидом под названием « EV861652 protein, sus scrofa », функции которого не исследованы.
Пептид mpR2 наряду с другими аминокислотами состоит из 5 аминокислотных остатков лизина, 2 лейцина и 5 аланина, что согласуется с базой данных APD3, состоящей из более чем 3 000 записей о структурно-аннотированных природных пептидах, из которой следует, что антимикробные α-спиральные пептиды имеют в составе лизин, лейцин и аланин [18].
По данным [19], в состав антимикробных пептидов входят специфические аминокислоты, такие как аргинин, глицин и гистидин. Их антимикробная активность обеспечивается водородными связями или силами Ван-дер-Ваальса между пептидами и мембранными липидами, независимо от водородных связей между остатками.
В антимикробном пептиде, который проявляет активность против бактерий и вируса SARS-CoV-2, по данным [20], присутствуют аминокислотные последовательности VV, VA и AK, которые имеются в исследуемом пептиде mpR2 .
При моделировании 2-и 3-D структур установлено, что пептид mpR2 относится к α-спиральным и имеет заряд +2, гидрофильность (гидрофобность) – +73,70 Ккал×моль-1, что позволяет сделать предположение о его антибактериальных свойствах, и согласуется с исследованием [21]. В исследовании [22] установлено, что АМП обычно содержат несколько основных сайтов, которые придают им суммарный положительный заряд при изоэлектрической точке близкой к нейтральной или слабощелочной, что подтверждается результатами наших исследований. Так, у пептида mpR2 изоэлектрическая точка на уровне 8,90 и имеется гидрофобный домен. По данным [23], электростатический заряд является еще одним движущим фактором, который влияет на притяжение пептида к микробной клетке и сворачивание пептида на границе раздела липид-пептид и большинство антимикробных пептидов имеют катионную природу с суммарным положительным зарядом от + 2 до + 9.
Теоретическое обоснование антимикробного действия пептида согласуется с исследованиями [24], в которых установлено, что гидролиз трипсина и пепсина способствует образованию большинства признанных АМП.
В таблице представлена антимикробная и противогрибковая активность пептида mpR2 .
Таблица
Антимикробная и противогрибковая активность пептида mpR2
|
Наименование образца |
Диаметр зоны лизиса, мм |
||
|
E. coli ATCC 25922 |
B. subtilis |
C. Albicans |
|
|
Пептид mpR2 |
7 |
9 |
5 |
|
Контроль |
0 |
0 |
0 |
|
Антибиотик канамицин |
22 |
24 |
не исследовали |
|
Противогрибковый препарат флуконазол |
не исследовали |
не исследовали |
26 |
Установлено, что пептид mpR2 обладает противомикробной активностью в отношении бактерий E.coli ATCC 25922 и B. Subtilis, а также противогрибковой активностью в отношении дрожжевого гриба C. Albicans . Следует отметить, что исследуемая активность пептида значительно ниже по сравнению с антибиотиком канамицином и противогрибковым препаратом флуканазолом.
Таким образом, теоретически прогнозируемая противомикробная активность пептида mpR2 подтверждена экспериментально.
Заключение
Несмотря на продолжающиеся усилия по разработке новых антибиотиков, возникновение резистентности у бактерий ограничивает эффективность их применения, что имеет значительные последствия для здоровья населения. По этой причине в последние годы исследования все больше фокусируются на выявлении альтернативных стратегий. В этом контексте особое внимание уделяется использованию АМП природного происхождения.
Проведены исследования по изучению взаимосвязи между структурной организацией и активностью АМП, вследствие чего из трипсинового гидролизата молозива коров выделен пептид с условным названием mpR2 , который идентифицирован по базе данных Protein NCBI как пептид «EV861652 protein, sus scrofa» с функциями, которые ранее не были исследованы.
На основании идентификации аминокислот в пептидной последовательности и определении их числа, а также на основании молекулярной массы пептида, заряда, изоэлектрической точки и гидрофильности сделано предположение, что исследуемый пептид относится к антимикробным катионным α-спиральным пептидам.
Экспериментально доказано, что исследуемый пептид обладает противомикробным и антигрибковым действием, но более низким в сравнении с антибиотиком и противогрибковым препаратом. Следовательно, можно рекомендовать использование исследуемого пептида в качестве дополнительного антибактериального и противогрибкового средства при условии доказательства его биодоступности и отсутствия токсичности.
Список литературы Теоретическое обоснование и экспериментальное подтверждение антибактериальных и противогрибковых свойств природного пептида
- Seyf R., Abarghooi F., Tahereh K. et al. Antimicrobial peptides (AMPs): roles, functions and mechanism of action // Int. J. Pept. Res. Ther. 2020. – P. 1451–1463.
- Huan Y., Kong Q., Mou H. et al. Antimicrobial peptides: classifcation, design, application and research progress in multiple felds // Front Microbiol. 2020. – N 11. – 582779.
- Lei J., Sun L., Huang S. et al. The antimicrobial peptides and their potential clinical applications // Am. J. Transl. Res. 2019. – N 11(7). – P 3919–3931.
- Shi Y., Li C., Wang M. et al Cathelicidin-DM is an antimicrobial peptide from duttaphrynus melanostictus and has wound-healing therapeutic potential // ACS Omega. 2020. – N 5(16). – P. 9301–9310.
- Shin J., Gwak J., Kamarajan P. et al. Biomedical applications of nisin // J. Appl. Microbiol. 2016. – N 120. – P. 1449–1465.
- Moretta A., Scieuzo C., Petrone A.M. et al. Antimicrobial Peptides: A New Hope in Biomedical and Pharmaceutical Fields. Front. Cell. Infect // Microbiol. 2021. – N 11. – 668632.
- Wang G., Li X., Wang Z. APD3: The antimicrobial peptide database as a tool for research and education // Nucleic Acids Res. 2016. – N 44. – P D1087–D1093.
- Koehbach J., Craik D.J. The Vast Structural Diversity of Antimicrobial Peptides // Trends Pharmacol. Sci. 2019. – N 40. – P. 517–528.
- Wang G. Unifying the classification of antimicrobial peptides in the antimicrobial peptide database (Chapter One) // In Methods in Enzymology. – Academic Press: Cambridge, MA, USA, 2022. – Vol. 663. – P. 1–18.
- Perumal P., Pandey V.P. Antimicrobial peptides: The role of hydrophobicity in the alpha helical structure // J. Pharm. Pharmacogn. Res. 2013. – N 1. – P. 39–53.
- Xhindoli D., Pacor S., Benincasa M. et al. The human cathelicidin LL-37 – A pore-forming antibacterial peptide and host-cell modulator // Biochim. Biophys. Acta (BBA)-Biomembr, 2016. – Vol. 1858. – P. 546–566.
- Pino-Angeles A., Leveritt J.M., Lazaridis T. Pore Structure and Synergy in Antimicrobial Peptides of the Magainin Family // PLoS Comput. Biol. 2016. – Vol. 12. – e1004570.
- Zhang L.J., Gallo R.L. Antimicrobial peptides // Curr. Biol. 2016. – N 26(1). – P. R14–R19.
- Guha S., Sharma H., Deshwal G.K. A comprehensive review on bioactive peptides derived from milk and milk products of minor dairy species // Food Prod Process and Nutr., 2021. – Vol. 3. – URL: https://doi.org/10.1186/s43014-020-00045-7
- Соколов Д.В. [и др.] Ферментативный гидролиз соевого белка // Техника и технология пищевых производств. – 2023. – Т. 53, № 1. – С. 86–96. – URL: https://doi.org/10.21603/2074-9414-2023-1-241
- Chernukha I.M., Mashentseva N.G., Afanasev D.A. et al. Biologically active peptides of meat and meat product proteins. Part 2. Functionality of meat bioactive peptides // Theory and practice of meat processing. 2020. – N 5(2). – P. 12–19.
- Жамсаранова С.Д., Лебедева С.Н., Болхонов Б.А. и др. Ферментативная конверсия пищевого белка и оценка антиоксидантной активности пептидов // Вестник ВСГУТУ. – 2021. – № 4(83). – С. 5–14. – DOI 10.53980/24131997_2021_4_5.
- Chen C.H., Lu T.K. Development and Challenges of Antimicrobial Peptides for Therapeutic Applications // Antibiotics. 2020. – N 9. – P. 24.
- Mishra A.K., Choi J., Moon E. et al. Tryptophan-Rich and Proline-Rich Antimicrobial Peptides // Molecules. 2018. – N 23. – 815 p.
- Liscano Y., Onate-Garzon J., Ocampo-Ibanez I.D. In Silico Discovery of Antimicrobial Peptides as an Alternative to Control SARS-CoV-2 // Molecules. 2020. – N 25. – P. 5535.
- Wang Y., Ding Y.,Wen H. et al. QSAR modeling and design of cationic antimicrobial peptides based on structural properties of amino acids // Comb. Chem. High Throughput Screen. 2012. – N 15. – P. 347–353.
- Wang G. The antimicrobial peptide database provides a platform for decoding the design principles of naturally occurring antimicrobial peptides // Protein Sci. 2020. – N 29(1). – P. 8–18.
- Chan D.I., Prenner E.J., Vogel H.J. Tryptophan- and arginine-rich antimicrobial peptides: Structures and mechanisms of action // Biochimica et Biophysica Acta (BBA) – Biomembranes. 2006. – Vol. 1758, Is. 9. – P. 1184-1202.
- Shivanna S.K., Nataraj B.H. Revisiting Therapeutic and Toxicological Fingerprints of Milk-Derived Bioactive Peptides // Food Biosci. 2020. – 100771.


