Терапевтический патоморфоз переходноклеточного рака при внутрипузырной химиотерапии проспидином и цисплатином у больных раком мочевого пузыря без мышечной инвазии
Автор: Селиванов С.П., Ялова М.Ф., Шабунина Т.И., Исаева С.Н., Ковалик Т.А., Петлин А.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 4-2 т.25, 2010 года.
Бесплатный доступ
Изучалась пролиферативная активность переходноклеточного рака мочевого пузыря у больных раком мочевого пузыря без мышечной инвазии в динамике неоадьювантной внутрипузырной химиотерапии. Сравнивались цитостатические препараты проспидин (производство ФГУП НПО "Микроген" МЗ РФ, Пермь) в разовой дозе 200 мг, суммарной дозе 4000 мг и цисплатин в разовой дозе 20 мг, суммарной дозе 500 мг. Проспидин и цисплатин при внутрипузырном введении достоверно угнетают пролиферативную активность опухолевых клеток и демонстрируют примерно сходные показатели терапевтического патоморфоза.
Рак мочевого пузыря без мышечной инвазии, неоадьювантная внутрипузырная химиотерапия, проспидин, цисплатин
Короткий адрес: https://sciup.org/14920241
IDR: 14920241 | УДК: 616.62-006.6-08
Текст научной статьи Терапевтический патоморфоз переходноклеточного рака при внутрипузырной химиотерапии проспидином и цисплатином у больных раком мочевого пузыря без мышечной инвазии
Хирургический метод лечения рака мочевого пузыря без мышечной инвазии (РМПБМИ) остается главным не только в России, но и за рубежом [8, 13]. Внутрипузырная терапия РМПБМИ используется преимущественно в послеоперационном периоде для снижения риска развития рецидива опухоли после трансуретральной резекции [5, 9, 11, 12]. Доказано, что внутрипузырная химиотерапия позволяет улучшить терапевтический эффект еще на до-операционном этапе [6, 14].
С целью расширения спектра цитотоксических препаратов для внутрипузырной химиотерапии РМПБМИ нами изучен отечественный препарат проспидин (производство ФГУП НПО “Микроген” МЗ РФ, Пермь), широко используемый в химиотерапии злокачественных опухолей различной локализации [1, 4, 7]. Было установлено, что при внутрипузырном введении проспидина в разовой дозе 200 мг препарат оказывает низкую местную и системную токсичность, в частности отсутствует угнетающее действие на кроветворение [2, 3]. Полученные результаты позволили перейти к изучению противоопухолевого действия проспидина.
Цель исследования: провести сравнительную оценку противоопухолевой эффективности внутрипузырного введения проспидина и цисплатина при лечении РМПБМИ.
Материал и методы
В исследование вошли 74 пациента в возрасте 57–80 лет (средний возраст 69 лет) с впервые выявленным раком мочевого пузыря. У всех пациентов был диагностирован переходноклеточный РМПБМИ. Диагноз установлен до начала исследования и подтвержден гистологически при исследовании биопсийного материала, полученного при цистоскопии. У 34 пациентов был проведен один курс неоадьювантной внутрипузырной химиотерапии проспидином (I группа), а 40 пациентов получили внутрипузырную химиотерапию цисплатином (II группа). Обе группы пациентов не имели статистически значимого различия по основным клиническим признакам: стадия заболевания, размер опухоли, распространенность процесса, гистологическая форма опухоли (уровень значимости отличий не опускается ниже 0,3499). У 24 паци-
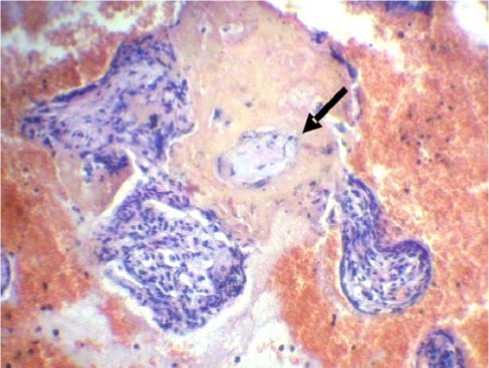
Рис. 1. Высокодифференцированный переходноклеточный рак мочевого пузыря. Больной П., 52 лет (до лечения). Окраска гематоксилином и эозином. Ув. х100
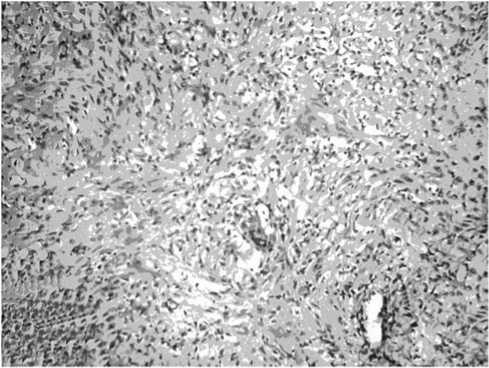
Рис. 2. Выраженный отек фиброзной ткани в зоне ранее выявленной опухоли. Больной П., 52 лет (после завершения курса лечения проспидином). Формируется молодая грануляционная ткань. Окраска гематоксилином и эозином. Ув. х100
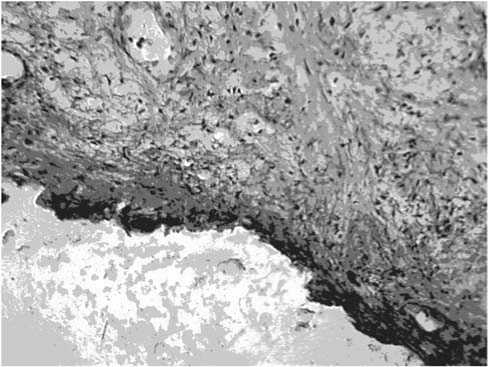
Рис. 3. Грубый фиброз слизистой оболочки и подслизистого слоя типа рубца в зоне излеченной опухоли мочевого пузыря. Больная А., 48 лет (по окончании курса лечения цисплатином). Окраска гематоксилином и эозином. Ув. х100
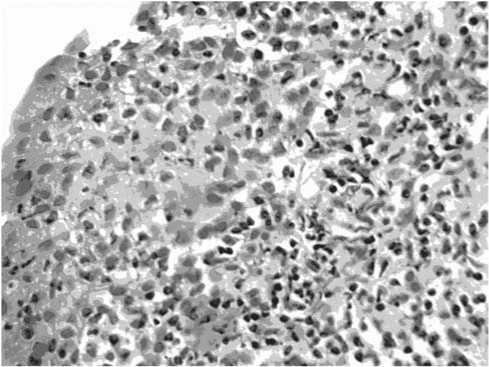
Рис. 4. Густая лимфоидная инфильтрация, окружающая опухолевые клетки. Больная Л., 59 лет (по окончании курса лечения проспидином). Окраска гематоксилином и эозином. Ув. х200
ентов I группы и у 29 больных II группы была диагностирована стадия Т1. Преимущественная локализация опухоли обеих групп приходилась на боковые стенки мочевого пузыря. В исследование вошли больные РМПБМИ с размерами опухоли, не превышающими 2,5 см. Высокодифференцированные формы опухолей (G1) встретились в половине наблюдений каждой группы.
Для сравнительной оценки противоопухолевой активности внутрипузырной химиотерапии проспидином и цисплатином отбирались пациенты, получившие один полный курс химиотерапии. Проспидин вводили внут-рипузырно в разовой дозе 200 мг, разведенной в 20 мл физиологического раствора, ежедневно до суммарной дозы 4000 мг. Экспозиция раствора в мочевом пузыре составила два часа. Курс внутрипузырной химиотерапии цисплатином предусматривал введение препарата в разовой дозе 20 мг, разведенной в 20 мл изотонического раствора натрия хлорида. Экспозиция раствора в моче- вом пузыре составляла 2 ч. Внутрипузырные введения цисплатина повторяли ежедневно до суммарной курсовой дозы 500 мг. Перед внутрипузырным введением про-спидина и цисплатина внутривенная водная нагрузка больным не требовалась. В связи с отсутствием токсического действия на жизненно важные органы снижение дозы препаратов у больных с сердечно-сосудистой и печеночной патологией не проводилось.
При первичном обследовании и на этапах химиотерапии объем диагностических процедур наряду с клиническими анализами (общий анализ крови, мочи, биохимический анализ крови, ЭКГ) включал цистоскопическое, ультразвуковое исследование. Оценка эффективности лечения РМПБМИ включала сопоставление размеров опухоли до и после лечения, изучение морфологических критериев. При этом в I и II группах пациентов биопсийный материал до начала химиотерапии использовался в качестве контроля.
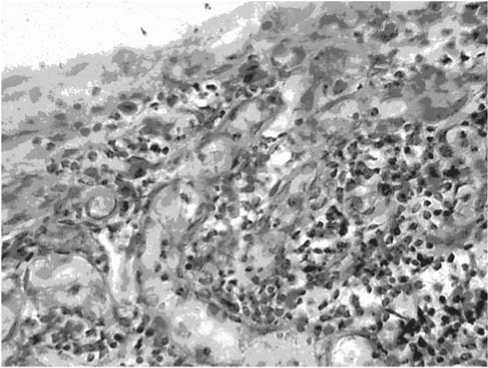
Рис. 5. Баллонная дистрофия опухолевых клеток. Больной С., 62 лет (после окончания курса внутрипузырной химиотерапии проспидином). Окраска гематоксилином и эозином. Ув. х200
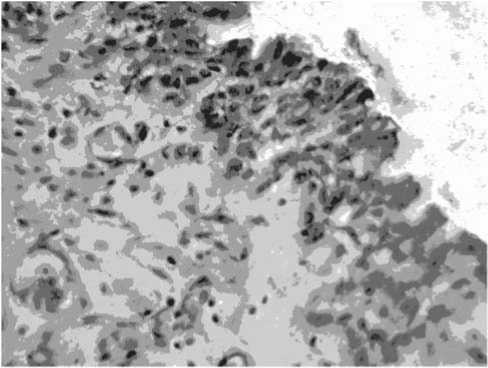
Рис. 6. Дистрофически измененные опухолевые клетки. Расширение и полнокровие мелких капилляров в зоне остатков опухоли. Больной С., 48 лет после завершения химиотерапии цисплатином. Окраска гематоксилином и эозином. Ув. х200
Материал для гистологического анализа забирался при трансуретральном исследовании с помощью щипцов универсального цистоскопа или операционной петли цисторезектоскопа. Полученные фрагменты немедленно фиксировали в 10%-ном нейтральном формалине с последующей стандартной проводкой и парафиновой заливкой. Препараты окрашивали гематоксилином и эозином. Анализировали качественные и количественные изменения опухолевой ткани. Количественная оценка терапевтического патоморфоза опухоли после химиотерапии включала изучение митотической активности клеток, процента нормальных и патологических митозов, удельного веса митозов, направленных на гибель опухолевой клетки. Для более объективной оценки повреждающего действия химиопрепарата рассчитывался индекс жизнеспособности опухолевых клеток (ИЖОК) как отношение числа “летальных” митозов к жизнеспособным [10].
Статистическую обработку полученных данных осуществляли общепринятыми методами вариационной статистики с использованием программы Microsoft Excel 2003 и Statistica 6.0. Описание качественных признаков осуществляли путем вычисления абсолютных и относительных частот. Анализ различий по количественным признакам выполняли методами множественного сравнения независимых групп (ANOVA Краскела–Уоллиса) и сравнения двух независимых групп (U-тест Манна–Уитни). Разницу значений считали статистически значимой при p<0,001.
Результаты и обсуждение
Специфических качественных изменений переходноклеточного рака мочевого пузыря, характерных для конкретного цитостатического препарата, отмечено не было.
Как указывалось выше, основной гистологической формой опухоли в исследуемых группах был высокодифференцированный переходноклеточный рак (рис. 1).
После лечения в зоне бывшей локализации опухоли эпителиальный пласт практически не определялся. В подэпителиальном слое визуализировался очаговый фиброз с отеком и формированием подобия грануляционной ткани (рис. 2).
Как видно из представленного рисунка 2, в группе больных, получивших внутрипузырную химиотерапию проспидином, также отмечалась лимфоидная инфильтрация и выраженные сосудистые изменения в виде отека эндотелия и пареза сосудов.
В группе больных, которым была проведена внутри-пузырная химиотерапия цисплатином, в зоне излеченной опухоли регистрировался грубый фиброз, напоминающий рубец (рис. 3).
Однако у пяти больных I группы и семи пациентов II группы после окончания лечения обнаруживались мелкие комплексы опухолевых клеток. У больных, получивших внутрипузырную химиотерапию проспидином, опухолевые клетки были окружены густой лимфоидной инфильтрацией и лежали разрозненно. В зоне опухоли преобладал отек. В двух случаях из I группы регистрировалась выраженная баллонная дистрофия опухолевых клеток. Но последние сохраняли свою активность, в частности отмечались отдельные фигуры митоза (рис. 4, 5).
После лечения цисплатином (II группа) у семи больных сохранилось 3–4 слоя опухолевых клеток с выраженными дистрофическими изменениями (рис. 6).
Для оценки эффективности проведенного лечения у больных с сохраняющимися после внутрипузырной химиотерапии опухолевыми очагами изучали пролиферативную активность опухолевых клеток и виды патологических митозов. Полученные результаты сравнивали с контролем (исходные показатели тех же больных до начала лечения).
Митотический индекс снижался во всех исследуемых группах. Наименьший уровень отмечен в группе больных, леченных цисплатином, – 6,2±2,9‰, что статистически значимо по сравнению с контролем – 19,6±2,6‰ (p=0,0532). Проспидин также показал тенденцию к сни- жению – 9,6±1,6‰ (p=0,2524). Удельный вес патологических митозов в обеих исследуемых группах по окончании химиотерапии был статистически значимо выше контроля. Наибольшее число патологических митозов отмечено в группе больных, получивших химиотерапию проспидином, – 49,6±2,97% (p=0475). При лечении цисплатином этот показатель оказался несколько ниже – 47,7±1,8% (p=0,0471). В контрольной группе число патологических митозов составило 27,6±2,03%.
Уровень “летальных” митозов в исследуемых группах статистически значимо вырос по сравнению с контролем. Так, в I группе число “летальных” митозов составило 22,3±1,76% (p=0,0507), во II группе – 19,78±2,02% (p=0,0532), а в контрольной группе – 7,17±1,74%.
Индекс жизнеспособности опухолевых клеток в исследуемых группах больных раком мочевого пузыря после неоадъювантной химиотерапии был статистически значимо выше контроля. Наивысший показатель зарегистрирован во II группе (цисплатин) – 3,71±0,52 (p=0,0026). В I группе (проспидин) данный показатель приближался к указанному выше – 2,97±0,47 (p=0,0239). В контрольный группе изученный показатель составил 0,83±0,12. Эти показатели говорят о том, что несмотря на деление, определенный процент опухолевых клеток выпадает из митоза (умирает), т.е. со временем может наступить гибель всей опухоли.
Выводы
-
1. Внутрипузырное введение проспидина, также как и цисплатина, снижает митотическую активность клеток переходноклеточного рака мочевого пузыря.
-
2. Уровень “летальных” митозов сравним при внутрипу-зырной химиотерапии проспидином и цисплатином и статистически значимо выше контрольных образцов.
-
3. Полученные данные позволяют использовать внутри-пузырное введение проспидина в разовой дозе 200 мг и суммарной дозе 4000 мг в клинической практике для лечения опухолей мочевого пузыря без мышечной инвазии.
Список литературы Терапевтический патоморфоз переходноклеточного рака при внутрипузырной химиотерапии проспидином и цисплатином у больных раком мочевого пузыря без мышечной инвазии
- Ваккер А.В. Отдаленные результаты применения проспидина при консервативном лечении рака гортани//Российский биотерапевтический журнал. -2008. -Т. 7, № 3. -С. 72-79.
- Селиванов С.П., Александрович И.Н., Исаева С.Н. и др. Внутрипузырное применение проспидина (ФГУП НПО "Микроген" МЗ РФ, Пермь) у больных поверхностным раком мочевого пузыря//Сборник научных трудов V Региональной научно-практической конференции урологов Сибири. -Томск, 2006. -С. 193.
- Селиванов С.П., Исаева С.Н., Ковалик Т.А. и др. Внутрипузырная химиотерапия проспидином при поверхностном раке мочевого пузыря//Материалы IV Конгресса Российского общества онкоурологов. -М., 2009. -С. 109-110.
- Барчук А.С., Гельфонд М.Л., Гершанович М.Л. и др. Комплексное лечение меланомы кожи с использованием физических методов: пособие для врачей. -СПб., 2003. -15 с.
- Матвеев Б.П., Фигурин К.М., Карякин О.Б. Рак мочевого пузыря -М.: Вердана, 2001. -243 с.
- Селиванов С.П. Диагностика и лечение поверхностного рака мочевого пузыря: автореф. дис. … докт. мед. наук. -СПб., 2001. -38 с.
- Чернов В.А. Проспидин -новое противоопухолевое средство. -М., 1973. -С. 92-226.
- Чернышев И.В. Оптимизация подходов диагностики и лечения рака мочевого пузыря: дис. … док. мед. наук. -М., 2004. -369 с.
- Серегин И.В., Матвеев В.Б., Фигурин К.М. и др. Эффективность поддерживающей внутрипузырной иммунотерапии вакциной БЦЖ после трансуретральной резекции при поверхностном раке мочевого пузыря//Матер. III Конгресса Российского общества онкоурологов. -М., 2008. -С. 116-117.
- Ялова М.Ф., Селиванов С.П. Морфологические критерии оценки эффективности местного лечения рака мочевого пузыря//Актуальные проблемы современной онкологии: матер. рег. науч. конф. -Томск, 1994. -Вып. 11. -С. 128-130.
- Lamm D., Colombel M., Persad R. et al. Clinical practice recommendations for the management of non-muscle invasive bladder cancer//Eur. Urol. -2008. -Suppl. 7. -Р. 651-666.
- Duque J.L., Loughlin K.R. An overview of the treatment of superficial bladder cancer. Intravesical chemotherapy//Urol. Clin. North. Am. -2000. -Vol. 27, No. 1. -P. 125-135.
- Oosterlinck W., Lobel B., Jakse G. et al. Guidelines on bladder cancer//Eur. Urol. -2002. -Vol. 41, No. 1. -P. 105-112.
- Horiuchi K., Tsuboi N., Shimizu H. et al. High frequency endoluminal ultrasonography for staging transitional cell carcinoma of the bladder//Urol. -2000. -Vol. 56, No. 3. -P. 404-407.


