Тератогенное влияние противоэпилептических препаратов по данным регистров врожденных пороков развития в Самарской области
Автор: Якунина Альбина Викторовна, Повереннова Ирина Евгеньевна, Ананьева Светлана Анатольевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Внутренние и экологически обусловленные заболевания
Статья в выпуске: 5-2 т.17, 2015 года.
Бесплатный доступ
Выявление тератогенных факторов является главной задачей популяционного мониторинга. Общепопуляционный уровень врожденных пороков развития (ВПР) на территории Самарской области составляет 2,6%. Нами проанализированы исходы 463 беременностей женщин с эпилепсией. Выявлено 3,7% ВПР, включая обусловленные генной и хромосомной патологией. Риск возникновения ВПР плода среди женщин без лечения составил 0,6%, на фоне приема противоэпилептических препаратов (ПЭП) в период беременности - 5,2%, был наиболее высоким на фоне приема вальпроевой кислоты - 7,8%. Семерым матерям детей с ВПР проведено типирование генов фолатного цикла MTHFR, MTRR, MTR, SLC19A1, у 6 из них обнаружены комбинации мутантных полиморфных вариантов 3-4 генов. Исследование показало, что у женщин с эпилепсией механизмы возникновения ВПР плода разнообразны и сложны, прием ПЭП из которых является лишь одним из возможных факторов.
Беременность, противоэпилептические препараты, врожденные пороки развития, гены, фолатный цикл
Короткий адрес: https://sciup.org/148204075
IDR: 148204075 | УДК: 616.853:
Текст научной статьи Тератогенное влияние противоэпилептических препаратов по данным регистров врожденных пороков развития в Самарской области
Эпилепсия – это хроническое заболевание нервной системы, требующее длительной, а иногда пожизненной лекарственной терапии. Доступность большого спектра противоэпилептиче-ских препаратов (ПЭП) на современном этапе позволяет в большинстве случаев добиться компенсации заболевания вплоть до полного прекращения приступов. Успехи лечения открывают хорошие перспективы для страдающего эпилепсией в социальном, трудовом, семейном плане, а для женщины – еще и возможность деторождения. В последние 20-25 лет распространенность эпилепсии среди беременных составляет 0,3-1% по данным разных авторов [10, 12] и имеется тенденция к ее увеличению [3]. Но именно прием ПЭП в период беременности является одной из больших проблем, требующих квалифицированного подхода и индивидуального решения. Опасения в данной ситуации касаются возможного неблагоприятного действия лекарственных препаратов на внутриутробное и постнатальное развитие плода.
Тератогенное влияние лекарственных препаратов, принимаемых женщиной во время
беременности, одна из актуальных проблем современных наук – фармакологии, тератологии, медицинской генетики и различных отраслей клинической медицины. Связь между приемом ПЭП и ВПР плода изучается с 1963 г., и к настоящему времени накоплены массивы данных по исходам беременности согласно данным регистров, когортных исследований, нескольких мета-анализов [11]. Большинство авторов говорит о повышенном в 2-3 раза риске возникновения ВПР плода на фоне приема беременной женщиной ПЭП в сравнении с общепопуляционными показателями [5, 8, 9, 13]. Увеличение риска ассоциировано с отягощенной по ВПР наследственностью [13], политерапией ПЭП [12], дефицитом фолиевой кислоты, а также мужским полом [7]. Выявлен значительный риск ВПР плода на фоне приема матерью препаратов вальпроевой кислоты (ВК) - 10,73% (95% ДИ 8,16–13,29), оказавшийся существенно более высоким, чем в популяции (2-3%) [11]. Однако признается, что основным недостатком опубликованных до настоящего времени результатов когортных исследований и регистров по врожденным порокам развития является то, что они не позволяют оценить факторы риска во всем их разнообразии (тип и частота эпилептических приступов, форма эпилепсии, семейный анамнез ВПР, проводимая терапия, исходы повторных беременностей у одной женщины и др.) [1]. В популяции в 40-60% случаев точные причины ВПР неизвестны, многофакторное влияние (генетическая предрасположенность, реализуемая под воздействием влияния окружающей среды) присутствует в 20-25% ВПР, 12-25% ВПР имеют генетические причины, 10-12% ВПР возникают под воздействием окружающей среды.
В последние годы появляются работы, в которых представлены результаты изучения индивидуальных генетических особенностей, которые могут являться факторами риска возникновения ВПР у женщин, принимающих ПЭП [2]. Полиморфные аллельные варианты генов ферментов фолатного цикла, особенно MTHFR 677С>Т, MTR2756A>G, MTRR 66A>G, приводят к снижению активности ферментов фолатного цикла у женщин фертильного возраста, что может усугубляться приемом ПЭП и приводить к повышенному риску ВПР у плода в ранние сроки гестации (I триместр), а также к летальным хромосомным мутациям и остановке беременности в ранние сроки развития со спонтанными абортами, а также к ВПР нервной трубки и носогубного треугольника (заячья губа, волчья пасть), геномным мутациям (синдром Дауна и др.) [14, 15]. Была показана высокая частота гомо- и гетерозиготных носительниц мутантных полиморфных аллельных вариантов генов фолатного цикла у женщин с эпилепсией, требующих мониторинга уровня фолиевой кислоты и гомоцистеина в крови во время планирования и вынашивания беременности [2]. Таким образом, остается актуальным разностороннее изучение возникновения случаев ВПР плода у женщин с эпилепсией, разработка персонализированного подхода к прогнозированию и профилактике ВПР.
Цель работы: изучить возможное влияние ПЭП и генетических факторов на возникновение ВПР плода.
Была проанализирована группа пациенток с эпилепсией, наблюдающихся в Самарском областном противоэпилептическом центре, и их потомство. Регистрация ВПР у живорожденных детей осуществлялась нами на основании данных клинического обследования и инструментальных методов обследования (преимущественно УЗИ). В случае пренатального выявления ВПР окончательное заключение по наличию патологии делалось либо на основании данных патологоанатомического вскрытия (в случае прерывания беременности), либо после рождения ребенка. Матерям детей с ВПР было проведено генетическое тестирование с целью оценки полиморфизма генов фолатного цикла (MTHFR, MTRR, MTR, SLC19A1). Кроме того, проведен анализ данных регистра ВПР на территории Самарской области за 15-летний период, осуществляемый в соответствии с приказом Минздрава РФ «О мониторинге врожденных пороков развития у детей» №268 от 10.09.1998 г.
За период с 2004 по 2015 гг. под наблюдением специалиста областного противоэпилепти-ческого центра находилась 384 женщины с эпилепсией, у которых было прослежено течение и исход 463 беременностей, не прервавшихся в первом триместре. Большинство пациенток страдало фокальной эпилепсией – 282 (60,9%). Наследственная отягощенность по эпилепсии была выявлена у 54 женщин (14,1%), причем родственники 1 степени родства болели у 17 женщин (нами наблюдались во время беременности 3 пары родных сестер, больных эпилепсией). К моменту возникновения беременности ремиссия эпилепсии (отсутствие каких бы то ни было эпилептических приступов) сроком от 6 месяцев до 8-10 лет диагностировалась в 192 случаях (41,5%), причем в 2 раза чаще – при генерализованной эпилепсии. В большинстве же случаев беременность возникла на фоне текущей эпилепсии. Возникающие приступы, а также недостаточно длительный период ремиссии заболевания не позволял отменить ПЭП к моменту возникновения беременности у большинства пациенток. В наших наблюдениях первый триместр беременности, значимый для формирования врожденных пороков развития (ВПР), проходил без приема ПЭП в 154 (33,3%) случаях, все остальные пациентки принимали ПЭП в различных дозировках и комбинациях (табл. 1).
Таблица 1. Терапия эпилепсии женщины, проводимая в первом триместре беременности
|
Терапия эпилепсии |
Кол-во пациенток (абс.) |
Кол-во пациенток (%) |
|
Без ПЭП |
154 |
33,3 |
|
Монотерапия, из них: |
220 |
47,5 |
|
вальпроевая кислота |
115 |
52,3* |
|
карбамазепин |
45 |
20,4* |
|
ламотриджин |
18 |
8,2* |
|
топирамат |
10 |
4,5* |
|
окскарбазепин |
7 |
3,2* |
|
барбитураты |
25 |
11,4* |
|
Политерапия, из них |
89 |
19.2 |
|
с вальпроевой кислотой |
64 |
71,9 |
Примечание: * - указано процентное соотношение в группе принимающих монотерапию
Более половины пациенток, забеременевших на фоне ПЭП, принимали препараты вальпроевой кислоты (52,3% среди монотерапии и 71,9% в случае комбинации препаратов). Это обусловлено высокой эффективностью препаратов этой группы, а также широкой доступностью. Достаточно высокий удельный вес пациенток, принимавших барбитураты, объясняется активным применением их для лечения эпилепсии 1015 лет назад. Политерапия осуществлялась путем комбинации различных препаратов, в том числе не совсем благоприятных в период беременности (вальпроевая кислота и ламотриджин). Суточные дозировки ПЭП в подавляющем большинстве не превышали среднетерапевтических, хотя были случаи беременности и на фоне высоких доз. Возникновение беременности на относительно неблагоприятном лекарственном фоне было обусловлено отсутствием планирования деторождения.
Анализируя исходы всех 463 беременностей, ВПР были выявлены в 17 случаях (3,7% от всей группы обследованных). ВПР сердца были выявлены в 5 случаях (двухкамерное сердце, тетрада Фалло, дефект межпредсердной перегородки, дефект межжелудочковой перегородки - 2), ВПР мочеполовой системы - в 4 случаях (полики-стоз почек - 2, гипоспадия - 2), ВПР костномышечной системы в 3 случаях (расщелина верхней губы и неба - 2, полидактилия), ВПР центральной нервной системы (ЦНС) - в 2 случаях
(синдром Денди-Уокера, менингоцеле в поясничном отделе), множественные ВПР - в 2 случаях, болезнь Дауна диагностирована в 1 наблюдении. Девять пороков развития диагностированы пренатально, из них 7 - на 20-22 неделе беременности, 2 случая расщелины губы и неба выявлены в 31-32 недели беременности. В 4 случаях пренатальной диагностики беременность прервана по медицинским показаниям (поликистоз почек, ВПР ЦНС - 2, множественные ВПР). Все случаи ВПР сердца диагностированы постнатально в роддоме.
Пятнадцатилетний мониторинг ВПР на территории Самарской области (1999-2014 гг.) позволил вывести базовую частоту этой патологии в нашем регионе - 2,6%, в том числе ВПР, подлежащие обязательной регистрации - 2,3% [4]. На рис. 1 представлены сравнительные данные по структуре ВПР в популяции Самарской области в целом и ВПР в изучаемой группе.
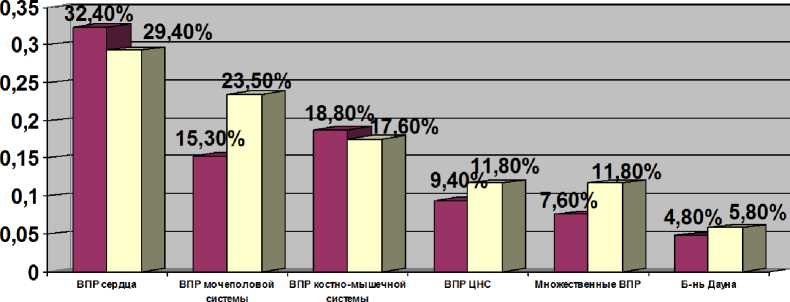
■ Популяция Самарской области □ Женщины с эпилепсией
Рис. 1. Структура врожденных пороков развития в популяции Самарской области и в группе женщин с эпилепсией
Анализ показывает, что лидирующими в обеих группах являются ВПР сердца, второе-третье места занимают ВПР мочеполовой системы и костно-мышечной системы, далее по убывающей идут ВПР ЦНС, множественные ВПР, болезнь Дауна. В группе женщин с эпилепсией не зарегистрировано ВПР желудочно-кишечного тракта плода, которые регистрируются в популяции в 3,7% случаев. Таким образом, структура ВПР потомства женщин с эпилепсией практически полностью совпадает с общепопуляционными показателями.
Нами был изучен аспект качества регистрации выявленных ВПР в регистре Самарской области, для чего проведено сопоставление данных регистра беременных с эпилепсией и регистра ВПР Самарской области. Оказалось, что 5 из 17 ВПР не были зарегистрированы в областном регистре ВПР. Среди них было 2 порока сердца (дефекты межпредсердной перегородки) и гипоспадия, выявленные постнатально. Незарегистрированной оказалась пренатально выявленная расщелина верхней губы и подтвержденная после рождения ребенка. Дефект регистрации ВПР в данных случаях является тактической ошибкой педиатров, наблюдающих детей с момента рождения. В одном случае по поводу диагностированного в 21 неделю беременности синдрома Денди-Уокера было проведено прерывание беременности, закончившееся плодоразрушающей операцией. Вероятно, плодный материал не попал в патологоанатомическое отделение, что и привело к «потере» данного случая. Таким образом, тенденция дефекта регистрации ВПР в общем регистре Самарской области позволяет предположить, что истинный уровень ВПР в популяции должен быть выше (около 4,5-5%).
Семейная отягощенность по ВПР в группе женщин с эпилепсией была выявлена в 4 случаях, причем эти случаи могут быть с высокой вероятностью отнесены к наследственным порокам с моногенным наследованием. При выявлении полидактилии у плода было выяснено, что такая же патология присутствовала у родственников по отцовской линии (отец, его ребенок от другого брака, дедушка и прабабушка), что позволило предположить аутосомно-доминантное наследование данного ВПР. В другом случае патология плода (расщелина верхней губы и неба) полностью повторяла дефект матери, по поводу которого та была прооперирована в детском возрасте. У данной женщины первый ребенок родился без ВПР. В этом наблюдении повторение подобного ВПР в двух поколениях также может указывать на моногенную мутацию, наследуемую по доминантному типу. Два других случая ВПР были выявлены в повторных беременностях у одной женщины – дважды пренатально диагностировался поликистоз почек, подтвержденный после родоразрешения. Выявление идентичных ВПР у сибсов позволяет предположить аутосомнорецессивный тип инфантильного поликистоза почек (ARPKD). Рождение ребенка с болезнью Дауна указывает на хромосомную причину патологии (трисомия по 21 хромосоме), что также может быть отнесено к группе ВПР с наследственной (генетической) причиной.
Таблица 2. Терапия матерей, на фоне которой возникли ВПР плода
|
Лечение |
Количество ВПР |
Удельный вес (%) ВПР в группе данного лечения |
|
без приема ПЭП |
1 |
0,6 |
|
на фоне приема ПЭП |
16 |
5,2% |
|
монотерапия |
12 |
5,4% |
|
вальпроевая кисто-та |
9 |
7,8% |
|
карбамазепин |
3 |
6,7% |
|
политерапия |
4 |
6,3% |
Оценка возможного тератогенного влияния ПЭП показала, что среди женщин, не принимающих лечения, возник только один случай ВПР у плода, что составило 0,6% в группе не принимающих ПЭП, остальные аномалии возникли на фоне пренатальной лекарственной экспозиции, что составило 5,2% в группе, принимающих лечение (табл. 2). В группе монотерапии удельный вес ВПР был несколько меньше (5,4%), чем в группе политерапии (6,3%). Анализ возможного риска ВПР в зависимости от группы ПЭП показал, что риск несколько выше в группе монотерапии препаратами вальпроевой кислоты (ВК), чем при приеме карбамазепина (КБЗ). Все женщины, ВПР плода которых возникли на фоне политерапии, принимали вальпроевую кислоту в комбинации с карбамазепином, ламотриджином, барбитуратом, топираматом.
Исследование аллельных вариантов генов фолатного цикла было проведено у 7 женщин с эпилепсией, потомство которых имело ВПР. Были типированы гены 5,10-метилентетра-гидрофолатредуктазы (MTHFR), метионин-синтазы (MTR), метионин-синтазы-редуктазы (MTRR) и ген-транспортер фолатов в клетку ( SLC19A1). У каждой женщины были обнаружены мутации исследованных генов в гомо- и гетерозиготном состоянии, что является характерным в целом для популяции. Обращает внимание, что у шестерых в генотипе были обнаружены комбинации мутантных полиморфных вариантов 3-4 генов. Только у одной женщины выявлена единственная мутация – гетерозиготная мутация (СТ) MTHFR 677С>T. Мутация MTHFR 677С>T, доминирующее отрицательное влияние которой на фолатный обмен доказано, была выявлена в 5 случаях. Два результата показали сочетание носительства полиморфного аллельного варианта MTHFR с.677С>Т ( Ala222Val ) с полиморфным аллельным вариантом с.1286А>С ( Glu429Ala). Считается, что у женщин фертильного возраста, страдающих эпилепсией и имеющих одновременно обе мутации (компаунд-гетерозигота), тератогенный потенциал ПЭП и риск ВПР нервной трубки пропорционально увеличиваются [6, 16]. Следует отметить, что у обеих компаунд-гетерозиготных носительниц имеются здоровые дети без ВПР, что демонстрирует возможность различных путей реализации одного и того же генотипа. В целом в группе генотипированных женщин здоровые дети имеются у пятерых, в одном случае было повторение поликистоза почек (случай был обсужден), в одном случае попыток повторных беременностей не было. У четверых женщин обе беременности проходили на фоне приема одинаковых схем ПЭП, что ставит под сомнение доминирующую тератогенную роль ПЭП. В целом сложилось впечатление, что среди женщин с эпилепсией, имеющих ВПР у потомства, носительство мутантных полиморфизмов аллелей генов фолатного цикла выявляется чаще, чем в европейской популяции, но возникновение ВПР реализуется только при сочетании факторов, из которых воздействие ПЭП является не единственным (табл. 3).
Таблица 3. Полиморфные аллельные варианты генов фолатного цикла матерей
|
ФИО |
ВПР плода |
ПЭП в период бе-ремености |
MTHFR с.677 С>T |
MTHFR c.1286 A>C |
MTRR c.66 A>G |
MTR c.2756 А>G |
SLC19A1 c.80 А>G |
|
ПЭА |
множественные ВПР |
ВК |
CТ* |
АС* |
GG* |
AA |
AG* |
|
КЕВ |
2-х камерное сердце |
КБЗ |
CC |
AC* |
GG* |
AA |
AG* |
|
КМЮ |
множественные ВПР |
ВК |
CT* |
AA |
AA |
AA |
AA |
|
КНА |
двойная расщелина губы и неба |
ВК |
CT* |
AA |
AG* |
AG* |
GG* |
|
МОВ |
б-нь Дауна |
КБЗ |
CT* |
AC* |
AA |
AA |
GG* |
|
ПОН |
менингоцеле |
ВК |
CT* |
AA |
AG* |
AA |
GG* |
|
МОЮ |
поликистоз почек (2 случая) |
ВК |
CC |
AC* |
AG* |
AG* |
AG* |
Примечание: * - обозначены варианты гомо- и гетерозиготного носительства мутантных аллельных вариантов генов
Выводы: исследование показало, что уровень возникновения ВПР плода у женщин с эпилепсией (3,7%) несколько превышает показатели Самарской области (2,6%). Выявление случаев дефекта регистрации ВПР в областном регистре демонстрирует «искусственное» занижение общепопуляционных показателей. Сходная с общепопуляционной структура ВПР плода у женщин с эпилепсией, выявление моногенных и хромосомных причин аномалий, выявление высокой частоты носительства мутантных полиморфных аллелей генов фолатного цикла позволяет предположить наличие разнообразных механизмов возникновения ВПР плода у женщин с эпилепсией. Прием ПЭП, среди которых препараты вальпроевой кислоты вызывают наибольшие опасения, является лишь одним из возможных тератогенных факторов. Женщины, страдающие эпилепсией, требуют индивидуального подхода при планировании и ведении беременности, в том числе нуждаются в тестировании генов фолатно-го цикла.
Список литературы Тератогенное влияние противоэпилептических препаратов по данным регистров врожденных пороков развития в Самарской области
- Власов, П.Н. Применение вальпроатов у женщин детородного возраста и беременных, страдающих эпилепсией//Неврология, нейропсихиатрия, психосоматика. 2015. Спецвыпуск 1. С. 4-9.
- Дмитренко, Д.В. Профилактика врожденных пороков развития плода с учетом фармакогенетических особенностей антиэпилептических препаратов и наследственных нарушений фолатного цикла//Неврология, нейропсихиатрия, психосоматика. 2014. Спецвыпуск 1. С. 31-38.
- Карлов, В.А. Терапевтическая тактика при эпилепсии во время беременности. Методические указания/В.А. Карлов, П.Н. Власов, В.И. Краснопольский и др. -М., 2001. 15 с.
- Ненашева, С.А. Итоги 10-летнего мониторинга врожденных пороков развития в Самарской области/С.А. Ненашева, О.В. Круглова, В.Н. Балашова//Материалы восьмого российского конгресса «Современные технологии в педиатрии и детской хирургии». 2009. С. 81-82.
- Ушкалова, Е.А. Применение противосудорожной терапии при беременности и кормлении грудью//Фарматека. 2002. №1. С. 43-47.
- Шнайдер, Н.А. Структура и частота встречаемости нежелательных лекарственных реакций на фоне приема противоэпилептических препаратов у женщин, больных эпилепсией/Н.А. Шнайдер, М.С. Пилюгина, Д.В. Дмитренко и др.//Проблемы женcкого здоровья. 2011. №6(2). С. 74-78.
- Battino, D. Malformation risk after monoterapy exposure to antiepileptic drugs: first report from EURAP/Battino, E. Bonizzoni, J. Craig et al.//The 9th European congresson on epileptology, Rhodes. 2010 -URL: http: www.abstractserver.com/ece2010/planner/
- Ganger, R. Malformations in offspring of women with epilepsy a prospective study./R. Ganger, D. Battino, M.P.Canevini et al.//Epilepsia. 1999. V. 40. P. 1231-1236.
- Holmes, L.B. The teratogenisity of anticonvulsant drugs/L.B. Holmes, E.A. Narvey, B.A. Coull et al.//N. Engl. J. Med. 2001. № 344. P. 1132-1138.
- Jerby, M.S. Pregnancy, teratogenesis and epilepsy//Neurol. Clin. 1994. Vol. 12. P. 749-771.
- Meador, K. Pregnancy outcomes in women with epilepsy: a systematic review and meta-analysis of published pregnancy registries and cohorts/K. Meador, M.W. Reynolds, S. Crean et al.//Epilepsy Res. 2008. Sep. №81(1). Р. 1-13
- Tomson, T. Epilepsy in pregnancy/T. Tomson, V. Hiilesmaa//BMJ. 2007. Vol. 335. P. 769-773.
- Tomson, T. Dose-dependent risk of malformations with antiepileptic drugs: an analysis of data from the EURAP epilepsy and pregnancy registry/T. Tomson, Battino, E. Bonnizoni et al.//Lancet Neurol. 2011. №10(7). Р. 609-617.
- Shi, Q. L-homocysteine sulfinic acid and other acidic homocysteine derivatives are potent and selective metabotropic glutamate receptor agonists/Q. Shi, J.E. Savage, S.J. Hufeisen et al.//J. Pharmacol. Exp. Ther. 2003. №305(1). Р.131-142.
- Gueant-Rodriguez, R.M. Transcobalamin and methionine synthase reductase mutated polymorphisms aggravate the risk of neural tube defects in humans/R.M. Gueant-Rodriguez, C. Rendeli, B. Namour et al.//Neurosci. Lett. 2003. №334(3). Р.189-192.
- Kluijtmans, L.A. Molecular genetic analysis in mild hyperhomocysteinemia: a common mutation in the methylenetetrahydrofolate reductase gene is a genetic risk factor for cardiovascular disease/L.A. Kluijtmans, L.P. van den Heuvel, G.H. Boers//Am. J. Hum. Genet. 1996. V. 358(1). Р. 35-41.


