Термические свойства фаз системы Zn2V207 - Cu2V207
Автор: Иванова А.Н., Ротермель М.В., Красненко Т.Н., Сивцова О.В., Викторов В.В.
Рубрика: Химия
Статья в выпуске: 19 (91), 2007 года.
Бесплатный доступ
Методами дифференциально-термического и высокотемпературного рентгенофазового анализа исследован фазовый состав системы Zn2V207 -Cu2V207 в субсолидусной области. Определены границы областей существования твердых растворов на основе всех модификаций пированадатов меди и цинка, установлен их характер плавления.
Короткий адрес: https://sciup.org/147158521
IDR: 147158521 | УДК: 546.881.548.
Текст научной статьи Термические свойства фаз системы Zn2V207 - Cu2V207
В последние годы обнаружены и интенсивно исследуются сложные оксидные соединения с близким к нулевому и отрицательным коэффициентом объемного термического расширения (ОКОТР). Их применение возможно в устройствах, работающих в условиях перепада температур и термических ударов. Однако близкое к нулевому и отрицательное объемное термическое расширение материалов при температурах выше комнатной и нормальном давлении встречается довольно редко и характеризуется как аномальное. Нами обнаружено, что ОКОТР присущ пированадатам меди Cu2V2O7 и цинка Zn2V2O7. Материаловедческий интерес, как к данным соединениям, так и к твёрдым растворам на его основе определили цель настоящего исследования: изучение взаимной растворимости пированадатов меди и цинка и термических свойств твёрдых растворов на их основе методами рентгенофазового и дифференциально-термического анализов.
Конгруэнтное плавление Cu2V2O7 происходит, согласно [1], при 780 °C, что не совпадает с мнением авторов [2], полагающих, что пированадат меди плавится с разложением при 740 °C. Исследования, проведённые в [3] показали, что в интервале температур от комнатной до 770 °C пированадат меди кристаллизуется в трех полиморфных модификациях - a-Cu2V2O7, P'-Cu2V2O7 и P-Cu2V2O7, одна из которых, P-Cu2V2O7, является метастабильной и образуется при охлаждении от температур выше температуры фазового а—>Р' перехода 715±5 °C. Низкотемпературная а-модификация пированадата меди принадлежит орторомбической сингонии, пр. гр. Fddl [4], высокотемпературная P'-Cu2V2O7 [3], также как и закалочная Р-фаза [5], кристаллизуется в моноклинной сингонии, пр.гр. С2/с. Плавящийся конгруэнтно при 890 °C Zn2V2O7, претерпевает фазовый переход I рода при 610±5 °C [6, 7], кристаллизуясь ниже этой температуры в моноклинной сингонии, пр. гр. С2/с, a-Zn2V2O7 [8], выше - также в моноклинной сингонии, но с пр.гр. C2/m, Р-Zn2V2O7 [9]. Сходство всех структурных модификаций Zn2V2O7 и Cu2V2O7 состоит в том, что ванадий-кислородные тетраэдры соединены попарно общим атомом кислорода, причем угол V -ОМост - V равен 180° для P-Zn2V2O7 (структура тортвейтита), в остальных случаях он меньше развернутого (структура бихромата калия).
Необходимо отметить некоторые особенности синтеза пированадата меди: однофазные образцы низкотемпературной a-Cu2V2O7 могут быть получены твердофазным способом при изотермическом отжиге при температурах, не превышающих температуру фазового а—>Р* перехода, с последующим медленным (2°/мин) охлаждением [10-13]. Формирование P-Cu2V2O7 происходит при быстром охлаждении от температур существования P'-Cu2V2O7 либо предварительно синтезированной a-Cu2V2O7, либо прокаленной при 730 - 750 °C в течение 10 часов стехиометрической смеси оксидов меди (II) и ванадия (V) [5, 12, 14].
Информация о фазовой диаграмме системы Zn2V2O7 - Cu2V2O7 в литературе отсутствует. Прологом для ее построения могут служить фрагментарные сведения о формировании твердых растворов на основе исходных ванадатов. Протяжённость твёрдого раствора на основе a-модификации Cu2V2O7 по данным [15] составляет 7 мол.% Zn2V2O7, область гомогенности a-Zn2 2xCu2XV2O7 при комнатной температуре ограничена 35 мол.% Cu2V2O7 [16]. Исследования, проведённые при повышенных температурах показали, что до 700 °C атомы цинка практически не замещают атомов меди в p-Cu2V2O7, тогда как замещение в a-Zn2V2O7 достигает 85 мол.% Cu2V2O7 [17]. Дальнейшее повышение температуры приводит к образованию непрерывного твёрдого раствора замещения со структурой тортвейтита, пр.гр. Cl/с. Однако в [18] показано, что серия твёрдых растворов является непрерывной уже при комнатной температуре. Необходимо от-
|
1. 7 |
||||||||
|
1 3 1 1 |
||||||||
|
. I . Il 1 |
1 |
4 |
||||||
|
1 |
5 |
|||||||
|
hl 1 1 I . |
6 |
|||||||
|
-11 1 1 |
1 1 . |
7 |
||||||
|
1 |
8 |
|||||||
|
t 11., |
1 11 1 1 |
Il |
1 , |
9 |
||||
|
1 |
10 |
|||||||
|
1 1 ,, 1 1 III |
1 |
I |
H 1 I 1 |
|||||
|
1 |
f |
12 < < 1 , , |
||||||
|
В |
||||||||
|
1 t 1 I e 11 |
1 |
14 |
||||||
|
1 |
15 |
|||||||
|
j | | | |
1 |
1 .II76 |
||||||
26, град
Рис. 1. Дифрактограммы образцов твёрдых растворов системы Cu2V2O7 - Zn2V2O7 при комнатной температуре: 1 - P-Zn2V2O7; 2 - a-Zn2V2O7; 3-10 мол. % Cu2V2O7; 4-20 мол. % Cu2V2O7; 5 - 30 мол. % Cu2V2O7; 6-35 мол. % Cu2V2O7; 7-40 мол. % Cu2V2O7; 8-50 мол. % Cu2V2O7; 9-60 мол. % Cu2V2O7;
10 - 70 мол. % Cu2V2O7; 11-80 мол. % Cu2V2O7;
12- 85 мол. % Cu2V2O7; 13- 90 мол. % Cu2V2O7;
14 - a-Cu2V2O7; 15 - p'-Cu2V2O7 (740°C in situ\, 16 - p-Cu2V2O7
метить, что образцы Cu2-2XZn2xV2O5 в [18] были получены при температурах синтеза выше фазового перехода при (715±5) °C, расплавлены и затем закалены. Учитывая возможность инконгру-энтного плавления пированадата меди [2] и твердых растворов на его основе, интерпретация результатов авторов [18] может быть неоднозначной. В [17] также сообщается, что плавление образцов твёрдых растворов Cu2-2xZn2xV2O5 сопровождается потерей кислорода.
Синтез образцов твёрдых растворов Cu2-2XZn2xV2O7 осуществляли твёрдофазным методом из a-Cu2V2O7 и a-Zn2V2O7 при температуре отжига 650 °C. Последние получали из оксидов СиО (ос.ч.), ZnO (ос.ч.) и V2O5 (ос.ч.), взятых в необходимых пропорциях по описанной выше методике и [19]. Образцы идентифицировали рентгенографически.
Для определения областей гомогенности твёрдых растворов системы Cu2V2O7 - Zn2V2O7 синтезировано 15 образцов с переменным шагом. Шаг 2,5 мол.% был выбран для составов, прилегающих к исходным пированадатам и в областях, где, согласно [15-17], проходит граница раздела фаз между бихроматотоподобными структурами. Остальные образцы синтезированы с шагом 10 мол.%.
Согласно данным РФА (рис. 1), при комнатной температуре образцы с содержанием от 2,5 до 30 мол.% Cu2V2O7 принадлежат структуре a-Zn2V2O7. Интервал концентраций от 35 до 92,5 мол. % Cu2V2O7 является областью гомогенности твёрдого раствора на основе P-Cu2V2O7. Разрыв смесимости a-модификации Zn2V2O7 и Р-Cu2V2O7 происходит вблизи состава с содержанием 32±2 мол.% Cu2V2O7. Образец твёрдого раствора, содержащий 2,5 мол.% Zn2V2O7, кристаллизуется в структуре a-Cu2V2O7.
При нагревании исследуемых образцов твёрдых растворов на кривых ДТА в области температур 600-650 °C обнаружены термические эффекты, величины которых не превышают 10 кДж/моль (рис. 2). Эндотермические эффекты для составов с 10 и 20 мол. % Cu2V2O7, кристаллизующихся при комнатной температуре в структуре a-Zn2V2O7, наблюдаются при 610 и 612 °C соответственно. ДТА образцов, содержащих от 40 до 90 мол.% Cu2V2O7 из области сосуществования твёрдого раствора на основе P-Cu2V2O7 показал наличие эндоэффектов с постепенно возрастающей от 602 до 618 °C температурой. На поли-терме ДТА образца P-Cu2V2O7 обнаружен хорошо обратимый эндотермический эффект при 628 °C соответствующий, по-видимому, полиморфному превращению P^P'-Cu2V2O7. Таким образом, допирование пированадата меди катионами Zn2+, имеющими больший радиус, приводит к понижению температуры фазового р—»Р' перехода, соответственно замещение Zn2+ катионами Си2+ в a-Zn2V2O7 ведёт к некоторому повышению температуры фазового a—>P-Zn2V2O7 перехода.
Химия
900-тт-
3,5
800 -
3,0
♦
О 700 -
2,5
2,0
600-
1,5
500 -40
mol. %, Cu2V2O7
Рис. 2. Результаты термоаналитических исследований твёрдых растворов Cu2-2xZn2xV2O7: , • л * температуры термических эффектов на кривых ДТА,
♦- величина убыли массы при плавлении
^.ihn.i, .ДПы
зо
29, град
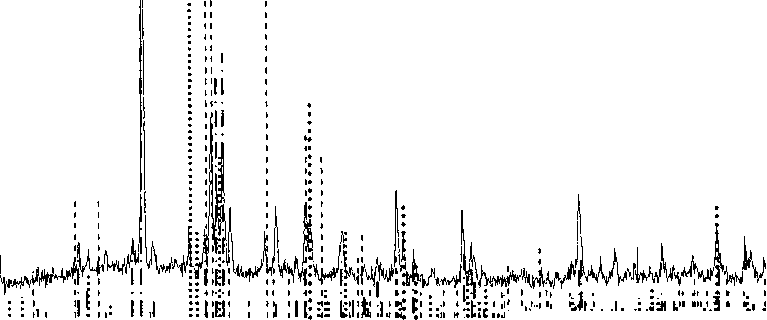
Рис. 3. Дифрактограмма образца пированадата меди, закалённого от 790 °C
P-CU2V2O7,
Cu3(VO4)2,
O-CU2V2O7,
CU3VO4
В предплавильной области на кривой ДТА пированадата меди фиксируется два значительных по величине (20-50 кДж/моль) эндотермических эффекта при 780±5 и (800±5) °C. Рентгено- фазовый анализ при комнатной температуре образца расплава Cu2V2O7 закалённого от 790 °C (рис. 3) позволил идентифицировать следующие фазы: |3-Cu2V2O7, Cu3(VO4)2, a-Cu2V2O7, Cu3VO4. Следовательно, первый эффект (780±5) °C на политерме ДТА Cu2V2O7 соответствует началу ин-конгруэнтного плавления, а второй (800±5) °C полному исчезновению твёрдой фазы.
Плавление образцов как чистого Cu2V2O7, так и твёрдых растворов на его основе сопровождается необратимой убылью массы, величина которой постепенно уменьшается от 3,35% до нуля с ростом концентрации пированадата цинка (см. рис. 2), что может быть обусловлено выходом в газовую фазу компонентов соединения. Потеря массы и наличие двойных эндотермических эффектов на кривых ДТА всех исследованных в настоящей работе твёрдых растворов на основе пированадата меди позволяет предположить, что они также плавятся с разложением. При плавлении Zn2V2O7 и составов из области твердых растворов на его основе уменьшение массы не наблюдается.
Таким образом, в данной работе определены температурные и концентрационные пределы существования твердых растворов на основе пированадатов меди и цинка, определен характер плавления как исходных пированадатов, так и твердых растворов на их основе.
Работа выполнена при поддержке фонда РФФИ, проект № 07-03-01-063а.
Список литературы Термические свойства фаз системы Zn2V207 - Cu2V207
- Fleury,P.//C.r. Acad. sci. С. -1966. -V. 263С. -№ 11. -P. 1375.
- Ivanova,Y.Y., Dimitriev Y.B. et al//C.r. Acad. sci. (Bulg.). -1974. -V. 27, № 4. -P. 491.
- Петрова, C.A./C.A. Петрова, Р.Г. Захаров и др.//ДАН. 2005. -Т. 400, № 6. -С. 770.
- Calvo, С./С. Calvo, R. Faggiani//Acta Cryst. -1975. -В 24. -P. 603.
- Mercurio-Lavaud, D./D. Mercurio-Lavaud, B. Frit//С R. Acad. Sc. Paris. Serie С -1973. -V. 277.-P. 1101.
- Макаров В.А., Фотиев А.А. и др.//Журн. неорган, химии. -1971. -Т. 16, № 10. -С. 2849.
- KurzawaM. et al//J. Thermal Analysis and Calorimetry. -2001. -V. 64.-P. 1113.
- Copal, R./R. Copal, С Calvo//Canad. J. Chem. -1973. -V. 51. -P. 1004.
- Красненко, Т.И./Т.И. Красненко, В.Г. Зубков, А.П. Тютюнник и др.//Кристаллография. -2002.-Т. 48, № 1.-С.35.
- Mercurio-Lavaud, D./D. Mercurio-Lavaud, В. Frit//Acta Cryst. -1973. -В 29. -P. 2737.
- Eguchi, M./M. Eguchi, M. Yamaguchi, T. Miura, T. Kishi//Denki Kagaku. -1993. -V. 61, №12.-P. 1347.
- Benko, F.A./F.A. Benko, F.P. Koffyberg//Can. J. Phys. -1992. -V. 70. -P. 99.
- Ponomarenko L.A., Vasil'ev A.N, Antipov E.V. et al//Physica В 284 -288. -2000. -P. 1459.
- Waal de D, Hutter С // Mat. Res. Bull. - 1994. - V. 29. - № 8. - P. 843.J. Pommer, V. Kataev, K.-Y. Choi, P. Lemmens et al // Physical Review. - 2003. - В 67. -214410.
- Nord, A.G./A.G. Nord, T. Stefanidis//Mater. Res. Bull. -1985. -V. 20, № 7. -P. 845.
- Снегирев А.И, Фотиев А.А, Журавлев В.Д. и др.//Огнеупоры. -1987. -№ 6. -С. 49.
- Schindler, М./М. Schindler, F.C. Hawthorte//J. Solid State Chem. -1999. -V. 146. -P. 271.
- Фотиев А.А. Ванадаты. Состав, синтез, структура, свойства/А.А. Фотиев и др. -М.: Наука.-1988.-272 с.


