Термодинамический анализ равновесных процессов в сложных природных системах
Автор: Каржавин В.К., Волошина З.М.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 1 т.5, 2002 года.
Бесплатный доступ
Статья посвящена исследованию возможностей использования метода расчета термобарометрических параметров природных метаморфических процессов. Несколькими примерами показано выполнение условий равновесия в одной точке на Р-Т плоскости, хорошо коррелирующей с химической информацией о равновесиях. Это позволяет определять состояние равновесия между минералами в образцах исследуемой системы.
Короткий адрес: https://sciup.org/14293453
IDR: 14293453
Текст научной статьи Термодинамический анализ равновесных процессов в сложных природных системах
-
1. Введение
-
2. Методика исследования
Использование недостаточно полной информации при определении термодинамических условий образования природной системы может повлиять на достоверность результатов исследования. При традиционном подходе в расчётах обычно учитывается только часть химических соединений, которые могут принимать участие в реакциях. Но неучтённые соединения могут оказать существенное влияние на давление и температуру. Поэтому выбор количества компонентов в исследуемой системе должен обеспечить возможность составления всех реакций, что позволит получить достоверный результат. В этой связи наиболее привлекательным нам представляется метод TWQ ( Berman , 1991). Данный метод оценивает равновесное состояние из сравнения поведения констант равновесия ( Кр как функция Р и Т ) химических реакций, возможных в данной системе, и позволяет осуществлять расчёт величин давления и температуры по химическому составу всех присутствующих фаз (соединений). Метод использует обширную внутренне согласованную базу термодинамических характеристик химических соединений. В основу расчёта положены следующие уравнения:
Термодинамическим исследованиям отводится важная роль при анализе процессов, сопровождаемых химическими и фазовыми превращениями в широком интервале температур и давлений. Для равновесных или локально равновесных процессов расчёт параметров состояния позволяет с относительно высокой точностью моделировать реальные условия и представлять информацию, которую обычно трудно получить экспериментальным путём. В связи с этим путём расчёта проводится предварительная оценка наличия сосуществующих в условиях равновесия химических соединений в реагирующей смеси. Действительно, исследованиям, например, синтеза новых химических соединений при высоких давлениях и температуре обычно предшествует детальный термодинамический и кинетический анализ путей решения поставленной задачи.
Принято считать, что "...состав и термодинамические свойства равновесных продуктов однозначно зависят от элементарного состава, температуры и давления" ( Зельдович , 1938). Это же соотношение является главным и при решении обратной задачи химического равновесия. Это позволяет широко использовать термодинамические методы исследования для решения некоторых геологических задач. Оценка температуры и давления среды (термобарометрический расчёт), при которых происходило образование минералов, является важной задачей для прогнозирования протекающих в природных условиях постмагматических (метаморфических) процессов. Для данной цели исследуют химический состав совместно присутствующих в природном образце минералов и осуществляют расчёт на основании констант равновесия химических реакций. Так, для определения зависимости константы равновесия от температуры при постоянном давлении обычно использовали следующее уравнение: d (ln Kp ) / dT = Δ H / RT 2. Для случая изотермических условий зависимость константы равновесия от давления выглядит следующим образом: d (ln Kp ) / dP = Δ V / RT .
T = [ΔHo + ΔVo (P-1)] / (ΔSo - RlnKp), P = (- RTlnKp - ΔHo + TΔSo) / ΔVo, где ΔHo, ΔSo и ΔVo - изменение энтальпии, энтропии и объёма соединений, участвующих в реакции.
Отсюда находятся константы равновесия химических реакций как функции температуры и давления. При равновесии в исследуемой системе расчётные кривые констант равновесия должны пересечься на Р-Т плоскости в одной точке. В данном случае равновесие среды определяется фазовым и химическим составами, а уравнения, определяющие Р , Т и составы равновесных фаз в точке пересечения, получаются из условия равенства химических потенциалов компонентов системы во всех фазах. Если по результатам расчёта исследуемая система является неравновесной, то на Р-Т плоскости за счёт смещения кривых констант равновесия образуется некоторая область, размеры которой пропорциональны степени отклонения системы от состояния равновесия. Возможности метода позволяют решать и обратную задачу, т.е. по известным значениям температуры и давления установить, существует ли равновесие в исследуемом объекте или системе. В данной работе проведена оценка возможностей метода TWQ на примере одного из природных объектов Кольского полуострова.
Основой для исследований явилось детальное петрографическое и микрозондовое изучение химического состава минеральных фаз. В процессе модельных исследований предусмотрено решить задачу по определению Р-Т параметров превращения исследуемого природного объекта во вторичные (метаморфические) минералы в присутствии летучих компонентов при равновесных условиях. Метаморфическая система, как сложная природная система, рассматривается как результат эволюционирования совокупности всевозможных взаимосвязанных процессов. В качестве примера для исследования мы использовали образец (Панская интрузия, Кольский полуостров), имеющий следующую минеральную ассоциацию: плагиоклаз, амфиболы, серпентины, хлорит, клиноцоизит. Химический состав некоторых минеральных фаз представлен в таблице.
|
SiO 2 Al 2 O 3 FeO MgO CaO Na 2 O K 2 O |
|
|
Амфибол 1 Амфибол 2 Клиноцоизит Плагиоклаз |
53.40 5.36 11.00 15.61 12.51 0.74 0.18 52.85 6.45 10.86 15.01 11.95 0.90 0.20 40.37 24.72 10.26 0.15 22.76 0.27 0.00 55.58 28.30 0.00 0.00 10.38 5.74 0.00 |
Как видно из таблицы, исследуемая минеральная система представлена следующим элементарным составом: Si, Al, Fe, Ca, Mg, Na, K, H, O. В соответствии с петрографическим составом природного образца для расчёта в исследуемую систему на начальном этапе были включены следующие минералы: NaAlSi 3 O 8 (альбит), CaAl 2 Si 2 O 8 (анортит), Ca 2 Fe 5 Si 8 O 22 (OH) 2 (актинолит), Ca 2 Mg 5 Si 8 O 22 (OH) 2
(тремолит), Ca2Al3Si3O12(OH) (клиноцоизит), Ca2FeAl2Si3O12(OH) (эпидот), Fe3O4 (магнетит) и SiO2 ( α -кварц). Термодинамические характеристики перечисленных соединений брались из совмещённой базы данных метода TWQ, в которую внесён справочный материал из ( Holland and Powell , 1990).
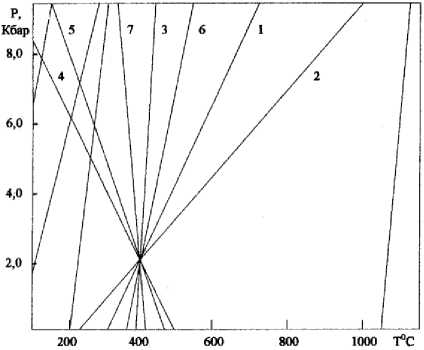
Рис. 1. Р - Т диаграмма химических реакций системы (подробности в тексте)
На начальном этапе исследования был рассмотрен вариант "сухой" (безводной) минеральной системы. Моделирование показало, что химическое взаимодействие между указанными компонентами отсутствует. При последовательном введении в указанную минеральную систему летучих компонентов (воды, водорода и кислорода) было отмечено протекание многочисленных химических реакций. Было установлено, что значительное усложнение химического состава системы приводит к её постепенному отходу от равновесного состояния. В связи с этим истинные Р - Т параметры в сильно усложнённой системе оценить оказалось невозможным. Для системы, в которой присутствуют все летучие компоненты, расчет показал наличие ряда химических реакций и отсутствие равновесия. Детальный анализ позволил установить, что отклонение системы от равновесных условий обусловлено реакциями, в которых принимал участие водород.
Термодинамическим расчётом системы при отсутствии водорода установлено, что остальные химические соединения могут находиться между собой в состоянии равновесия при Т = 404°С и Р = 2.18 Кбар (рис. 1). При этих параметрах существуют семь реакций (из одиннадцати), константы равновесия которых на Р - Т диаграмме пересеклись в одной точке (их номера показаны на кривых рис. 1):
26 CaAl 2 Si 2 O 8 + 10 Ca 2 FeAl 2 Si 3 O 12 (OH) + Ca 2 Fe 5 Si 8 O 22 (OH) 2 + 6 Н 2 О =
= 24 Ca2Al3Si3O12(OH) + 5 Fe3O4 + 18 SiO2
24 Ca2Al3Si3O12(OH) + 4 Fe3O4 + 12 SiO2 + О2 = 24 CaAl2Si2O8+ 12 Ca2FeAl2Si3O12(OH) + 6 Н2О(2)
2 CaAl2Si2O8+ Ca2Fe5Si8O22(OH)2 + О2= 2 Ca2FeAl2Si3O12(OH) + Fe3O4+ 6 SiO2
2 Ca 2 Fe 5 Si 8 O 22 (OH) 2 + 24 Ca 2 Al 3 Si 3 O 12 (OH) + 2 Fe 3 O 4 + 3 О 2 =
= 20 CaAl2Si2O8 + 16 Ca2FeAl2Si3O12(OH) + 6 Н2О(4)
12 Ca 2 Fe 5 Si 8 O 22 (OH) 2 + 24 Ca 2 Al 3 Si 3 O 12 (OH) + 13 О 2 =
= 36 Ca2FeAl2Si3O12(OH) + 8 Fe3O4+ 60 SiO2 + 6 Н2О(5)
36 CaAl 2 Si 2 O 8 + 6 Ca 2 Fe 5 Si 8 O 22 (OH) 2 + 6 Н 2 О + 5 О 2 =
= 24 Ca2Al3Si3O12(OH) + 10 Fe3O4+ 48 SiO2
24 Ca 2 Al 3 Si 3 O 12 (OH) + 4 Ca 2 Fe 5 Si 8 O 22 (OH) 2 + 5 О 2 =
= 16 CaAl2Si2O8+ 20 Ca2FeAl2Si3O12(OH) + 12 SiO2 + 6 Н2О(7)
В химических реакциях (1-7) отсутствуют соединения, содержащие натрий и магний. Это явилось результатом недостаточно корректного отбора в исследуемую систему химических соединений, которые могли бы принять участие в реакциях. Вместе с тем следует отметить, что установленное химическими реакциями (1-7) равновесие можно считать действительным для системы с указанным составом минералов, но при отсутствии в ней альбита и тремолита. Поэтому была предпринята попытка ввести химические соединения, содержащие натрий и магний. В исследуемую систему вводились отдельно и попарно Na- и Mg-содержащие минералы: паргасит, магнезиорибекит, эденит, глаукофан. Было установлено, что всякое усложнение системы также способствует выводу её из состояния равновесия. Равновесное состояние в системе, содержащей минералы всех указанных элементов, было установлено после замены актинолита (активно участвующего в реакциях 1, 3-7) на паргасит [NaCa 2 Mg 4 Al 3 Si 6 O 22 (OH) 2 ]. Расчёты показали, что равновесное состояние в откорректированной системе определяется следующими химическими реакциями:
4 Ca 2 Mg 5 Si 8 O 22 (OH) 2 + 14 CaAl 2 Si 2 O 8 + 5 NaAlSi 3 O 8 + 4 Н 2 О =
= 6 Ca2Al3Si3O12(OH) + 5 NaCa2Mg4Al3Si6O22(OH)2 + 27 SiO2
24 Ca 2 Al 3 Si 3 O 12 (OH) + 4 Fe 3 O 4 + 12 SiO 2 + O 2 =
= 12 Ca2FeAl2Si3O12(OH) + 24 CaAl2Si2O8+ 6 Н2О(9)
12 Ca 2 Mg 5 Si 8 O 22 (OH) 2 + 30 Ca 2 Al 3 Si 3 O 12 (OH) + 15 NaAlSi 3 O 8 + 8 Fe 3 O 4 +2 О 2 =
= 6 CaAl2Si2O8 +24 Ca2FeAl2Si3O12(OH) + 15 NaCa2Mg4Al3Si6O22(OH)2 + 57 SiO2
6 Ca 2 Mg 5 Si 8 O 22 (OH) 2 + 192 Ca 2 Al 3 Si 3 O 12 (OH) + 20 NaAlSi 3 O 8 + 36 Fe 3 O 4 + 9 О 2 =
= 160 CaAl2Si2O8+ 108 Ca2FeAl2Si3O12(OH) + 20 NaCa2Mg4Al3Si6O22(OH)2 + 38 Н2О(11)
48 Ca 2 Mg 5 Si 8 O 22 (OH) 2 + 96 Ca 2 Al 3 Si 3 O 12 (OH) + 60 NaAlSi 3 O 8 + 28 Fe 3 O 4 + 6 Н 2 О + 7 О 2 =
= 84 Ca2FeAl2Si3O12(OH) + 60 NaCa2Mg4Al3Si6O22(OH)2 +240 SiO2
Ca 2 Mg 5 Si 8 O 22 (OH) 2 + 32 CaAl 2 Si 2 O 8 + 20 NaAlSi 3 O 8 + 4 Fe 3 O 4 + 10 Н 2 О + О 2 =
= 12 Ca2FeAl2Si3O12(OH) + 20 NaCa2Mg4Al3Si6O22(OH)2 + 96 SiO2
В связи с тем, что паргасит является более высокотемпературным минералом по сравнению с исключёнными соединениями, его появление в системе вызвало смещение ранее установленных параметров в область более высокой температуры.
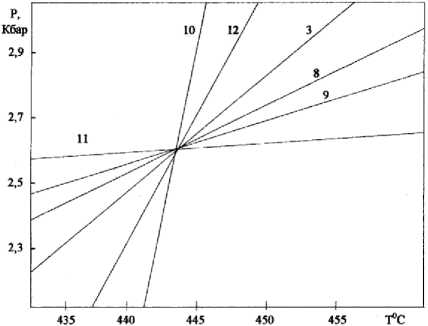
Рис. 2. Оценка Р - Т параметров природного образца согласно установленному равновесию в системе
Кривые констант равновесия химических реакций (8-13) на Р - Т диаграмме, как следует из рис. 2, пересеклись в одной точке при Т = 443°С и Р = 2.62 кбар.
4. Выводы
По данным фазового и химического состава исследуемого объекта теоретическими расчётами установлены температура и давление среды образования минералов в природных условиях. Показаны возможности термодинамического расчёта параметров равновесия по результатам химического анализа и химических реакций, протекающих в исследуемой системе. Отмечается, что определение величин давления и температуры возможно при условии детальных микрозондовых и петрографических анализов, а также при корректной постановке задачи.


