Термодинамический анализ реакции водяного газа
Автор: Кузнецов Юрий Серафимович, Михайлов Геннадий Георгиевич, Качурина Ольга Ивановна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 1 т.14, 2014 года.
Бесплатный доступ
Возможные равновесные концентрации водяного газа и концентрации газа, полученного нагреванием смесей Н 2 - СО 2 и Н 2О - СО разных составов, представлены номограммами. Номограммы позволяют определить кислородный потенциал газовой фазы и условия восстановления оксидов металлов.
Водяной газ, условия получения, кислородный потенциал, восстановление оксидов
Короткий адрес: https://sciup.org/147156852
IDR: 147156852 | УДК: 669.1.(075.8)
Текст научной статьи Термодинамический анализ реакции водяного газа
Водяной газ – четырехкомпонентная смесь Н2 – Н2О–СО–СО2 – является основой газовых атмосфер во многих металлургических технологиях. Параметры равновесия реакции водяного газа
H 2 + CO 2 = H 2 O + CO достаточно просто рассчитываются с использованием константы равновесия:
p H 2 O p CO (% H 2 O)(% CO)
K n (1) = K (1) =--------=---------------= p c pH2 pCO2 (%H2)(%CO2)
понентов водяного газа, удовлетворяющих соотношениям (4). Получить водяной газ нужного состава можно нагреванием до заданной температуры смеси «Н2, a 0 моль – СО2, d 0 моль» при исходных концентрациях x co = x Н2о = 0; или смеси «Н2О, b 0 моль – СО, c 0 моль» при исходных концентрациях x Н2 = X co2 = 0. Подтвердим это чис-
x H2O x CO x H2 x CO2
A G (1) e RT
ленными расчетами.
Пусть смесь водорода и углекислого газа нагревается до заданной температуры в реакторе любого объема при любом давлении:
Стандартное изменение энергии Гиббса (Дж) для реакции водяного газа с учетом температурных зависимостей тепловых эффектов реакций, изменения энтропии и теплоемкостей газов [1, 2]
A rGT (1) = 47 584 - 1,263 • 10 - 3 T 2 - 3,963 0—
Н 2 + СО 2 = Н 2 О + СО
Исходный состав a 0 d 0 – –
Равновесный состав a 0 – x d 0 – x x x
Здесь a 0 и d 0 – числа молей Н 2 и СО 2 в исходной смеси. Если для простоты расчетов положить a 0 + d 0 = 1 моль, тогда a 0 – x , d 0 – x , x и x – моляр-
- 132,956 T + 13,011 T In T . (2)
Довольно часто в практических расчетах используют приближенные уравнения. Например, для реакции водяного газа в справочниках и научной литературе рекомендуется пользоваться приближенным линейным уравнением [2]
A rG T (1) = 36 580 - 33,465 T . (3) Результаты расчетов по уравнениям (2) и (3) хорошо совпадают при температурах ниже 1200 К. Поэтому при расчетах процессов твердофазного восстановления, например оксидов железа (особенно в присутствии углерода), допустимо использование приближенного уравнения (3).
Если переписать константу равновесия реакции водяного газа в таком виде:
K 1 = xco/xco^, xco = K JH., (4) xH2 xH2O xCO2 xH2O то количественную информацию о равновесии реакции при разных температурах можно представить номограммой, на которой изотермы – прямые линии, угловой коэффициент которых равен константе равновесия (рис. 1). График на рис. 1 иллюстрирует важную особенность равновесия реакции водяного газа – для любой температуры возможно множество концентраций ком-
ные доли компонентов равновесного водяного газа. Получаем для константы равновесия
K 1 =
.
( a 0 - x )( d 0 - x )
Решение этого квадратного уравнения (при
K 1 * 1) представляется уравнением
x CO = x Н2О =
0,5 K 1
1 - K
±
K 1 a 0 d 0 +1 0,5 K 1 | (6)
1 - K 1 ( 1 - K 1 ) . 1
Из результатов вычислений по этому уравнению следует, что физический смысл имеет один из двух корней, причем для K 1 < 1 перед квадратным корнем следует ставить знак «+», а для K 1 > 1 - знак «-». При K 1 = 1 (1093 К) из уравнения (5) получается a 0 d 0
x a 0 + d 0.
Результаты расчетов составов равновесного водяного газа для трех температур представлены в табл. 1–3 и точками для разных соотношений a 0 / d 0 на соответствующих изотермах номограммы на рис. 1. Для примера на рис. 2 представлены результаты расчетов для температуры 1093 К. Рис. 3 отмечает еще одну важную особенность – сумма концентраций газов-восстановителей и сумма концентраций газов-окислителей зависят только от состава нагреваемой смеси, но не зависят от температуры.
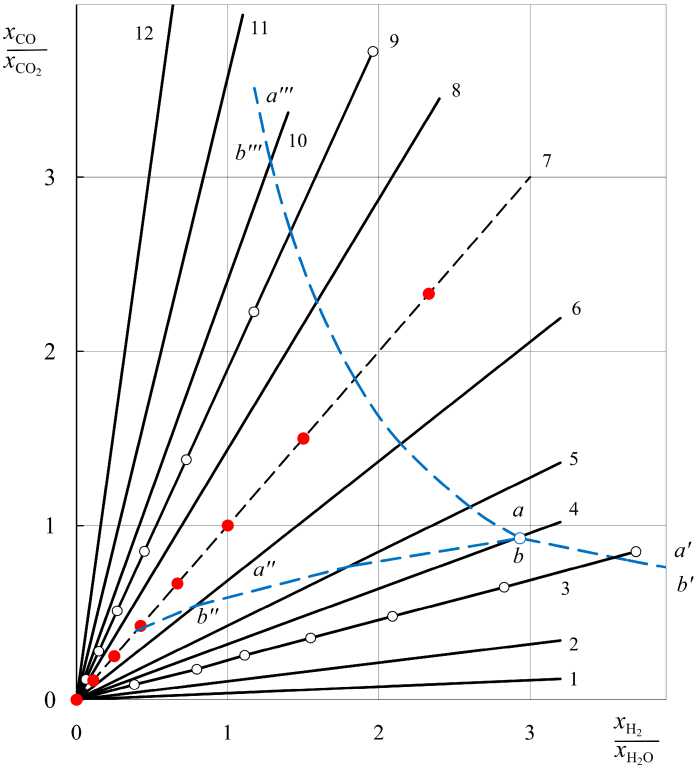
Рис. 1. Соотношения между x CO/ x CO2 и x H2 / x H2O равновесного водяного газа: 1 – 600, 2 – 700, 3 – 800, 4 – 850, 5 – 900, 6 – 1000, 7 – 1093, 8 – 1200, 9 – 1300, 10 - 1400, 11 - 1600, 12 - 2000 К; линии aa’ ( bb’) , aa” ( bbfr) , aam ( bbn r ) - равновесия водяного газа со смесями Fe 3 O 4 -Fe, Fe 3 O 4 -FeO, FeO-Fe; точка a ( b ) - нонвари-антное равновесие Fe 3 O 4 –FeO–Fe–H 2 –H 2 O–CO–CO 2
Таблица 1
Возможные параметры равновесия реакции водяного газа при 800 К
|
a o d o |
1 0 |
0,9 0,1 |
0,8 0,2 |
0,7 0,3 |
0,6 0,4 |
0,5 0,5 |
0,4 0,6 |
0,3 0,7 |
0,2 0,8 |
0,1 0,9 |
0 1 |
|
x СО = x H2O |
0 |
0,0724 |
0,1153 |
0,1420 |
0,1570 |
0,1618 |
0,1570 |
0,1420 |
0,1153 |
0,0724 |
0 |
|
x H2 |
1 |
0,8276 |
0,6848 |
0,5580 |
0,4430 |
0,3382 |
0,2430 |
0,1580 |
0,0848 |
0,0276 |
0 |
|
x CO2 |
0 |
0,0276 |
0,0848 |
0,1580 |
0,2430 |
0,3382 |
0,4430 |
0,5580 |
0,6848 |
0,8276 |
1 |
|
x H2 x H2O |
0 |
0,382 |
0,7354 |
1,1122 |
1,5483 |
2,09 |
2,8224 |
3,928 |
5,9414 |
11,438 |
— |
|
x CO x CO2 |
0 |
0,08074 |
0,1683 |
0,2545 |
0,3543 |
0,4784 |
0,6459 |
0,8991 |
1,3599 |
2,618 |
— |
|
lg( p O2, атм) |
— |
–28,60 |
–28,03 |
–27,67 |
–27,38 |
–27,12 |
–26,86 |
–26,58 |
–26,22 |
–25,64 |
— |
Таблица 2
Возможные параметры равновесия реакции водяного газа при 1093 К
|
a o d o |
1 0 |
0,9 0,1 |
0,8 0,2 |
0,7 0,3 |
0,6 0,4 |
0,5 0,5 |
0,4 0,6 |
0,3 0,7 |
0,2 0,8 |
0,1 0,9 |
0 1 |
|
x СО = x H2O |
0 |
0,09 |
0,16 |
0,21 |
0,24 |
0,25 |
0,24 |
0,21 |
0,16 |
0,09 |
0 |
|
x H 2 |
1 |
0,81 |
0,64 |
0,49 |
0,36 |
0,25 |
0,16 |
0,09 |
0,04 |
0,01 |
0 |
|
x CO2 |
0 |
0,01 |
0,04 |
0,09 |
0,16 |
0,25 |
0,36 |
0,49 |
0,64 |
0,81 |
1 |
|
x H2 / x H2O |
0 |
0,111 |
0,25 |
0,429 |
0,667 |
1 |
1,5 |
2,33 |
5,674 |
9 |
— |
|
x CO / x CO2 |
0 |
0,111 |
0,25 |
0,429 |
0,667 |
1 |
1,5 |
2,33 |
5,674 |
9 |
— |
|
lg( p O2, атм) |
— |
–19,78 |
–19,07 |
–18,60 |
–18,22 |
–17,87 |
–17,52 |
–17,13 |
–16,66 |
–15,96 |
— |
Таблица 3
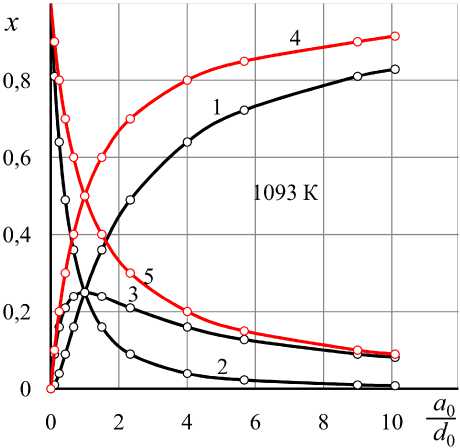
Рис. 2. Равновесные параметры водяного газа, полученном нагреванием исходной смеси «Н 2 , a 0 моль + + СО 2 , d 0 моль» до 1093 К: 1 – x H ; 2 – x CO ; 3 – x CO ,
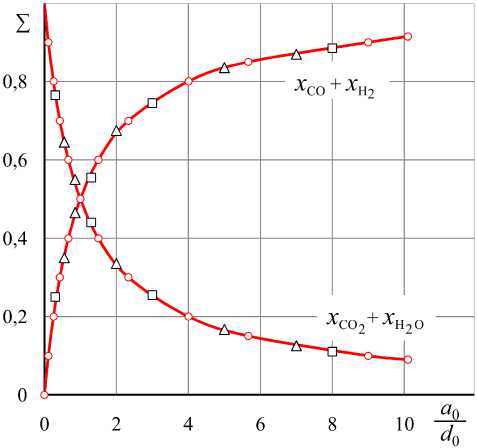
Рис. 3. Суммы концентраций восстановителей и окислителей в равновесном водяном газе, нагревание до 800 (∆), 1093 (○) и 1500 К (□)
Возможные параметры равновесия реакции водяного газа при 1300 К
Пунктирными линиями aa' (bb'), aa'' (bb''), aa''' (bb''') на номограмме (см. рис. 1) показаны хорошо известные «вилки», определяющие параметры равновесия газовых смесей CO–CO2 и H2 –H2O со смесями твердых фаз Fe3O4 –Fe, Fe3O4 –FeO и FeO – Fe. Точка пересечения линий a (b) ха- рактеризует параметры нонвариантных равновесий Fe3O4 –FeO–Fe–H2 –H2O и Fe3O4– FeO–Fe– CO–CO2.
В металлургической литературе принято количественно оценивать окислительно-восстановительные свойства газовой фазы величиной кислородного потенциала πО = RT ln pO . Для любой сколь угодно сложной газовой смеси, если в ней присутствуют СО2 и СО (или Н2О и Н2) и известны их концентрации, кислородный потенциал может быть вычислен при общем давлении 1 атм по уравнениям:
П О = -565 3 90 +
+
x
175,17 + 16,628ln-CO 2 x CO
T , Дж
П О = -492 230 +
+
108,24 + 16,628ln ^ H 2 °
T , Дж
x H2
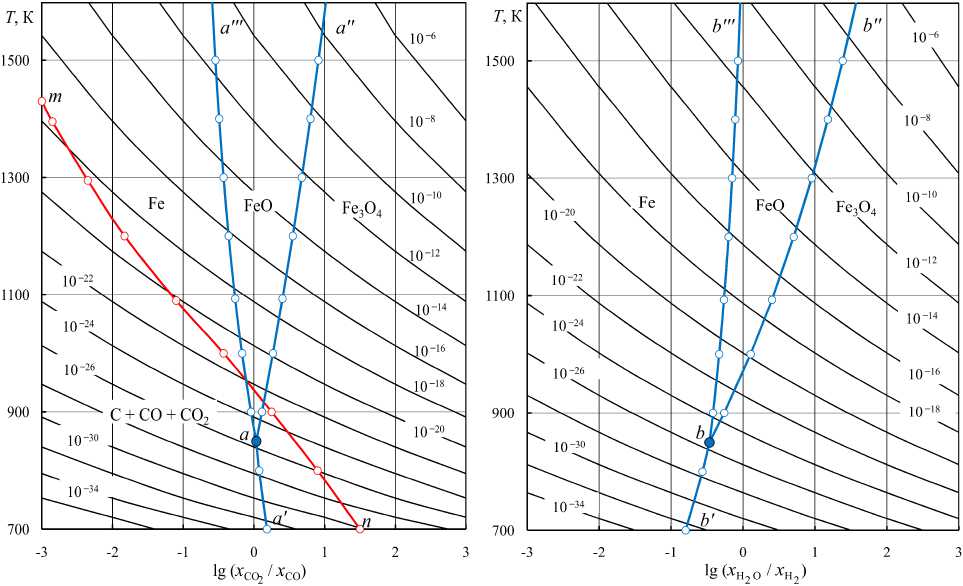
дяного газа при 1 атм: область ниже линии mn – термодинамическая неустойчивость CO (метастабильные состояния); линии aa' , aa'' и aa''' – равновесие газовой смеси CO–CO 2 с твердыми Fe 3 O 4 – Fe, Fe 3 O 4 – FeO и FeO–Fe; точка a – нонвариантная система Fe 3 O 4 – FeO–Fe– CO–CO 2
Рис. 5. Номограмма « lg( x H O x H ) - p O - T » для водяного газа при 1 атм: линии bb' , bb'' и bb''' – равновесие газовой смеси H 2 – H 2 O с твердыми Fe 3 O 4 – Fe, Fe 3 O 4 – FeO и FeO–Fe; точка b – нонвариантная система Fe 3 O 4 –FeO–Fe–H 2 –H 2 O
Рис. 4. Номограмма « lg( x CO x CO) - p O - T » для во
Эти уравнения основываются на термодинамических характеристиках реакций диссоциации диоксида углерода или паров воды при давлении 1 атм. Результаты расчетов величин lg( p O , атм) водяного газа, получающегося нагреванием смесей Н2 + СО2, приведены в табл. 1–3. Для приблизительной оценки величины парциального давления кислорода можно воспользоваться номограммами [3], рис. 4 и 5. На номограммах представлены изобары кислорода и, для примера, равновесные параметры реакций восстановления оксидов Fe3O4 и FeO водородом и монооксидом углерода. На рис. 4 линия mn характеризует равновесие реакции C + CO2 = 2CO. Параметры ниже этой линии характеризуют метастабильные состояния – выделения сажистого углерода.
Результаты расчетов (см. табл. 1–3) кроме обычных графиков (см. рис. 2 и 3) можно представить трехмерной диаграммой (рис. 6). Политерми-ческая поверхность на этой диаграмме определяет возможные сочетания концентраций Н2 и СО в водяном газе, полученном нагреванием смесей «Н2, a 0 моль+СО2, d 0 моль». Образующими поверхности являются изотермические линии, которые представляются проекциями 1, 2 и 3 на плоскость x H – x СО (рис. 7). Эти проекции определяют
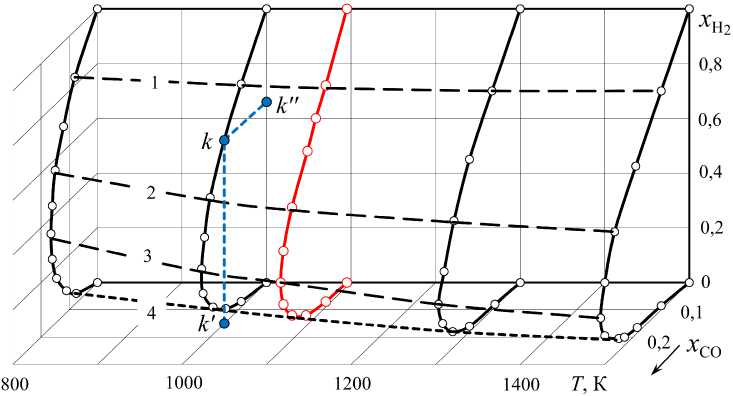
Рис. 6. Пространственная диаграмма, определяющая возможные соотношения между концентрациями H 2 и CO в равновесном водяном газе: изотермы 800, 1000, 1093, 1300 и 1500 К; исходные смеси (Н 2 , a 0 моль + СО 2 , d 0 моль): линия 1 – a 0 = 0,9 , 2 – 0,7 , d 0 0,1 0,3
3 – 0 5 ; точка k : x CO = 0,1498 ( k' ), x H
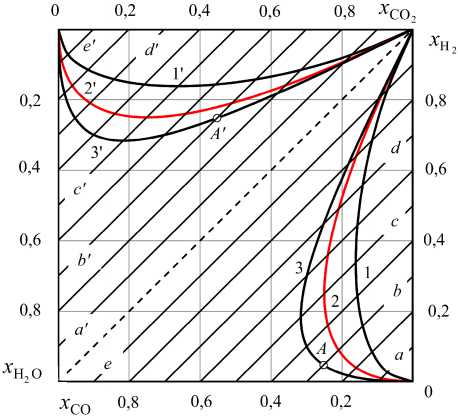
Рис. 7. Номограмма равновесных параметров водяного газа, полученного нагреванием смеси «Н 2 , a 0 моль + + СО 2 , d 0 моль»: 1, 2 и 3 – концентрации Н 2 и СО при 800, 1093 и 1500 К, 1 ′ , 2 ′ и 3' – концентрации Н 2 О и СО 2 при 800, 1093 и 1500 K; линии a , b , c , d и e : a 0 = 0,1 , d 0 0,9
0,3 0,5 0,7 0,9
0,7 , 0,5 , 0,3 и 0,1
равновесные концентрации только Н2 и СО. Равновесные концентрации Н2О и СО2 определяются на рис. 7 линиями 1 ′ , 2 ′ и 3 ′ . Соотношения равновесных концентрации Н2О и СО2 тоже могут быть представлены политермической поверхностью на пространственной диаграмме (чтобы не загромождать рисунок, эта поверхность на рис. 6 не показана, но ее положение можно представить по виду рис. 7).
= 0,6502 ( k'' ) – частный случай 1000 К,
a 0 = 0,8
d 0 0,2
Как следует из рис. 7, равновесный водяной газ кроме многообразия возможных концентраций компонентов характеризуется еще одной особенностью – зеркальной симметрией соотношений концентраций газов-восстановителей и концентраций газов-окислителей. Кроме того, политермиче-ские линии, соединяющие точки равновесных концентраций Н2 (или СО) и Н2О (или СО2) газа, полученного нагреванием до разных температур исходных смесей Н2 –СО2 разных составов, оказываются прямыми. Например, в нижнем правом концентрационном треугольнике (см. рис. 7) точки пересечения с изотермами 1, 2 и 3 политермиче-ских линий b и d (концентрация водорода в исходной смеси 0,3 и 0,7, соответственно) определяют равновесные концентрации x H и x СО. В верхнем левом концентрационном треугольнике (см. рис. 7) проведены политермические прямые линии b ′ и d ′ . Точки пересечения этих линий с изотермическими кривыми 1 ′ , 2 ′ и 3 ′ определяют другие две равновесные концентрации: x H O и x CO . Каждая из линий a … e и a ′ … e ′ параллельна гипотенузе и пересекает оси координат в точках, характеризующих состав исходной смеси. Таким образом, равновесные параметры газа определяются номограммой, на которой можно провести диагональные линии для любых соотношений величин a 0 и d 0 в нагреваемых смесях Н2 + СО2.
Водяной газ можно получить нагреванием смесей «Н2О, b0 –СО, c0». Результаты расчетов равновесия реакции Н2О + СО = Н2+ СО2 представлены на рис. 8. И в этом случае получаются зеркально симметричные кривые, определяющие составы равновесного водяного газа. Разные поло- жения изотерм 800, 1093 и 1500 К на рис. 7 и 8 объясняются разными знаками тепловых эффектов:
– реакция Н2 + СО2 = Н2О + СО эндотермическая (рис. 7),
– реакция Н2О + СО = Н2 + СО2 экзотермическая (рис. 8).
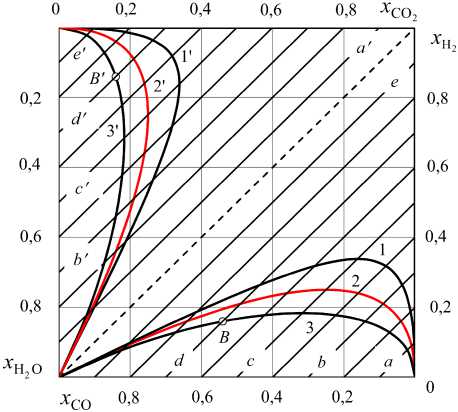
Рис. 8. Номограмма равновесных параметров водяного газа, полученного нагреванием смеси «H 2 O, b 0 моль – CO, c 0 моль»: линии 1, 2 и 3 – концентрации Н 2 и СО при 800, 1093 и 1500 К, линии 1 ′ , 2 ′ и 3' – концентрации Н 2 О и СО 2 при 800, 1093 и 1500 К; линии a , b , c , d и e : c 0,1 0,3 0,5 0,7 0,9
0= , , , и b^ 0,9 0,7 0,5 0,3 0,1
Приведем примеры использования номограмм для определения составов равновесного водяного газа при разных способах его получения.
-
1. Состав равновесного водяного газа, получающегося при нагревании смеси (Н2, 0,3 моль + +СО2, 0,7 моль) до 1500 К определяется координатами точек пересечения линий b и b ′ с изотермами 3 и 3 ′ . Получаем x H2 = 0,0477, x СО = 0,2523 (точка A , рис. 7); x H O = 0,2523, x CO = 0,4477 (точка A ′ , рис. 7).
-
2. Состав равновесного водяного газа, получающегося при нагревании смеси «Н2О, 0,3 моль –
СО, 0,7 моль» до 1500 К определяется координатами точек пересечения линий d и d ′ с изотермами 3 и 3 ′ . Получаем x H2 = 0,1596, x СО = 0,5404 (точка B , рис. 8); x H2O = 0,1404, x CO2 = 0,1596 (точка B ′ , рис. 8).
Выводы
-
1. Равновесие водяного газа реализуется при бесконечном множестве возможных концентраций компонентов. Это согласуется с правилом фаз Гиббса: число степеней свободы системы H 2 – H 2 O–CO–CO 2
-
2. Частные значения концентраций реализуются нагреванием до заданной температуры различных по составу смесей H2 –CO2 или H2O–CO.
-
3. Равновесные параметры водяного газа можно с достаточной точностью определять по номограммам. По этим же номограммам можно оценивать параметры исходных систем «оксид–H2–CO2» или «оксид – H2O – CO». При нагревании этих систем до заданной температуры будет происходить восстановление оксида. Номограммы могут использовать студенты для самоконтроля правильности расчетов, или преподаватели для контроля результатов работы студента.
с = к + 2 – ф = 3 + 2 – 1 = 4.
В случае Р и Т = const число степеней свободы с = к – ф = 3 – 1 = 2, то есть равновесные характеристики системы можно определить, если задать какие-либо два параметра исходной системы.
Список литературы Термодинамический анализ реакции водяного газа
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -520 с
- Краткий справочник физико-химических величин/под ред. А.А. Равделя и А.М. Пономаревой. -Изд. 10-е, испр. и доп. -СПб.: Иван Федоров, 2003. -240 с.
- Muan, A. Phase eqilibria among oxides in steelmaking/A. Muan, E.F. Osborn. -New York: Pergamon Press Limited, 1965.


