Термодинамический анализ системы галлий - азот
Автор: Леонович Борис Иванович, Трофимов Евгений Алексеевич, Жеребцов Дмитрий Анатольевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Краткие сообщения
Статья в выпуске: 4 т.5, 2013 года.
Бесплатный доступ
Рассчитаны параметры фазовых равновесий и построена диаграмма состояний системы галлий - азот. Определены температура и давление монотектического превращения и влияние общего давления на термическую стабильность фаз в исследованной системе.
Диаграмма состояния, термодинамика, нитрид галлия
Короткий адрес: https://sciup.org/147160279
IDR: 147160279 | УДК: 544.015.3
Текст краткого сообщения Термодинамический анализ системы галлий - азот
Нитрид галлия благодаря комплексу его физико-химических свойств широко используется в производстве светодиодов, сверхвысокочастотных транзисторов и полупроводниковых лазеров. Выращивание достаточно больших и чистых кристаллов GaN – чрезвычайно актуальная и вместе с тем сложная задача, в процессе решения которой получили развитие различные подходы [1].
Вне зависимости от того, какие технологические приёмы используются для выращивания кристаллов нитрида галлия, в процессе совершенствования таких технологий большую помощь может оказать термодинамический анализ систем, включающих галлий и азот. Таким образом, в основе термодинамических моделей процесса синтеза нитрида галлия будут лежать равновесия, реализующиеся в двойной системе Ga–N.
В связи с изложенным целью настоящей работы стал термодинамический анализ этой системы.
Методика расчёта
Известно, что легкоплавкий галлий (Т пл = 302,9 К) при взаимодействии с азотом образует стехиометрический нитрид галлия (GaN). Температура конгруэнтного плавления нитрида галлия составляет 2791 К при давлении азота « 5 - 10 4 Па [2].
При фиксированном общем давлении GaN диссоциирует по уравнению
GaN = Ga™ +— N2.
ж 2 2
Температурная зависимость равновесного давления азота приведенного трехфазного равновесия задается формулой [3]
lg / ^2(бар) = 13,569 - 1,516 - 10 4 / T . (1)
Экспериментально подтвержденные расчеты [2–4] показывают, что до температуры 1300 К и давления 100 бар в равновесии с практически жидким галлием находится чистый азот, поведение которого можно считать идеальным [4]. При более высоких давлениях отклонение от идеальности учитывали расчетом фугитивности по формуле [4]
RT ln( f N2 ) = RT ln( PI P o ) + 2,6954947 - 10 - 5( P - P0) -
- 1,02167 - 10 - 15( P - P 0)2, (2)
где Р – фактическое давление и Р 0 =101325 Па.
При термодинамическом моделировании фазовых равновесий в исследуемой системе свойства чистых элементов заимствованы из работы [5]. Температурную зависимость энергии Гиббса образования стехиометрического нитрида галлия рассчитывали по уравнению [2]
G GaN - H 298 = - 1 34869 + 270,578 - T - 44,377 - T - In T - - 6,301 - 10 - 3 - T 2 + 5,864 - 105-, -Дж.
T моль
Краткие сообщения
Молярную энергию Гиббса образования жидкого расплава галлий – азот в зависимости от температуры и состава выражали уравнением:
G m = x Ga G Ga + x N G N + RT ( x Ga ln x Ga + x N ln x N ) +
+ x Ga x N L GaN + x Ga x N ( x Ga x N ) L Ga,N ,
где xi - мольные доли компонентов расплава, LGaN - температурно-зависимые коэффициенты полинома Редлиха–Кистера, значения которых выражаются формулами [2]
Дж моль
L Ga,N =— 35811,5 + 21,74 • T и L Ga,N = 55558,6 - 7,68,
Молярную энергию Гиббса газовой фазы в исследованном интервале температур и давлений моделировали соотношением
G газ = G N + RT • ln f N .
Процедура расчета описана, например, в работе [6].
Результаты и их обсуждение
Результаты расчета фазовых равновесий представлены графически на рис. 1 в виде Т–х проекции диаграммы состояния системы Ga–N. Как следует из результатов расчета, максимальная растворимость азота в жидком галлии составляет 0,073 мол. %. Критическая температура расслоения жидких сплавов составляет 4278 К при содержании азота 32 мол. %.
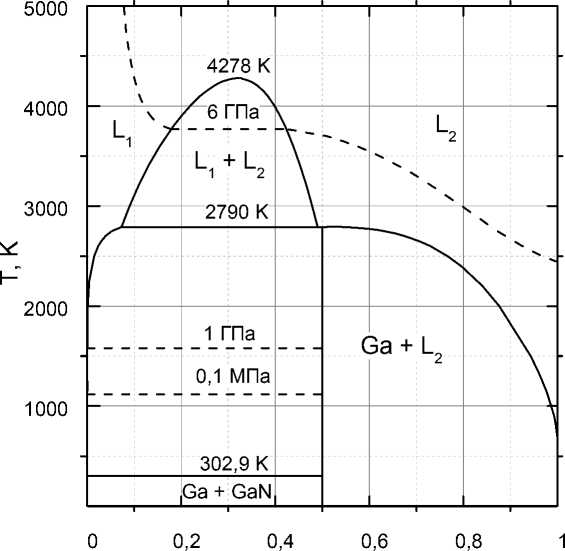
Ga N
Рис. 1. Проекция диаграммы состояния системы Ga–N в координатах температура – состав (штриховыми линиями показаны изобары азота)
Рис. 2 иллюстрирует термическую устойчивость фаз в системе галлий – азот при заданном давлении газовой фазы. При давлении 105 Па трехфазное равновесие ж + GaN + газ реализуется при температуре 1117 К (рис. 2, а). При этом на стороне жидкого расплава давление паров галлия на несколько порядков ниже давления азота.
Леонович Б.И., Трофимов Е.А., Жеребцов Д.А.
Термодинамический анализ системы галлий – азот
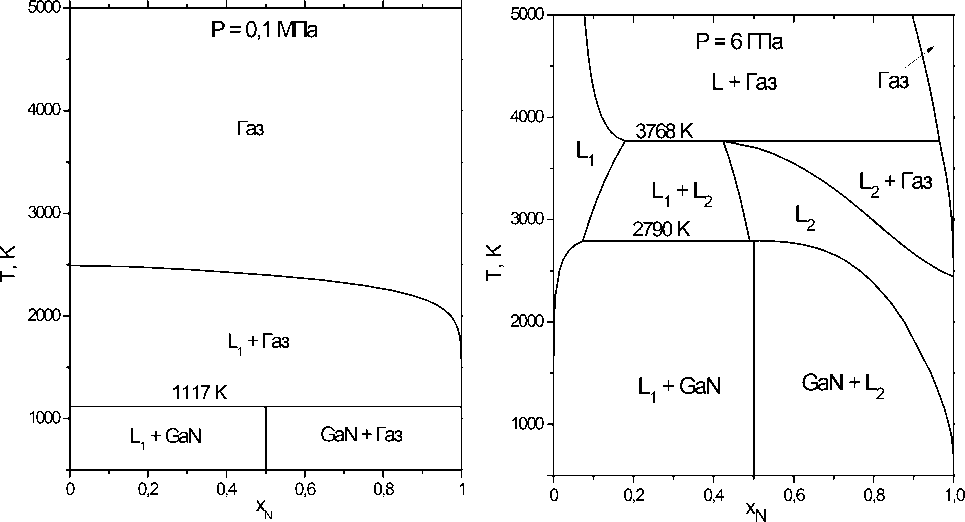
a) б)
Рис. 2. Изобарные сечения фазовой диаграммы системы Ga – N при общем давлении 0,1 МПа (а) и 6 ГПа (б)
При повышении давления до 6·109 Па в системе реализуются условия равновесного сосуществования двух жидкостей с различным содержанием азота. При температуре 3767,6 К равновесное содержание азота в расплавах и газовой фазе составляет 17,8; 42,4 и 96,5 мол. % соответственно.
Заключение
Опираясь на представленные в литературе данные, проведен термодинамический анализ системы галлий – азот. По результатам расчетов построена диаграмма состояния. Продемонстрировано влияние давления на характер фазовых равновесий в данной системе.
Работа выполнена при поддержке РФФИ, грант № 13-08-00545.
Список литературы Термодинамический анализ системы галлий - азот
- Technology of gallium nitride crystal growth: Springer series in materials science (V. 133)/ed. D. Ehrentraut, E. Meissner, M. Bockowski. -Berlin: Springer, 2010. -348 p.
- Davydov, A. Thermodynamic Analysis of the Ga-N System/A. Davydov, T.J. Anderson//III-V Nitride Materials and Processes III. -Boston (MA): ECS, 1998. -P. 38-49.
- Thermodynamic Assessment of the Gallium-Nitrogen System/A.V. Davydov, W.J. Boettinger, U.R. Kattner, T.J. Anderson//Physica status solidi A. -2001. -V. 188, Issue 1. -Р. 407-410.
- Thermodynamics and Phase Stability in the Ga-N System/J. Unland, B. Onderka, A. Davydov, R. Schmid-Fetzer//J. Crystal Growth. -2003. -V. 256. -Р. 33-51.
- Dinsdale, A.T. SGTE data for pure elements/A.T. Dinsdale//Calphad. -1991. -V. 15, № 4. -Р.317-425.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Изд. дом МИСиС, 2009. -520 с.


