Термодинамический анализ взаимодействия Cr 2O 3 и MgCr 2O 4 с газообразными углеродсодержащими восстановителями
Автор: Сенин Анатолий Владимирович, Куприянов Лев Сергеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Краткие сообщения
Статья в выпуске: 2 т.13, 2013 года.
Бесплатный доступ
Рассчитаны термодинамические характеристики реакций и равновесные составы газовой фазы при восстановлении оксидов Cr 2O 3 и MgCr 2O 4 углерод- и водородсодержащими газообразными восстановителями СН 4, СН 3, СН 2, СН, С, Н 2, Н, СО, С 3О 2, С 2О. Установлено, что углерод- и водородсодержащие радикалы обладают повышенной восстановительной способностью по сравнению с молекулярными СО и Н2.
Термодинамическое моделирование, газообразные восстановители, восстановление твердых оксидов, углеводородные радикалы
Короткий адрес: https://sciup.org/147156822
IDR: 147156822 | УДК: 669.014
Текст краткого сообщения Термодинамический анализ взаимодействия Cr 2O 3 и MgCr 2O 4 с газообразными углеродсодержащими восстановителями
Методика расчета восстановительной способности газообразных частиц изложена в работе [1]. В настоящей работе выполнена термодинамическая оценка восстановительной способности газообразных веществ Н2, Н, СН4, СН3, СН2, СН, С, СО, С3О2, С2О по отношению к оксиду хрома Cr2O3 и хромиту магния MgCr2O4.
В качестве параметра для сравнения восстановительной способности газообразного вещества по отношению к оксидам металлов выбрано равновесное парциальное давление восстановителя в системе, когда оксид металла находится в равновесии со своим металлом. В многокомпонентной системе равновесие обычно описывается набором независимых уравнений химических реакций между всеми веществами, составляющими систему. В соответствии с фундаментальным принципом термодинамики, если система находится в равновесии, то равновесной будет и любая из реакций, описывающих взаимодействие между веществами в системе. На основании этого положения была выбрана единая схема записи уравнений реакций восстановления, например, для восстановления углеводородными частицами:
Cr2O3 + xV ^ 2Cr + n CO + m H2, (1)
MgCr2O 4 + xV ^ MgO + 2Cr + n CO + m H2, (2) где V – обобщенный символ вещества-восстановителя; x , n и m – стехиометрические коэффициенты.
Следует помнить, что выбранный метод описания восстановления оксидов одним уравнением реакции не отражает в полной мере все разнообразие химических взаимодействий в системе. Однако цель работы – сравнить химическую активность газообразных восстановителей в идентичных условиях, поэтому однотипная форма записи уравнений реакций, в которой меняется только вещество- восстановитель, на наш взгляд, подходит для поставленной цели.
Термодинамические характеристики реакций восстановления с участием неустойчивых частиц были определены в настоящей работе. Для получения согласованных между собой данных была использована первичная информация о термохимических характеристиках индивидуальных веществ [2]. Энергию Гиббса индивидуальных веществ рассчитывали по формуле
f im)
GT =- T. Ф =-_T ^ ST - T =
= ( h + a fH298 )-t . ST, (3)
где Т - температура; ФT - приведенная энергия Гиббса; S°T - изменение энтропии; I°T - полная энтальпия вещества; HT - «физическая» составляющая энтальпии, изменение энтальпии при увеличении температуры и фазовых переходах; АfH298 - «химическая» составляющая энтальпии, стандартная теплота образования. Затем, в соответствии с уравнением химической реакции восстановления, по разнице энергий Гиббса продуктов реакции и исходных веществ рассчитывали изменение энергии Гиббса для соответствующей реакции. Результаты расчетов для реакций образования сложных веществ приведены в таблице. Далее методом комбинирования уравнений химических реакций рассчитывали значения констант равновесия реакций восстановления оксидов конкретным газообразным восстановителем. Равновесные составы газовой фазы определяли на основе правила фаз Гиббса из совместного решения уравнений закона действующих масс и нор- мировки состава газовой фазы на общее давление 1 атм. Как показали расчеты, равновесное давление углеводородов практически не зависит от соотношения количеств СО и Н2 в газообразных продуктах, поэтому на иллюстрациях приведены результаты для одного из значений р(Н2) = 0,6 атм. Результаты расчетов приведены на рис. 1, 2 в виде температурной зависимости логарифма равновесного парциального давления (атм) восстановителя в системе, когда оксид металла находится в равновесии со своим металлом в соответствии со схемами (1) и (2) уравнений реакций восстановления.
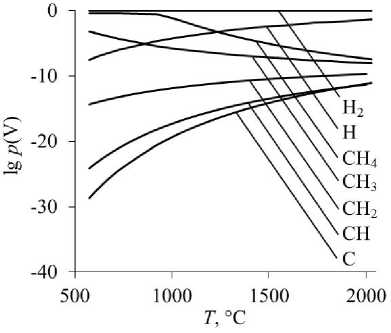
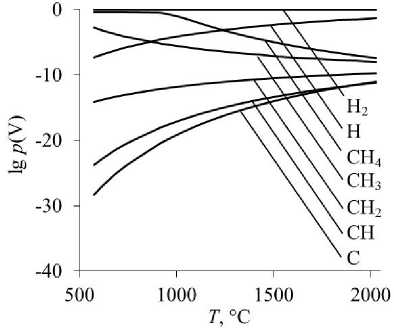
Самыми слабыми восстановителями в изученных условиях являются молекулярный водород Н2 и монооксид углерода СО.
По мере уменьшения количества атомов водорода в молекуле углеводорода СН4 → СН3 → СН2 → СН → С восстановительная способность газообразных частиц увеличивается. Самым сильным восстановителем является атомарный углерод, достаточно его следовых концентраций в газовой фазе на уровне 10–20–10–15 атм, чтобы началось восстановление. Следует отметить, что именно атомарная форма углерода обеспечивает его высокую восстановительную способность по сравнению с атомами углерода, входящими в кристаллическую решетку твердого графита. Атомарный водород также обладает более высокой восстановительной способностью, чем молекулярный.
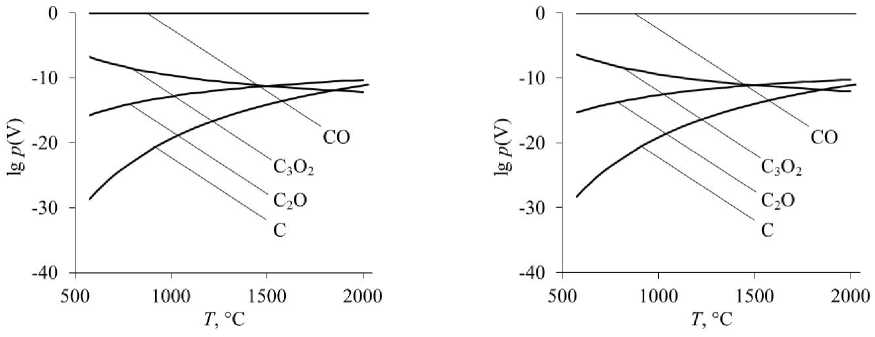
Производные от оксида углерода радикалы С 3 О 2 , С 2 О также обладают повышенной восстано-
Термодинамические характеристики реакций образования веществ в интервале температур 298–2000 К
|
Реакция |
A f G° T , Дж/моль |
|
2Cr (тв) + 3/2 O 2 = Cr 2 O 3(тв) |
–1130600 + 252,93 T |
|
Mg (тв) + 2 Cr (тв) + 2 O 2 (газ) = MgCr 2 O 4(тв) (298–923 К) |
–1756860 + 370,63 Т |
|
Mg (ж) + 2 Cr (тв) + 2 O 2 (газ) = MgCr 2 O 4(тв) (923–1376 К) |
–1764840 + 379,27 Т |
|
Mg (газ) + 2 Cr (тв) + 2 O 2 (газ) = MgCr 2 O 4(тв) (1376–2000 К) |
–1885150 + 466,71 Т |
|
Mg (тв) + 1/2 O 2 (газ) = MgO (тв) (298–923 К) |
–600930 + 107,05 Т |
|
Mg (ж) + 1/2 O 2 (газ) = MgO (тв) (923–1376 К) |
–608900 + 115,60 Т |
|
Mg (газ) + 1/2 O 2 (газ) = MgO (тв) (1376–2000 К) |
–729220 + 204,28 Т |
|
С (гр) + 2H 2 (газ) = CH 4 (газ) |
–86890 + 107,32 T |
|
С (гр) + 3/2 H 2 (газ) = CH 3 (газ) |
138840 + 22,79 T |
|
С (гр) + H 2 (газ) = CH 2 (газ) |
385160 – 48,87 T |
|
С (гр) + 1/2 H 2 (газ) = CH (газ) |
596380 – 111,1 T |
|
C (гр) = С (газ) |
717705 – 157,34 T |
|
1/2 Н 2 = Н (газ) |
223010 – 57,80 T |
|
С (гр) + 1/2 О 2 (газ) = CО (газ) |
–112370–87,24 T |
|
С (гр) + О 2 (газ) = CО 2 (газ) |
–394190 – 1,407 Т |
|
2C (гр) + 1/2 O 2 (газ) =C 2 O (газ) |
291770 – 122,73 T |
|
3C (гр) + O 2 (газ) = C 3 O 2 (газ) |
–99455 – 52,75 T |
а)
Рис. 1. Равновесные парциальные давления газообразных Н 2 , Н, СН 4 , СН 3 , СН 2 , СН, С при восстановлении оксидов: а – восстановление Cr 2 O 3 ; б – восстановление MgCr 2 O 4
б)
Сенин А.В., Куприянов Л.С.
Термодинамический анализ взаимодействия Cr 2 O 3 и MgCr 2 O 4 с газообразными углеродсодержащими восстановителями
б)
а)
Рис. 2. Равновесные парциальные давления газообразных СО, С 3 О 2 , С 2 О, С при восстановлении оксидов: а – восстановление Cr 2 O 3 ; б – восстановление MgCr 2 O 4
вительной способностью – на уровне углеводородных радикалов.
Поскольку оксиды Cr2O3 и MgCr2O4 имеют близкие характеристики термодинамической прочности, то и равновесные парциальные давления газообразных восстановителей по отношению к этим оксидам также практически совпадают.
Таким образом, в настоящей работе с термодинамической точки зрения показана высокая восстановительная способность углеродсодержащих молекул и радикалов по отношению к термодинамически прочным хромсодержащим оксидам Cr 2 O 3 и MgCr 2 O 4 .
Список литературы Термодинамический анализ взаимодействия Cr 2O 3 и MgCr 2O 4 с газообразными углеродсодержащими восстановителями
- Сенин, А.В. Термодинамический анализ взаимодействия FeO и FeCr2O4 с газообразными углеродсодержащими восстановителями/А.В. Сенин//Вестник Южно-Урал. гос. ун-та. Сер. «Металлургия». -2013. -Т. 13, № 1. -С.14-18.
- Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных ACTPA.OWN)/Г.К. Моисеев, Н.А. Ватолин, Л.А. Маршук, Н.И. Ильиных. -Екатеринбург: УрО РАН, 1997. -230 с.
- Senin A.V. Thermodynamic Analysis of the Reactions Between FeO, FeCr2O4 and Gaseous Carbon-Containing Reducing Agents [Termodinamicheskiy analiz vzaimodeystviya FeO i FeCr2O4 s gazoobraznymi ugle-rodsoderzhashchimi vosstanovitelyami]. Billetin of the South Ural State University. Series “Metallurgy”, 2013, vol. 13, no. 1, pp. 14-18.
- Moiseev G.K., Vatolin N.A., Marshuk L.A., Il'inykh N.I. Temperaturnye zavisimosti privedennoy energii Gibbsa nekotorykh neorganicheskikh veshchestv (al’ternativnyy bank dannykh ASTRA.OWN) [The Temperature Dependence of the Gibbs Energy of Some Inorganic Substances (Alternative Database ASTRA.OWN)]. Ekaterinburg, UrO RAN, 1997. 230 p.


