Термодинамический аспект выделения растворенного водорода в микропорах металла
Бесплатный доступ
В работе предложена простая и наглядная теория заполнения водородом, растворенным в образце, пор и микротрещин в объеме металла на основе уравнения состояния газа и закона Сивертса. Выведенное аналитическое выражение для давления водорода в поре иллюстрируется численными расчетами для различных значений температур и содержаний водорода в железе. Полученные результаты применены для обсуждения проблемы зарождения флокенов в сталях.
Короткий адрес: https://sciup.org/147158474
IDR: 147158474 | УДК: 548.51
Текст краткого сообщения Термодинамический аспект выделения растворенного водорода в микропорах металла
К настоящему моменту можно считать доказанным [1,2], что флокены - распространенные дефекты массивных стальных поковок, представляют собой внутренние микрополости (поры), заполненные водородом. Наполнение поры водородом происходит путем атомной диффузии растворенного газа из объема металла. По мере натекания водорода давление газа в поре возрастает, пока не достигнет критического значения Р^, при котором интенсивность механических на пряжений на границе трещины достигает критического уровня разрушения Кс:
Kc=aP^4L,
где величина критического уровня Кс определяется вязкостью разрушения и, вероятно, сегрега цией атомов водорода в вершине трещины [3]. Выполнение условия Р > Р^ приводит к росту зародыша трещины с характерной длиной L. Рост флокена приводит к падению давления и остановке развития трещины. Требуется некоторое время для дальнейшего повышения давления из- за «натекания» газа и начала следующего «рывка» вершины трещины.
Несмотря на то, что приведенная выше общая физическая картина развития флокенов является признанной, вопросы количественного описания и прогнозирования явления все еще остаются дискуссионными. Известно, что флокены зарождаются в ходе охлаждения поковок при температуре ниже 150 °C [1]..Вопрос о том, какие давления возникают при этом внутри микрополостей, которые, безусловно, существуют в поковках, остается открытым и наиболее спорным. Равновесное давление молекулярного водорода в порах регулируется законами физической химии: законом Сивертса растворения водорода в железе или стали
и уравнением состояния газа Н2 в полости
Рн2^ = —^. ^н2
Концентрация водорода в (2) выражена с помощью практической единицы измерения [см3/100 г], которая показывает количество газообразного Н2 в кубических сантиметрах выделяемого 100 г металла при нормальных условиях (0 °C, 1 атм). Измерив экспериментально величину Сн, можно определить массу водорода в образце объемом Vq (см3) из выражения:
тн2 -^’^О’^Н’ где
Рн2‘Ро 22,4-103
= 7,018-Ю"4,
р0 = 7,86 г/см3 - плотность стали, /zHz = 2 г/моль - молярная масса водорода. Тогда отношение масс водорода в образце и самого образца, которое можно найти как
_^к_ = А. сн = 8,929 • 10~5 • Сн, ^0 ' Ро Ро представляет массовую долю водорода в растворе. Удобной единицей измерения в последнем случае является 1 propromille (1 весовая часть на миллион). Очевидно, что 1 (см3 / 100 г) = = 0,893 ppm = 0,893 ТО"4 мас.%. Для раствора водорода в a-железе по данным [5]:
Л = 47,534
1 см3
атм1/2 100 г’
а энергия активации растворения Е = 27,180 кДж/моль.
Формула (3) определяет концентрацию водорода в железе, если оно при некоторой температуре Т находится в равновесии с атмосферой молекулярного водорода, характеризующейся давлением РН1 . Но закон Сивертса применим и для обратного процесса выделения водорода из металла. Допустим, что при высокой температуре образец имеет равновесную концентрацию водорода Си . При относительно быстром охлаждении образца вне водородной атмосферы некоторое количество водорода, выйдя путем диффузии на поверхность, испарится, но основная часть газа в глубине образца сохранится в неизменной концентрации. Предположим, что здесь возникла бесконечно малая по размеру пора. Тогда давление водорода в ней будет определяться условием равновесия с растворенным в стали газом:
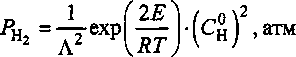
Если, например, Сц = 5 (см3/100 г), то при 1000, 500, 300 и 100 К равновесное давление окажется равным соответственно 7,65; 5300; 3,24Т07 и 2,8-Ю26 атм или 0,77; 535,3; 3,ЗТ06 и 2,85-Ю25 МПа. Согласно [7] окружное растягивающее напряжение у поверхности сферической полости составляет /^2 /2. Таким образом, уже в районе 450 К у поверхности будет достигнуто напряжение, превышающее <тд * 1000 МПа, и начнется разрушение. Для комнатной температуры возникающие вокруг поры напряжения примерно в 15 000 превышают сгд. Однако, нам необходимо учесть, что реальные образцы содержат достаточно большое количество пор, обладающих конечным суммарным объемом Vt. Тогда может оказаться, что найденные выше значения давления не будут достигаться в силу ограниченности количества газа, заключенного в образце. Поэтому проведем оценку возникающего давления, предположив, что доля образца, занятая порами, равна / = Vn]V, и весь водород, запасенный в металле, полностью выделится в них:
2 88-10-2 л
^н2 КГ = С" • Г, атм. (7) Рн2 ‘ 7
При выводе (7) мы неявно предполагали, что концентрация водорода в образце уменьшается однородно, поэтому давление в порах разного размера возрастает одинаково. В частности, если /= 0,001, т.е. объем пор составляет 0,1 % от объема образца, то реально достижимое давление составит /ц2 =28,8-Сц-Т (атм). При Г = 300 К и Су =5 (см3/100 г) получаем давление Рдг = 43 200 атм. Это значительное давление, но существенно меньшее, чем определенное по уравнению Сивертса (6)! Таким образом, необходима теория, позволяющая учесть совместное действие обоих факторов. К выводу уравнений такого рода мы и перейдем.
Вывод основных уравнений
После проведенных оценок, очевидно, что истинное давление можно определить лишь совместным решением уравнений (6) и (7) с учетом закона постоянства массы водорода в образце. С этой целью рассчитаем:
Мирзаев Д.А., Мирзоев А.А.
-
а) количество водорода в порах т^
тн--
RT
(8а)
-
б) количество растворенного в стали водорода т^:
"=н) = №. (86)
полагая, что выделившийся в порах и растворенный в металле водород находятся в равновесии при неизменной сумме
^н + т^ =тн= рУ0Сц, (8в)
где Си - концентрация растворенного водорода в стали, не содержащей поры, приближенно совпадающая с исходной высокотемпературной концентрацией. После подстановки (8а) и (86) в (8в)
получаем:
Сн-Сн+^н, и далее, с учетом (2), приходим к окончательному выражению
, RT0Ax
— RTp о
н2
(Ю)
которое представляет собой квадратное уравнение относительно ^PHz . Через Л, обозначен коэффициент растворимости At = Ae"EIRT, имеющий смысл концентрации водорода в стали при давлении водорода в 1 атмосферу. Решение уравнения (10) имеет вид
^.i.
(П)
RTP^
В области низких температур при Г -> 0 параметр Aj также стремится к нулю. Поэтому первое слагаемое под знаком радикала неограниченно возрастает, по сравнению с ним можно пренебречь единицей, тогда и, следовательно,
^h2=^CS, (126)
что совпадает с (7). Как и следовало ожидать, при низких температурах реализуется ситуация, когда весь водород концентрируется в порах. Наоборот, в другом предельном случае при Т-> со первое слагаемое становится малым параметром. Разлагая подкоренное выражение в ряд по этому параметру и ограничиваясь первым членом разложения, находим соотношение, аналогичное (6):
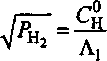
Таким образом, при высоких температурах давление в порах определяет концентрация газа, растворенного в металле.
Представленная нами теория является достаточно простой и очевидной. Несмотря на то, что она не приводится в современной литературе, трудно представить, что эти расчеты до сих пор не были сделаны. Например, В.Я. Дубовой в своей книге [1] ссылается на статью Хонда и Хироне [8], опубликованную в 1936 г. Ознакомится с содержанием этой статьи сейчас затруднительно, но, судя по графику температурной зависимости давления водорода в порах, приведенному в [1], подход авторов к проблеме был аналогичен нашему. Однако, данные о растворимости водорода в а-железе в те годы были недостаточно точны, так что авторы получили максимум давления в порах в районе 250 °C. В.Я.Дубовой отвергал теорию образования флокенов Хонда и Хироне по той причине, что он наблюдал для многих сталей образование флокенов ниже 100 °C. Похожие расчеты были сде-
Физика
ланы в ряде работ, обзор которых приведен в [6, 8]. Однако их цель заключалась в выяснении влияния пористости на коэффициент диффузии, а оценки давления не проводились.
Результаты численных расчетов
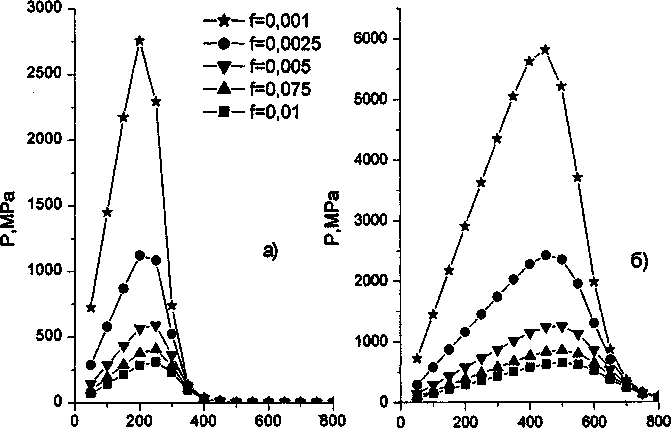
Для иллюстрации результатов приведенной теории были проведены численные расчеты на основе формулы (11) для трех значений концентрации водорода 2,5; 5 и 7,5 (см3/ 100 г) и трех значений/от/= 10-2 до/= 10~3. Результаты расчета приведены на рис. 1 а, б, в. Каждый график, если двигаться вдоль оси температур, имеет восходящий участок, заканчивающийся максимумом, и последующий нисходящий участок в области высоких температур.
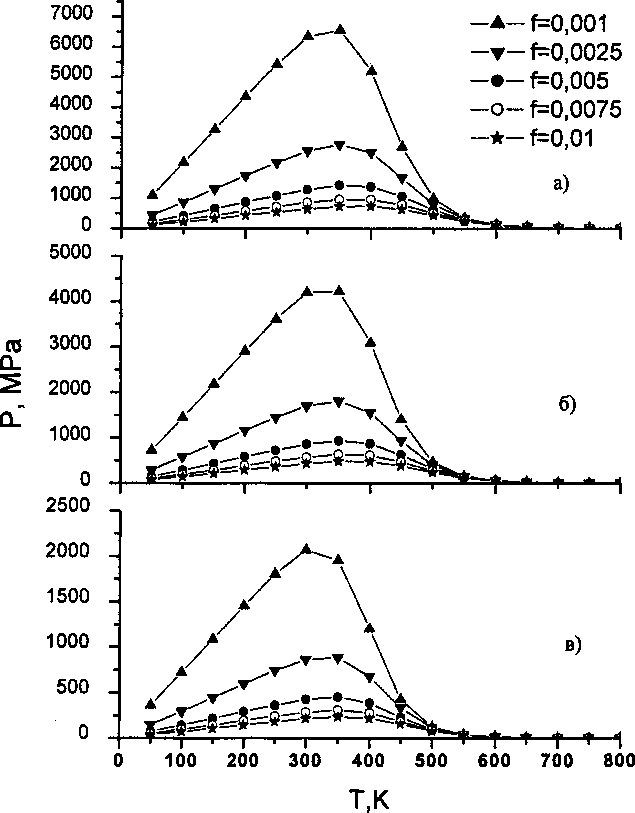
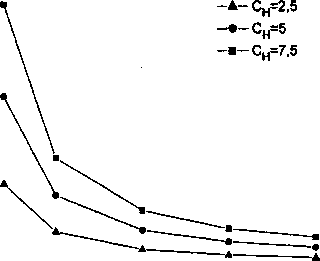
Рис. 1. Влияние температуры и объемной доли пор f на давление водорода для различного содержания водорода в железе: а - 2,5; б - 5; в - 7,5 см3/г
Восходящий участок обусловлен действием уравнения состояния газа (7), согласно которому давление пропорционально температуре; нисходящий участок - действием закона Сивертса, в соответствии с которым растворимость газа в металле растет при увеличении температуры, а выделение газа в поры падает. Тенденции изменения давления, определяемые указанными законами, взаимно противоположны, поэтому всегда возникает довольно резкий максимум в районе 300-400 К. Зависимость температуры Тм, соответствующей максимальному давлению, от концентрации водорода и доли пустот/ приведен рис. 2. При повышении концентрации или параметра / температура Тм несколько повышается, но остается в пределах того температурного интервала, в котором наблюдается возникновение флокенов [1]. Уровень максимального давления в зависимости от аналогичных параметров представлен на рис. 3. Формально, мы можем указать те зна-
Мирзаев Д.А., Мирзоев А.А.
чения Сн и / при которых Р^ превзойдет значение 2000 МПа, и растягивающее напряжение ст = 0,5?^ окажется выше ств. Такой подход возможен, и часто используется. Однако поры не обязательно имеют сферическую форму. А при иной форме необходимо учитывать коэффициенты концентрации напряжений и, в конечном итоге, мы придем к условиям (1), вытекающим из линейной механики разрушения. Вероятно, условие Р^ > 2ств определяет верхний предел разрушающего давления, но за неимением данных об L и Кс приходиться использовать именно его.
Для концентрации водорода 2,5 (см3/ 100 г) принятое условие разрушения выполняется только для / = 0,001 и Г = Гм. Этот факт согласуется с наблюдениями производственников о том, что флокены не наблюдаются у сталей, с концентрацией водорода менее 2 (см3/ 100 г) [4]. В случае концентраций 5 и 7,5 (см3/ 100 г) условия разрушения выполняются для/ = 0,001 в довольно широком диапазоне температур.
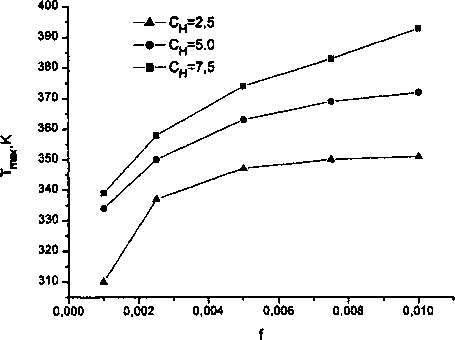
Рис. 2. Влияние концентрации водорода в железе и доли пор f на температуру Тт, при которой давление водорода максимально
7000-
0- — 0.000
0,002
0,004 0,006 0,008 0,010
Рис. 3. Зависимость величины максимального давления в порах от концентрации водорода и степени пористости f
Т,К Т,К
Рис. 4. Зависимость давления водорода в порах от температуры и доли пор при различных значениях энергии активации растворения водорода: Е = 17185 Дж/моль (а) и Е = 37185 Дж/моль (б). Данные для промежуточного значения Е = 27185 Дж/моль приведены на рис.1 б
Физика . .
Давно известно [4], что некоторые легирующие элементы, такие как Pd и Ti, подавляют процесс флокенообразования в сталях. Существует мнение [6], что такие добавки увеличивают растворимость водорода в стали. Чтобы проверить влияние растворимости водорода, были выполнены расчеты, в которых энергии активации растворения Е придавали значения 17 185 и 37 185 Дж/моль, меньшее и большее, чем в действительности (рис. 4). В первом случае растворимость водорода при 300 К увеличивается в 55 раз, а во втором - уменьшается в 55 раз. Повышение растворимости при неизменной концентрации Су приводит, как это видно из сравнения рис. 16 и 4а, к смещению пика давления примерно на 200 К вниз по температурной шкале и снижению его высоты с 4200 до 2690 МПа. При этом давление водорода в порах при 300 К (конечная температура охлаждения поковок) существенно снижается (с 4200 МПа до 750 МПа), т.к. точка Т= 300 К оказывается правее Тм.
Уменьшение растворимости в 55 раз вызывает перемещение максимума давления к более высокой температуре 440 К, при этом сам максимум возрастает до 5800 МПа (ср. рис. 1а и 46). Однако давление водорода при 300 К остается практически таким же, как и в исходном варианте. Это связано с тем, что в обоих случаях точка Т= 300 К оказывается ниже Тю, поэтому лежит на прямолинейном участке, определяемом уравнением состояния газа (7). Поэтому для одной и той же температуры (300 К) получаем одинаковые значения давления, независимо от величины коэффициентов растворения А!.
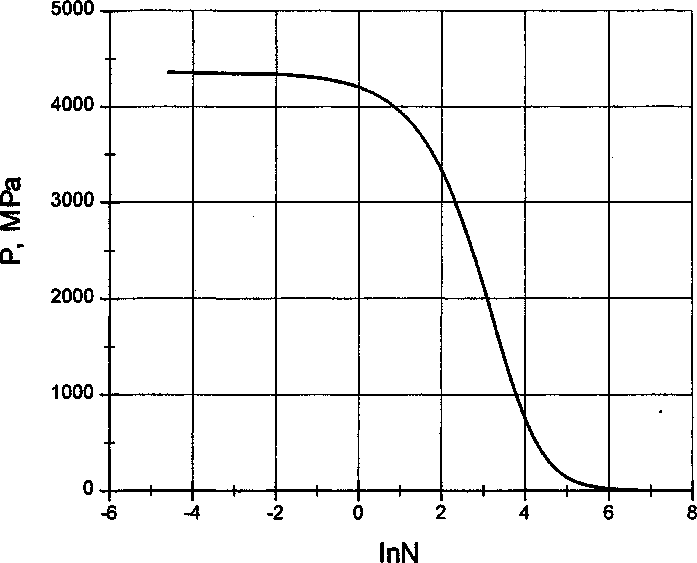
Рис. 5. Влияние растворимости водорода в железе на давление водорода в порах: N*AJ Ai(Fe), где Af(Fe) = 8,78-10"4 см3/100 г - коэффициент растворимости водорода в железе, a Ai - различные возможные значения данного коэффициента для сплавов железа
Более детальная зависимость давления водорода при 300 К как функция растворимости приведена на рис. 5. За единицу растворимости принято значение Aj (Fe) = 8,78-Ю-4 (см3/100 г), характеризующее растворимость водорода в железе при 300 К и РНг = 1 атм. Резкое уменьшение давления в порах достигается при весьма значительном возрастании растворимости. Например, десятикратное возрастание N приводит уменьшению давления на 45 %, тридцатикратное - к уменьшению на 64 %, пятидесятикратное - к уменьшению в 5 раз. Напротив, уменьшение растворимости водорода (InTV < 0), действительно, почти не влияет на уровень давления водорода при 300 К.
Мирзаев Д.А., Мирзоев А.А. Термодинамический аспект выделения растворенного водорода в микропорах металла
Следует отметить, что расчеты проведены в предположении, что поры, заполненные водородом, имеют равное давление газа, независимо от размера пор. Данное условие необходимо для того, чтобы в пространстве между порами отсутствовали диффузионные потоки. Однако наполнение пор хотя бы на начальном этапе может оказаться нескоррелированным, и этот вопрос нуждается в дополнительном исследовании.
Выводы
-
1. Вопреки распространенному мнению о приоритете закона Сивертса, наши расчеты показали, что установление равновесного давления водорода в порах является компромиссом между законом Сивертса и законом состояния газа.
-
2. Именно этот компромисс приводит к появлению максимума давления водорода в районе 300 К. Точное значение температуры, при которой давление водорода максимально, зависит от концентрации водорода, степени несплошности и растворимости водорода, но во всех случаях оно расположено в том интервале температур, в котором возникают флокены при охлаждении поковок.
-
3. Возрастание растворимости водорода в стали, при соответствующем легировании, действительно может привести к значительному уменьшению давления водорода благодаря смещению пика давления в область отрицательных температур.
-
4. Результаты расчета показали, что снижение растворимости водорода, хотя и приводит к смещению максимума давления в область более высоких температур, но оставляет практически неизменным давление газа в порах при Т= 300 К (конечная температура поковок). Это указывает на то, что отрицательная роль, которую в литературе приписывают легирующим добавкам, снижающим растворимость водорода, возможно, преувеличена.
Список литературы Термодинамический аспект выделения растворенного водорода в микропорах металла
- Дубовой В.Я. Флокены в металлах. -М.: Металлургиздат, 1950. -330 с.
- Штремель М.А., Князев А.А., Либенсон А.Г. Кинетика роста флокенов//ФММ. -1982. -Т. 54.-№4.-С. 804.
- Штремель М.А., Князев А.А. Кинетика раскрытия внутренней зернограничной трещины водородом//ФММ. -1986. -Т. 62. -№ 4. -С. 645-651.
- Шаповалов В.И., Трофименко В.В. Флокены и контроль водорода в стали. -М.: Металлургия, 1987. -161 с.
- Колачев Б.А. Водородная хрупкость металлов. Итоги науки и техники. Серия «Металловедение и термическая обработка». -М.: Наука, 1989. -Т. 23. -221 с.
- Гельд П.В., Рябов Р.А. Водород в металлах и сплавах. -М.: Металлургия, 1974. -272 с.
- Гельд П.В., Рябов Р.А., Кодес Е.С Водород и несовершенства структуры металла. -М.: Металлургия. -1979. -221 с.
- Тимошенко С.П., Гудьер Дж. Теория упругости. -М.: Наука, -1975. -С. 395-400.
- Хонда К., Хироне//Science Report of the Tohoku Imperial University. -1936. -V. 25. -№ 4. -P.713-725.


