Термодинамическое моделирование фазовых равновесий в системе SrO-Al2O3
Автор: Макровец Лариса Александровна, Самойлова Ольга Владимировна, Бакин Игорь Валерьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.21, 2021 года.
Бесплатный доступ
Проведено термодинамическое моделирование фазовых равновесий с последующим построением диаграммы состояния системы SrO-Al2O3. Для расчета активностей оксидного расплава в ходе настоящей работы использовали приближение теории субрегулярных ионных растворов, при этом наиболее оптимальными оказались значения энергетических параметров Q1112 = -104 349; Q1122 = -217 689; Q1222 = -104 436 Дж/моль. Полученные результаты по положению линии ликвидус в исследуемой системе имеют хорошее соответствие с экспериментальными литературными данными. В ходе расчета оценены значения констант равновесия реакций образования алюминатов стронция из компонентов оксидного расплава.
Термодинамическое моделирование, теория субрегулярных ионных растворов, система sro-al2o3, оксид стронция, фазовые равновесия
Короткий адрес: https://sciup.org/147236544
IDR: 147236544 | УДК: 669.18 | DOI: 10.14529/met210401
Текст научной статьи Термодинамическое моделирование фазовых равновесий в системе SrO-Al2O3
Изучение фазовых равновесий, реализующихся в системе SrO–Al2O3, представляет интерес в связи с тем, что данная система входит в состав шлаковой фазы как при производстве новых марок ферросплавов с добавками стронция [1], так и при производстве сталей, модифицированных стронцийсодержащими сплавами [2–5].
В литературе имеются данные по диаграмме состояния системы SrO–Al2O3 [1, 6–14], которые достаточно сильно отличаются между собой. Так согласно большинству авторов в системе SrO–Al2O3 образуются пять алюминатов стронция: Sr4Al2O7, Sr3Al2O6, SrAl2O4, SrAl4O7, SrAl12O19. Однако в работе [10] помимо указанных соединений обсуждается возможность образования еще двух алюминатов – Sr5Al2O8 и Sr4Al14O25, а в работе [11], наоборот, указывается на наличие только четырех соединений в исследуемой системе (отсутствует биалюминат стронция). Согласно сведениям из разных источников различен и характер плавления указанных выше соединений (конгруэнтный или инконгруэнтный), а температуры как для плавления соединений, так и для эвтектических превращений отличаются у некоторых авторов почти на сто пятьдесят градусов. Таким образом, система SrO–Al2O3 требует дополнительных исследований, в том числе и оценки реализующихся фазовых равновесий с позиций термодинамического анализа.
Целью настоящей работы является термодинамическое моделирование фазовых равновесий в системе SrO–Al2O3 с последующим построением диаграммы состояния данной системы.
Методика моделирования
Подробно методика используемого нами термодинамического моделирования фазовых равновесий в диаграммах состояния оксидных систем приведена в работах [15–17]. Кратко методику моделирования оксидных систем можно описать следующим образом. Согласно используемым алгоритмам расчет опирается на экспериментальные данные (из представленных в литературе) по координатам (составе и температуре) характерных точек
Физическая химия и физика металлургических систем фазовых диаграмм: точек эвтектических, перитектических, фазовых переходов и т. п. С учетом этих данных подбираются параметры выбранной для расчета термодинамической модели, и далее просчитывается полностью вся линия или поверхность ликвидус исследуемой системы.
Значения параметров используемой термодинамической модели определяются в процессе решения систем нелинейных уравнений, для чего применяется метод Ньютона. Для составления уравнений необходимы (как уже говорилось ранее) данные о координатах ряда характерных точек, выбранных на линии или поверхности ликвидус фазовых диаграмм. Для каждой характерной точки составляется выражение, связывающее ее координаты с параметрами используемой для расчета термодинамической модели.
Значения координат характерных точек могут отличаться согласно различным вариантам диаграммы состояния, приведенным в литературе. Соответственно, для каждого из имеющихся вариантов диаграммы состояния были подобраны энергетические параметры теории и оценены значения констант равновесия реакций образования алюминатов стронция из компонентов оксидного расплава. Затем была проведена термодинамическая оценка полученных расчетных данных (оценивали параметры используемой термодинамической модели, расчетные значения активностей оксидного расплава, данные по фазовым переходам (например, константы, характеризующие процесс перехода твердого вещества в жидкое состояние), а также вид по- лученной линии или поверхности ликвидус). На основании проведенной оценки выбирали наилучший вариант, при этом возможно некоторое отличие значений координат характерных точек по отношению к оригинальным литературным данным, если варьирование (как правило, незначительное) приводило к улучшению показателей для термодинамической оценки результатов.
Результаты и их обсуждение
Для системы SrO–Al 2 O 3 наиболее оптимальные результаты по термодинамическому моделированию были получены при использовании для расчета активностей оксидного расплава модели субрегулярных ионных растворов [15] с энергетическими параметрами Q 1112 = –104 349; Q 1122 = –217 689; Q 1222 = –104 436 Дж/моль. Термодинамические данные по полученным константам, характеризующим процесс перехода твердого вещества в жидкое состояние, используемым при расчете диаграммы состояния системы SrO–Al 2 O 3 , приведены в табл. 1.
Результаты моделирования фазовых равновесий и диаграммы состояния системы SrO–Al 2 O 3 в сравнении с литературными данными приведены на рисунке и в табл. 2.
Согласно проведенной термодинамической оценке наиболее стабильными в системе являются пять соединений Sr 4 Al 2 O 7 , Sr 3 Al 2 O 6 , SrAl 2 O 4 , SrAl 4 O 7 , SrAl 12 O 19 , что совпадает с данными работ [1, 6–9]. Алюминаты стронция Sr 3 Al 2 O 6 и SrAl 2 O 4 имеют конгруэнтный характер плавления, остальные три соединения – инконгруэнтный. Полученный вид линии
Термодинамические данные для реакций фазовых превращений, K пл – константа плавления оксидов и их соединений
Таблица 1
|
№ |
Реакция |
lg K пл = – A / T + B |
Источник |
|||
|
A |
B |
|||||
|
1 * |
|FeO| = (FeO) |
1749 |
1,059 |
[18, 19] |
||
|
2* |
|SrO| = (SrO) |
4229 |
1,507 |
[20] |
||
|
3 * |
|Al 2 O 3 | = (Al 2 O 3 ) |
5683 |
2,447 |
[18] |
||
|
4 |
1 |
FeA^ 1 = (FeO) + (AI 2 O 3 ) |
11 366 |
4,568 |
[17] |
|
|
5 |
Sr 4 Al 2 O 7 |
= 4(SrO) + (AI 2 O 3 ) |
9023 |
–0,908 |
Данная работа |
|
|
6 |
Sr 3 Al 2 O 6 |
= 3(SrO) + (AI 2 O 3 ) |
11 797 |
1,020 |
Данная работа |
|
|
7 |
SrAl 2 O 4 1 = (SrO) + (AI 2 O 3 ) |
9101 |
1,533 |
Данная работа |
||
|
8 |
SrAl 4 O 7 1 = (SrO) + 2(А1 2 0 з ) |
7653 |
0,449 |
Данная работа |
||
|
9 |
1 |
SrAl i2 0 i9 1 = (SrO) + 6(А1 2 0 з ) |
16 523 |
3,546 |
Данная работа |
|
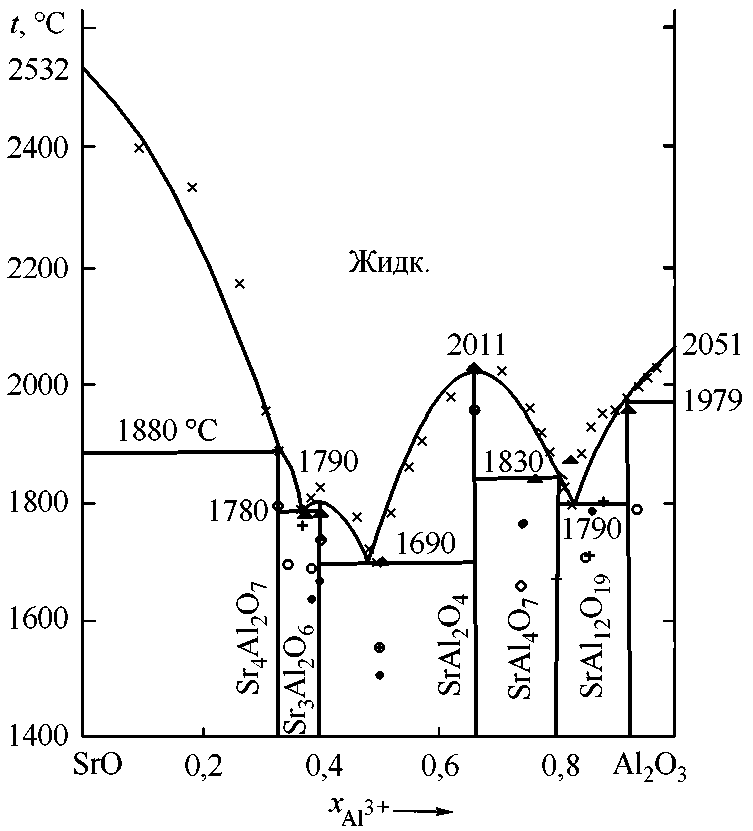
Диаграмма состояния системы SrO–Al 2 O 3 : –– – расчет, данная работа; • – [6]; ○ – [7]; × – [8]; + – [9]; ▲ – [10]
Таблица 2
Инвариантные точки системы SrO–Al 2 O 3
|
Фазовое равновесие |
Характер инвариантного превращения |
Состав, ион. доля Al 2 O 3 |
t , °С |
Источник |
|
SrO + Sr 4 Al 2 O 7 + жидкость |
Перитектика |
0,347 |
1690 |
Massazza F. [6] |
|
0,355 |
1765 |
Ye X. [9] |
||
|
0,324 |
1800 |
Ганиц Ф. [7] |
||
|
0,333 |
1880 |
Starczewski M. [8] |
||
|
0,333 |
1880 |
Данная работа |
||
|
Sr 4 Al 2 O 7 + Sr 3 Al 2 O 6 + жидкость |
Эвтектика |
0,381 |
1630 |
Massazza F. [6] |
|
0,392 |
1731 |
Ye X. [9] |
||
|
0,368 |
1781 |
Shukla A. [10] |
||
|
0,384 |
1687 |
Ганиц Ф. [7] |
||
|
0,374 |
1780 |
Starczewski M. [8] |
||
|
0,374 |
1780 |
Данная работа |
||
|
Sr 3 Al 2 O 6 + жидкость |
Плавление |
0,400 |
1660 |
Massazza F. [6] |
|
1735 |
Ye X. [9] |
|||
|
1782 |
Shukla A. [10] |
|||
|
1736 |
Ганиц Ф. [7] |
|||
|
1820 |
Starczewski M. [8] |
|||
|
1790 |
Данная работа |
|||
|
Sr 3 Al 2 O 6 + SrAl 2 O 4 + жидкость |
Эвтектика |
0,492 |
1505 |
Massazza F. [6] |
|
0,525 |
1557 |
Ye X. [9] |
||
|
0,496 |
1706 |
Shukla A. [10] |
||
|
0,496 |
1560 |
Ганиц Ф. [7] |
||
|
0,496 |
1690 |
Starczewski M. [8] |
||
|
0,482 |
1690 |
Данная работа |
Физическая химия и физика металлургических систем ликвидус имеет наибольшее соответствие с экспериментальными данными M. Starczewski [8], так как по проведенным расчетам, представленные именно им характерные точки на исследуемой диаграмме позволяют получить термодинамически значимый комплект расчетных данных, включая адекватное описание активностей оксидного расплава и вид положения линии ликвидус. При использовании данных других авторов константы, характеризующие процесс перехода твердого вещества в жидкое состояние для алюминатов стронция, имеют большие отрицательные значения, что с позиций термодинамического анализа не имеет смысла. Следует отметить, что эти константы отражают оценочные значения энтальпий и энтропий образования данных соединений из компонентов оксидного расплава и не могут численно выражаться большими отрицательными значениями.
Заключение
Проведены термодинамическая оценка и расчет фазовых равновесий в системе SrO–Al 2 O 3 с использованием теории субрегулярных ионных растворов. На основании этих расчетов построена диаграмма состояния данной системы (определено положение линии ликвидус). Согласно проведенной термодинамической оценке наиболее стабильными в системе являются пять соединений Sr4Al2O7, Sr 3 Al 2 O 6 , SrAl 2 O 4 , SrAl 4 O 7 , SrAl 12 O 19 , что совпадает с большинством из имеющихся литературных данных. В ходе работы были оценены константы, характеризующие процесс перехода твердого вещества в жидкое состояние. Для алюминатов стронция эти константы отображают энтальпии и энтропии их образования из компонентов оксидного расплава.
Окончание табл. 2
|
Фазовое равновесие |
Характер инвариантного превращения |
Состав, ион. доля Al 2 O 3 |
t , °С |
Источник |
|
SrAl 2 O 4 + жидкость |
Плавление |
0,667 |
1960 |
Massazza F. [6] |
|
1960 |
Ye X. [9] |
|||
|
2016 |
Shukla A. [10] |
|||
|
1960 |
Ганиц Ф. [7] |
|||
|
2015 |
Starczewski M. [8] |
|||
|
2011 |
Данная работа |
|||
|
SrAl2O4 + SrAl4O7 + жидкость |
Эвтектика |
0,734 |
1760 |
Massazza F. [6] |
|
0,737 |
1660 |
Ганиц Ф. [7] |
||
|
0,754 |
1830 |
Shukla A. [10] |
||
|
Перитектика |
0,800 |
1664 |
Ye X. [9] |
|
|
0,800 |
1830 |
Starczewski M. [8] |
||
|
0,800 |
1830 |
Данная работа |
||
|
SrAl 4 O 7 + SrAl 12 O 19 + жидкость |
Перитектика |
0,825 |
1857 |
Shukla A. [10] |
|
Эвтектика |
0,852 |
1780 |
Massazza F. [6] |
|
|
0,843 |
1704 |
Ye X. [9] |
||
|
0,846 |
1710 |
Ганиц Ф. [7] |
||
|
0,825 |
1790 |
Starczewski M. [8] |
||
|
0,838 |
1790 |
Данная работа |
||
|
SrAl12O19 + Al2O3 + жидкость |
Перитектика |
0,874 |
1794 |
Ye X. [9] |
|
0,920 |
1962 |
Shukla A. [10] |
||
|
0,934 |
1790 |
Ганиц Ф. [7] |
||
|
0,922 |
1960 |
Starczewski M. [8] |
||
|
0,934 |
1979 |
Данная работа |
||
|
SrO + жидкость |
Допол. точка |
0,292 |
2000 |
Данная работа |
|
Al 2 O 3 + жидкость |
Допол. точка |
0,951 |
2000 |
Данная работа |
Список литературы Термодинамическое моделирование фазовых равновесий в системе SrO-Al2O3
- Tang, K. Thermodynamic evaluation of Sr-containing Si metals and silicate melts for Si–Sr alloy production / K. Tang, L.K. Jakobsson, K. Hildal // Journal of the Southern African Institute of Mining and Metallurgy. – 2018. – Vol. 118, no. 6. – Р. 601–605. DOI: 10.17159/2411-9717/2018/v118n6a7
- Экспериментальное исследование рафинирования и модифицирования стали сплавами Si–Ca, Si–Sr и Si–Ba / И.В. Бакин, Н.А. Шабурова, И.В. Рябчиков и др. // Сталь. – 2019. – № 8. – С. 14–18.
- Breitzmann, M. Refining of steel melts using alkaline earth metals / M. Breitzmann, H.-J. Engell, D. Janke // Steel Research. – 1988. – Vol. 59, no. 7. – P. 289–294. DOI: 10.1002/srin.198801505
- Модифицирование стали барием и стронцием / И.Д. Рожихина, О.И. Нохрина, В.И. Дмитриенко, М.А. Платонов // Известия высших учебных заведений. Черная металлургия. – 2015. – Т. 58, № 12. – С. 871–876. DOI: 10.17073/0368-0797-2015-12-871-876
- Methods for improving the efficiency of steel modifying / I.V. Bakin, G.G. Mikhailov, V.A. Golubtsov et al. // Materials Science Forum. – 2019. – Vol. 946. – P. 215–222. DOI: 10.4028/www.scientific.net /MSF.946.215
- Massazza, F. Il Systema SrO–Al2O3 // La Chimica e l'industria. – 1959. – Vol. XLI, no. 2. – P. 108–115.
- Ганиц, Ф. Система SrO–Al2O3 / Ф. Ганиц, Т.Ю. Чемникова, Ю.П. Удалов // Журнал неорганической химии. – 1979 – Т. XXIV, вып. 2. – С. 471–475.
- Starczewski, M. Treatise on Solid State Reactions in the Ternary System SrO–Al2O3–SiO2 / M. Starczewski // Zeszyty Nauk. Politech. Slask. Chem. – 1964. – Vol. 22. – P. 5–75.
- Thermodynamic description of SrO–Al2O3 system and comparison with other systems. / X. Ye, W. Zhuang, J. Wang et al. // J. Phase Equilib. Diffus. – 2007. – Vol. 28. – P. 362–368. DOI: 10.1007/s11669-007-9086-x
- Shukla, A. Development of a Critically Evaluated Thermodynamic Databse for the Systems Containing Alkaline-Earth Oxides (PhD thesis, École Polytechnique de Montréal). – 2012. – 321 p.
- Sung, Y.-M. Sintering and crystallization of off-stoichiometric SrO∙Al2O3∙2SiO2 glasses / Y.-M. Sung, S. Kim // Journal of Materials Science. – 2000. – Vol. 35, no. 17. – P. 4293–4299. DOI: 10.1023/a:1004880201847
- Capron, M. Strontium Dialuminate SrAl4O7: Synthesis and Stability / M. Capron, A. Douy // Journal of the American Ceramic Society. – 2004. – Vol. 85, no. 12. – P. 3036–3040. DOI: 10.1111/j.1151-2916.2002.tb00575.x
- Корогодская, А.Н. Термодинамическая база данных огнеупорных алюминатов стронция / А.Н. Корогодская, Г.Н. Шабанова // Зб. наукових праць ПАТ «УкрНДІВогнетривів ім. А.С. Бережного». – 2012. – № 112. – С. 208–213.
- Phase Transition in SrAl2O4 / S. Ito, S. Banno, K. Suzuki, M. Inagaki // Zeitschrift Für Physikalische Chemie. – 1977. – Vol. 105, no. 3–4. – P. 173–178. DOI: 10.1524/zpch.1977.105.3_4.173
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. – М.: Издат. Дом МИСиС. – 2009. – 520 с.
- Самойлова, О.В. Термодинамическое моделирование фазовой диаграммы системы Cu2O–Na2O–K2O / О.В. Самойлова, Л.А. Макровец, Е.А. Трофимов // Вестник Московского университета. Серия 2: Химия. – 2018. – Т. 59, № 3. – C. 196–204.
- Samoilova, O.V. Thermodynamic Modeling of Phase Equilibria in the FeO–MgO–Al2O3 System / O.V. Samoilova, L.A. Makrovets // Materials Science Forum. – 2020. – Vol. 989. – P. 3–9. DOI: 10.4028/www.scientific.net/msf.989.3
- Кубашевский, О. Металлургическая термохимия / О. Кубашевский, С.Б. Олкокк. – М.: Металлургия, 1982. – 392 с.
- Darken, L.S. The system iron–oxygen. II. Equilibrium and thermodynamics of liquid oxide and other phases / L.S. Darken, R.W. Gurry // Journal of American Chemical Society. – 1946. – Vol. 68. – P. 798–816. DOI: 10.1021/ja01209a030
- Иргашов, Х. Термодинамические свойства оксида стронция в твердой и жидкой фазах / Х. Иргашов, В.Д. Тарасов, В.Я. Чеховской // Теплофизика высоких температур. – 1985. – Т. 23, № 1. – С. 86–91.


