Термодинамическое моделирование образования боридов и карбидов переходных металлов в вакууме
Автор: Ким Туяна Бэликовна, Халтанова Валентина Михайлова, Смирнягина Наталья Назаровна
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Физика
Статья в выпуске: 3, 2011 года.
Бесплатный доступ
Рассмотрены особенности образования карбидов хрома и вольфрама при высоких температурах и низком давлении. Термодинамически смоделированы фазовые равновесия, протекающие при восстановлении оксидов переходных металлов углеродом в вакууме.
Карбиды хрома, синтез в вакууме, термодинамическое моделирование
Короткий адрес: https://sciup.org/148180194
IDR: 148180194 | УДК: 621.9.048.7:669.15'74
Текст научной статьи Термодинамическое моделирование образования боридов и карбидов переходных металлов в вакууме
Электронно-лучевые технологии занимают видное место среди принципиально новых технологий, подлежащих широкому внедрению в народное хозяйство. При отработке и оптимизации технологии электронно-лучевого борирования (насыщения поверхности бором) или карбидизации (насыщение поверхности углеродом) очень важно не только проведение экспериментальных работ, но и численное моделирование процесса формирования боридного покрытия.
В [1, 2] выполнено термодинамическое моделирование физико-химических и фазовых превращений, протекающих при синтезе боридов переходных металлов (Ti, Zr, V), показана важная роль промежуточных карбидов в фазообразовании. Бориды хрома и вольфрама, особенно покрытия на их основе, выгодно отличаются среди других боридов переходных металлов своими максимальными эксплуатационными характеристиками, в частности, высокой износостойкостью [3]. Моделирование образования боридов хрома и вольфрама невозможно ввиду отсутствия термодинамических свойств некоторых боридов. Однако на первом этапе необходимо и возможно термодинамическое исследование образования карбидов.
Оксиды переходных металлов и углерод широко применяются в промышленности для получения порошков карбидов с размером частиц от 1 до 40 мкм [4, 5]. Однако процесс осуществляется при температурах от 1500 до 2000°С. Реакция взаимодействия оксидов металлов и углерода является экзотермической и сопровождается выделением газообразного продукта (оксида углерода СО), что вызывает повышение общего давления в системе. С целью смещения химического равновесия и снижения температур взаимодействия и образования карбидов необходимо уменьшать общее давление в системе. Это открывает путь для поиска условий, при которых возможно образование карбидов при температурах на поверхности железоуглеродистых сплавов, без оплавления последней, например в вакууме.
В настоящей работе приведены результаты термодинамических расчетов, моделирующих взаимодействие оксидов переходных металлов c углеродом. Выполнено термодинамическое исследование фазовых равновесий в системах Cr-C-O, W-C-O. При выборе условий синтеза карбидов учитывали температуру и общее давление в системе, а также общие энергозатраты.
Методика термодинамических расчетов
Термодинамическое моделирование выполнено с помощью программного комплекса АСТРА 4/рс. Расчеты проведены в температурном интервале 273-3873 К при варьировании общего давления в системе в диапазоне от 105 до 10-4 Па. Термодинамические расчеты позволили при каждой температуре определить мольные составы фаз, давление газообразных компонентов, термодинамические свойства, в том числе полную энтальпию Н, энтропию S, равновесную теплоемкость Сp. Анализ зависимости Н(T) в определенных температурных интервалах предоставил возможность выявить резкие изменения, которые можно было отнести к фазовым или химическим равновесным превращениям, связанным с образованием новых или промежуточных соединений. Изменение полной энтальпии Н при температуре завершения превращения, отнесенное к числу молей конденсированного вещества при температуре начала резкого увеличения Н, близко к величинам тепловых эффектов Δ H равновесных превращений [6].
Результаты и их обсуждение
Карбиды хрома . В двойной системе Cr-C образуется 3 карбида – Cr 3 C 2 , Cr 7 C 3 , Cr 23 C 6 [4]. В зависимости от температуры среды и соотношения реагирующих компонентов возможно протекание следующих реакций с образованием различных карбидов:
Cr 3 C 2 3Cr 2 O 3 + 13C= 2Cr 3 C 2 + 9CO (1)
Cr 7 C 3 7Cr 2 O 3 + 27C= 2Cr 7 C 3 + 21CO (2)
Cr 23 C 6 23Cr 2 O 3 + 81C= 2Cr 23 C 6 + 69CO (3)
Процесс взаимодействия оксида хрома с углеродом очень чувствителен к давлению газовой среды, роль которой на разных этапах взаимодействия существенно меняется. В начальный период восста- новления лимитирующей стадией является кристаллохимическая перестройка оксида в низший, металл или карбид. Затем протекает с относительно небольшой скоростью регенерация оксида углерода СО. В последующем, возрастает роль газификации углерода, поэтому процесс взаимодействия становится чувствительным к давлению газовой среды. К концу взаимодействия, когда заметно уменьшается поверхность реакционной зоны, при наличии избытка углерода вновь лимитирующей становится кристаллохимическая стадия.
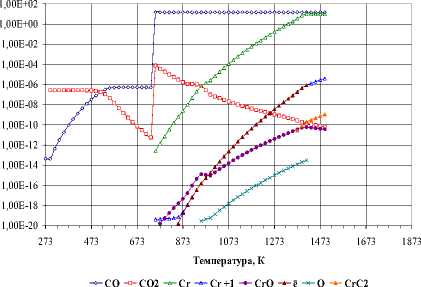
Карбид Cr 3 C 2 является самым термически устойчивым соединением среди остальных карбидов, инконгруэнтно плавящихся [4, 5]. На рис. 1 представлено влияние общего давления газовой фазы на температуру образования карбида Cr 3 C 2 в стехиометрической смеси 6 Cr:9 О:13C. Температура образования карбида Cr3C2 снижается с 1413 до 713 К при снижении давления от 105 до 10-4 Па. Весьма интересно взаимодействие оксида хрома при давлении в диапазоне от 10-4 до 10 Па. В этой области давлений наблюдается образование однофазного карбида Cr 3 C 2 , который далее разлагается. При этом хром переходит в газовую фазу, а остающийся остаток конденсированного углерода в виде кластеров появляется в газовой фазе при более высокой температуре (рис. 1).
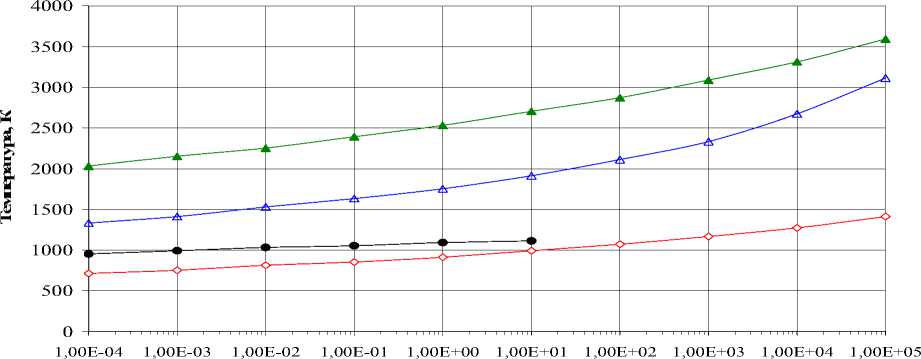
Давление, Па
Cr3C2,C
Cr3C2 C —▲— пар
Рис. 1. Температуры образования карбида Cr 3 C 2 в стехиометрической смеси 6Cr:9О:13C
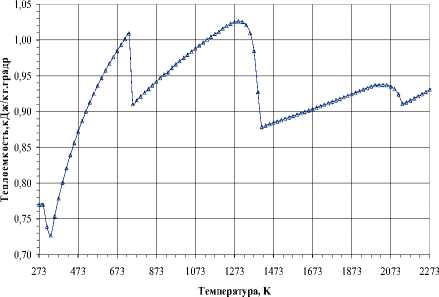
На рис. 2. представлено изменение термодинамических свойств при давлении 10-3 Па. Взаимодействие оксида хрома Cr 2 O 3 с углеродом наблюдается при температуре 733 К и сопровождается тепловым эффектом ∆Н= -1127 кДж/моль. Следует отметить, что этот тепловой эффект является суммарным двух процессов – восстановления Cr 2 O 3 и газификации С. Изменение фазового состава в стехиометрической смеси 6Cr:9О:13C подтверждает химическое взаимодействие при температуре 733 К. Газификация углерода (взаимодействие с оксидом СО 2 ) с образованием оксида СО протекает преимущественно в области температур от 453 К до химического взаимодействия, далее до температуры 873 К. Оксид хрома Cr 2 O 3 в этих условиях частично восстанавливается до хрома, который переходит в газовую фазу. Однофазный карбид Cr 3 C 2 фиксируется лишь в температурном интервале от 873 до 1033 К, загрязняется примесью углерода, далее с 1273 К начинает разлагаться, а при дальнейшем повышении температуры до 1373 К полностью отсутствует. Разложение карбида Cr 3 C 2 происходит в присутствии газовой фазы, содержащей оксиды углерода СО и СО 2 . Содержание последнего оксида в газовой фазе уменьшается с повышением температуры, при этом появляются пары оксида хрома CrО. Хром ионизируется, появляются его кластеры. Следует отметить, что следы примеси углерода исчезают в температурном интервале от 1653 до 2153 К за счет испарения, при этом в газовой фазе появляются пары и кластеры углерода. Наблюдаемые особенности поведения конденсированных фаз карбида Cr 3 C 2 и углерода проявляются в присутствии газовой фазы, содержащей оксиды СО и СО 2 . Карбид Cr 3 C 2 неустойчив в диапазоне давлений от 10-4 до 10 Па, разлагается вследствие диссоциации, в результате которой наблюдается интенсивное испарение хрома.
Можно представить суммарную последовательность химических превращений:
Сr 2 O 3 + CO ↔ Cr + CO 2
C + CO 2 ↔ 2 CO
Cr 2 O 3 + C = Cr + CO
Cr + C = Cr 3 C 2
Карбид Cr 7 C 3 . Взаимодействие оксида Cr 2 O 3 с углеродом протекает ступенчато, карбид Cr 7 C 3 образуется через стадию формирования Cr 3 C 2 . Однофазный Cr 7 C 3 в исследуемом стехиометрическом составе не образуется, в качестве примеси в нем присутствует карбид Cr 3 C 2 . Карбид Cr 7 C 3 в присутствии газовой фазы, содержащей оксиды углерода СО и СО 2 , разлагается, образуя Cr 3 C 2 , который, в свою очередь, диссоциирует с образованием углерода. Следует отметить, что в этом стехиометрическом составе также наблюдается газификация, в результате которой образуются оксиды углерода СО и СО 2 (рис. 4).
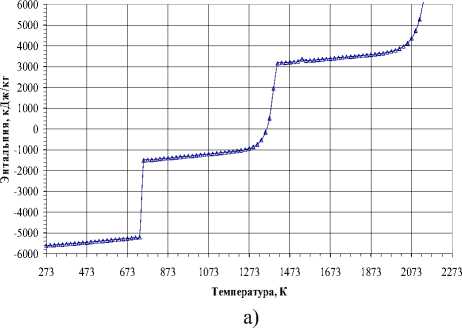
Рис. 2. Термодинамические свойства в стехиометрической смеси 6Cr:9О:13C (10-3 Па): а – ∆Н, б – Ср
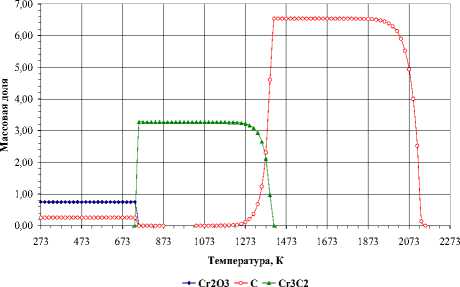
-
а) б)
Рис. 3. Фазовый состав в стехиометрической смеси 6Cr:9О:13C (10-3 Па): а – конденсированная фаза, б – газовая фаза
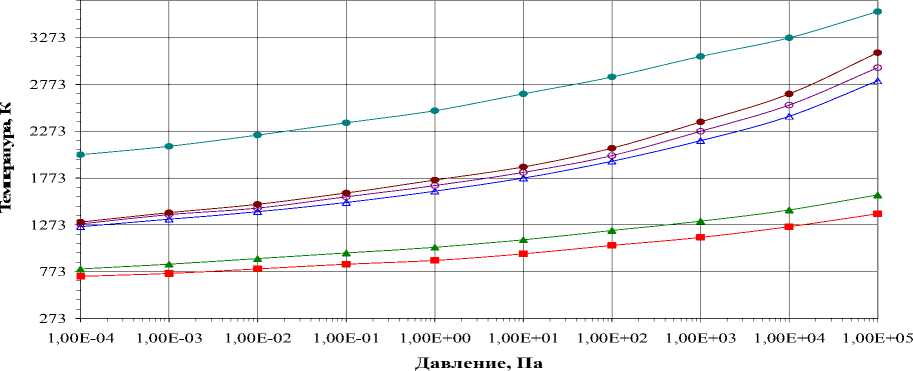
Характер взаимодействия не меняется в зависимости от изменения общего давления в системе давления. Изменения энтальпии и теплоемкости демонстрируют стадийность процесса образования карбида Cr 7 C 3 . Так, при Р=105 Па взаимодействие начинается с образования Cr 3 C 2 при температуре 1393 К, а при давлении 10-3 Па фиксируется снижение температуры до 763 К. Образование карбида Cr 7 C 3 можно наблюдать при 1603 К (105 Па), а при давлении 10-3 Па – 843 К соответственно. Тепловой эффект реакции образования карбида Cr 7 C 3 составляет ∆Н= -320,4 кДж/моль. Наблюдающиеся изменения теплоемкости в температурных интервалах 1593-1613 К и 2053-2073 К, вероятно, связаны с диссоциацией карбидов Cr 7 C 3 Cr 3 C 2 , в результате которой образуются промежуточные соединения от Cr 3 C 2 до углерода.
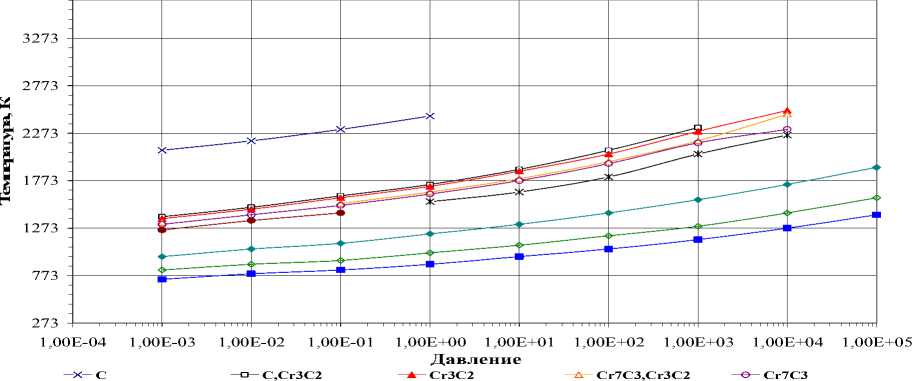
Карбид Cr 23 C 6 . Взаимодействие оксида Cr 2 O 3 с углеродом протекает сложно, многостадийно. В качестве промежуточных фаз можно последовательно наблюдать двухфазные области, содержащие Cr 2 O 3 и Cr 3 C 2 , Cr 2 O 3 и Cr 7 C 3 , Cr 7 C 3 и Cr 23 C 6 , Cr 7 C 3 и Cr 3 C 2 , Cr 3 C 2 и углерод, однофазные карбиды Cr 7 C 3 , Cr 3 C 2 . В диапазоне давлений от 105 до 1 Па в стехиометрических составах можно наблюдать в качестве промежуточных фаз металлический хром в сочетании с карбидами Cr 23 C 6 и Cr 7 C 3
(рис. 5). Температурные зависимости энтальпии, теплоемкости и энтропии демонстрируют многостадийность процесса взаимодействия и образования карбида Cr 23 C 6 и всех промежуточных фаз.
■ Cr2O3,Cr3C2 ■ ▲ Cr3C2,Cr7C3 Cr3C2 Cr3C2,C • C • пар
Рис. 4. Температуры образования карбида Cr 7 C 3 в стехиометрической смеси 14Cr:27C:21O
• Cr7C3,Cr23C6 ♦ Cr2O3,Cr7C3 Cr2O3,Cr3C2 ■ Cr2O3,C —ж— Cr, Cr7C3,Cr23C6
Рис. 5. Температуры образования карбида Cr23C6 в стехиометрической смеси 46Cr:81C:69O
Таким образом, термодинамические расчеты показали, что возможно образование однофазных карбидов хрома Cr 23 C 6 , Cr 7 C 3 и Cr 3 C 2 при более низких температурах в вакууме, чем при атмосферном давлении.
Карбиды вольфрама. Процесс взаимодействия окислов вольфрама с углеродом (сажей), согласно [5], осуществляется по следующим реакциям:
WO 3тв → W0 3 (4)
WO 3 + 2С тв → W тв + СО + СО 2 (5)
W тв + 2WО 3 → 3WО 2тв и г (6)
WО 2 + 2С тв → W тв + 2СО (7)
СО 2 + С → 2СО (8)
W тв + С тв → WC тв (9)
Температура начала взаимодействия триоксида вольфрама с сажей ~720°С [5]. Кинетические кривые процесса взаимодействия, как и в случае окислов молибдена, имеют экстремальный характер. Газовый состав реакционного пространства существенно влияет на скорость взаимодействия.
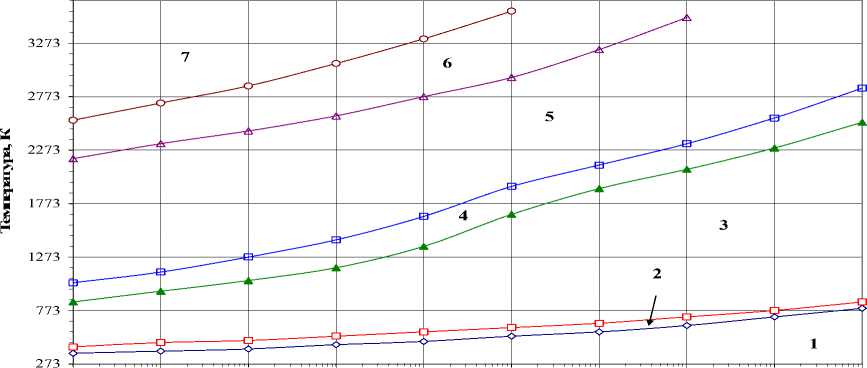
Карбид WC. На рис. 6 представлено влияние давления на температуру образования карбида WC. Взаимодействие WO 3 с углеродом протекает сложно, через стадию образования оксида WO 2 (область 2 , рис. 6), температура образования которого снижается с 793 (105 Па) до 393 К (10-3 Па). Температура образования WC снижается с 853 К (105 Па) до 473 (10-3 Па). В области 3 фиксируется присутствие карбида WC и некоторого количества углерода, который газифицируется в результате взаимодействия с оксидом СО 2 , образуя оксид CO. Снижение общего давления в системе приводит к снижению интервала с 853-2533 до 473-953 К. Особо стоит отметить поведение области 4 , в которой наблюдается снижение температурной устойчивости карбида WC в присутствии газовой среды, содержащей оксиды СО и СО 2 . Изменение состава конденсированной фазы при давлении Р=10-3 Па свидетельствует о сложных фазовых превращениях при синтезе карбида WC (рис. 7а). Первоначально при 393 К образуется WO 2 , который при 473 К реагирует с углеродом, образуя WC. Карбид WC присутствует однофазно только в интервале от 913 до 1133 К. При низких температура (473-913 К) WC содержит в качестве примеси углерод, а при высоких (> 1133 К) – W.
Интервал существования однофазного карбида WC увеличивается до 2533–2853 К (область 4 , рис. 6) при повышении общего давления до 105 Па. В то время как расширяется область 3 (рис.6) до 8532533 К, в которой присутствует в качестве примеси углерод. Изменение состава в газовой фазе (рис. 8б) свидетельствует, что содержание оксида СО 2 , вероятно, связано не только с газификацией углерода (без увеличения СО), но и с диссоциацией СО 2 , в результате должен образовываться атомарный кислород. Далее следует цепь химических превращений, связанных с окислением паров W и т.д.
1.0E-04 1.0E-03 1.0E-02 1.0E-01 1.0E+00 1.0E+01 1.0E+02 1.0E+03 1.0E+04 1.0E+05
Давление, Па
WO2 WC, C —▲— WC WC, W W пар
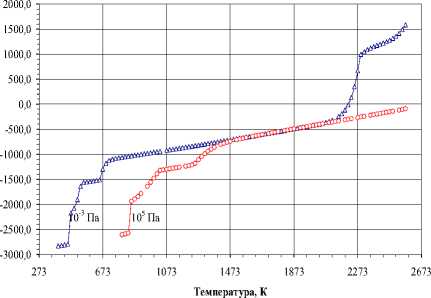
Рис. 6. Характер взаимодействия оксида WO 3 с углеродом (стехиометрический состав W:3О:4C)
а) б)
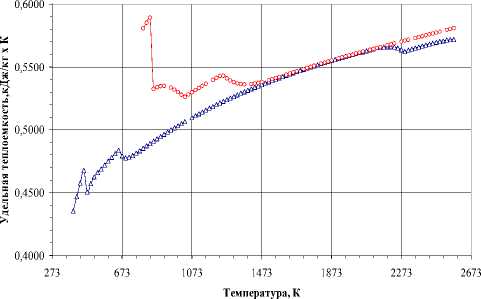
Рис. 7. Термодинамические свойства в стехиометрической смеси W:3О:4C (10-3 Па): а) – ∆Н, б) – Ср
Д.Э. Дашеев, Н.Н. Смирнягина, В.М. Халтанова. Особенности электронно-лучевого борирования низкоуглеродистых сталей в вакууме
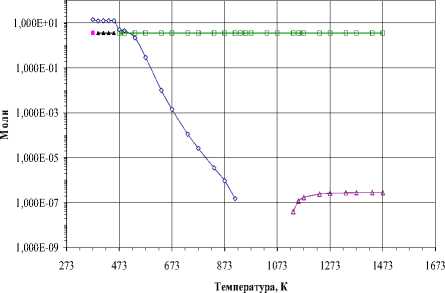
C -•- WO3 —*— WO2 WC W
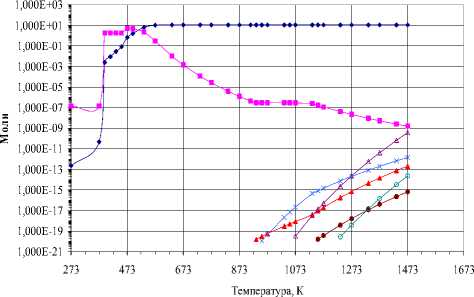
-♦- CO ■ CO2 -*- C2O -X-OC-♦- WO W
-
а) б)
Рис. 8. Фазовый состав в стехиометрической смеси W:3О:4C (10-3 Па):
-
а) – конденсированная фаза, б) – газовая фаза
Термодинамические расчеты, на наш взгляд, убедительно показали возможность синтеза карбидов хрома и вольфрама при низких температурах в вакууме. Появляется возможность синтеза карбидов на поверхности углеродистых сталей без оплавления последней для поверхностного упрочнения.


