Термодинамика процессов взаимодействия иттрия, кальция, магния и алюминия с кислородом в жидкой стали
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Смирнов Леонид Андреевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 2 т.16, 2016 года.
Бесплатный доступ
Иттрий находится в одной группе с лантаном и по своим химическим свойствам близок к лантану, поэтому иттрий относят к редким землям. Иттрий при введении в глубокораскисленный металл измельчает первичное литое зерно, уменьшает зону дентдритообразования, очищает границы зерна от интерметаллидов цветных металлов, измельчает размеры неметаллических включений, повышает жаростойкость и жаропрочность сталей специального назначения. Оптимальная присадка иттрия в металле не превышает 0,3-0,5 %. Комплексное взаимодействие иттрия с кислородом в присутствии в металле остаточных концентраций алюминия, кальция и магния совершенно не изучено. Выполнено термодинамическое моделирование процессов раскисления стали иттрием в присутствии малых концентраций алюминия, кальция или магния. Построены поверхности растворимости компонентов в жидкой стали (ПРКМ) для систем Fe-Y-Al-O-C, Fe-Y-Ca-O-C, Fe-Y-Mg-O-C. Для проведения расчетов определены возможные фазовые равновесия, проведено взаимосогласование зависимостей констант равновесия от температуры, определены энергетические параметры теории субрегулярных ионных растворов применительно к оксидным системам. Из вида ПРКМ следует, что в присутствии кальция и алюминия в стали раскисление иттрием будет проходить как комплексное. В продуктах раскисления будут появляться сложные по фазовому составу оксидные соединения на базе CaO, Al2O3 и Y2O3. В случае раскисления стали иттрием и магнием процесс будет носить альтернативный характер: либо раскислитель иттрий, либо магний.
Термодинамика, фазовые равновесия, диаграммы состояния, иттрий, алюминий, кальций, магний
Короткий адрес: https://sciup.org/147157020
IDR: 147157020 | УДК: 69.017 | DOI: 10.14529/met160201
Текст научной статьи Термодинамика процессов взаимодействия иттрия, кальция, магния и алюминия с кислородом в жидкой стали
Качество металла до сих пор в значительной мере определяется неметаллическими включениями, их фазовым и химическим составом, распределением по объему металла, размерами. Избежать образования неметаллических включений практически невозможно при открытой плавке стали, из-за взаимодействия металла с печной и цеховой атмосферой, технологическим шлаком, футеровкой металловмещающих агрегатов, а так же кристаллизационных явлений. Как правило, при разработке технологии новой марки стали, особое внимание обращается на организацию финишного этапа раскисления и модифицирования стали. Все большее применение в финишном этапе рафинирования стали находят редкоземельные элементы, к которым относится и иттрий, находящийся в одной группе с лантаном, и по химическим свойствам близок к свойствам лантаноидов, но имеет меньшую атомную массу (88,9) и очень высокую температуру кипения (3630 °С) [1]. Получают ит- трий в основном электролизом хлоридных расплавов. В черной металлургии иттрий используется либо в виде сплава с кремнием, либо в виде цериевого мишметалла. В соединениях с металлоидами проявляется валентность III [2, 3]. Сплав силико-иттрий используют в незначительных количествах. Чаще иттрий используется в мишметалле одновременно с церием, лантаном и другими РЗМ [4]. Иттрий, наряду с рафинирующим действием на металл, измельчает и глобулизирует неметаллические включения, повышает жаропрочность и жаростойкость сталей и поэтому применяется при выплавке сталей специального назначения [3]. Украинские исследователи Л.И. Тарасюк и Е.А. Казачков установили, что при введении иттрия в сталь 09Г2С снижаются показатели анизотропии и повышаются пластические характеристики металла при низких температурах [5].
Помимо вводимого иттрия в стали всегда есть некоторое остаточное количество высокоактивных элементов, таких как алюминий, кальций, магний, которые попадают в металл в незначительных количествах, и благодаря восстановительному действию глубокораскисленного металла на технологический шлак, а так же на ковшевую и трактовую футеровку [6, 7]. Для получения достоверных данных об участии введенного иттрия в рафинировании металла необходимо установить влияние участие каждого из этих компонентов на процесс рафинирования стали [8].
Наибольшую информацию о возможных реакциях рафинирования стали иттрием совместно с другими активными элементами можно получить в результате построения диаграмм растворимости взаимодействующих компонентов в жидком металле. Такую диаграмму состояний, на которой указаны составы жидкого металла, равновесного с неметаллической фазой, состав которой задан на сопряженной с областью существования жидкого металла оксидной диаграмме состояния, удобно называть поверхностью растворимости компонентов в металле (ПРКМ). В настоящей работе рассмотрены ПРКМ систем Fe–Y–Al–O–C, Fe–Y–Ca–O–C, Fe–Y–Mg–O–C.
При проведении расчетов активности компонентов жидкой оксидной фазы вычислялись с применением теории субрегулярных ионных растворов, построенной в варианте квадратичной зависимости координационного числа катионов от состава оксидного расплава. Подробно этот вариант теории изложен в монографии [9]. Энергетические параметры теории для оксидных расплавов систем
FeO–Al 2 O 3 –Y 2 O 3 , FeO–CaO–Y 2 O 3 , FeO–MgO–Y 2 O 3 [9, 10] приведены в табл. 1. Активности компонентов жидкой металлической фазы устанавливались с помощью удельных параметров взаимодействия. Значения параметров иттрия с компонентами металлических расплавов в литературе практически OCYY отсутствуют, кроме параметров e Y , e Y , e O , e C . Оценка параметра e Y Al по теории регулярных растворов для расплавов системы позволила получить значение e Y Al =0,039, тогда e Y Al = 0,039·27/89 ≈ 0,001, т. е. исчезающее малая величина, тем более что концентрации и иттрия, и алюминия в глубоко раскисленном металле не будут превышать сотые доли процентов. Данные по параметрам взаимодействия [11–14] представлены в табл. 2.
Данные по температурным зависимостям констант равновесия представлены в табл. 3. Значительная часть этих данных заимствована из справочников [15, 16] либо получена путем косвенных расчетов [10].
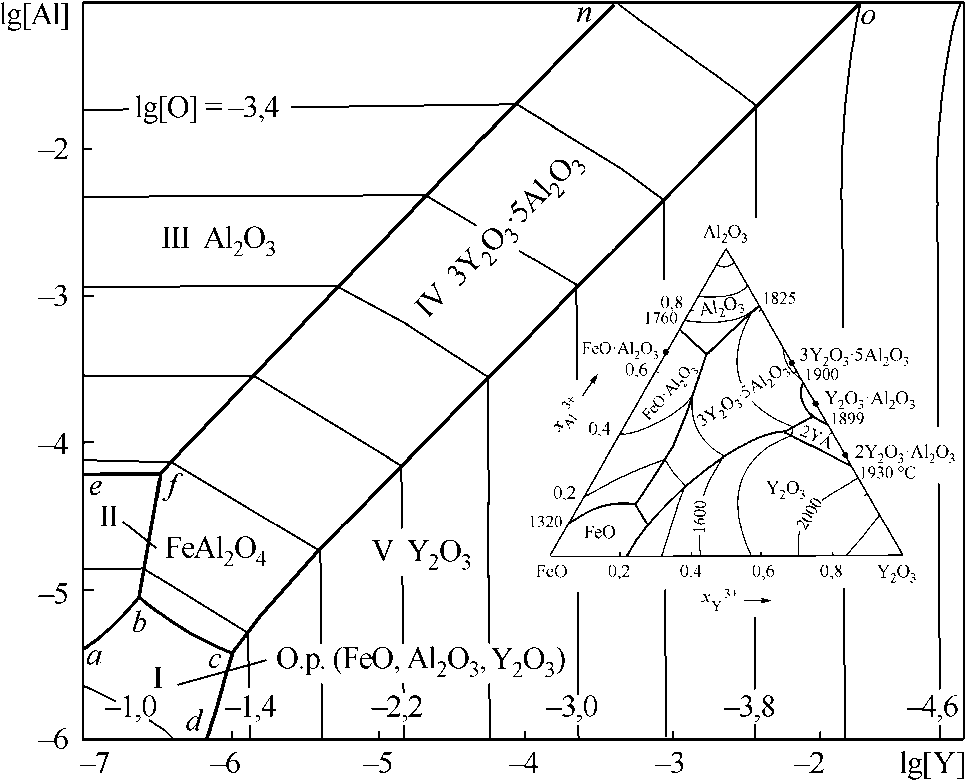
Строение ПРКМ для изучаемых систем приведены на рис. 1–3. На полях ПРКМ указаны составы металла, равновесного с обозначенной оксидной фазой. Так на рис. 1 в области I заданы составы металла, равновесного с оксидным расплавом (FeO, Al 2 O 3 , Y 2 O 3 ) переменного состава, в области II заданы составы металла, равновесного с герцинитом, в области III – с корундом, в области IV – с алюминатом 3Y 2 O 3 ·5Al 2 O 3 , в области V – с Y 2 O 3 . Здесь же указана сопряженная с этим металлом оксидная диаграмма состояний FeO–Al 2 O 3 –Y 2 O 3 .
Таблица 1
Значения параметров теории субрегулярных ионных растворов Q ijkl [9, 10]
|
Система |
Параметры теории Qijkl , кал/моль |
||
|
FeO–Y 2 O 3 |
0 |
0 |
0 |
|
Y 2 O 3 –Al 2 O 3 |
–4186 |
–1835 |
–7105 |
|
Y 2 O 3 –CaO |
–26 845 |
–42 106 |
–21 622 |
|
Y 2 O 3 –MgO |
5515 |
4099 |
2192 |
|
FeO–Y 2 O 3 –Al 2 O 3 |
–50 000 |
20 000 |
–50 000 |
|
FeO–Y 2 O 3 –CaO |
–36 438 |
–54 795 |
–56 469 |
|
FeO–Y 2 O 3 –MgO |
0 |
0 |
0 |
Таблица 2
Удельные параметры взаимодействия, T = 1600 °С для компонентов металлического расплава
|
Элемент i |
Элемент j |
|||||
|
Al |
Y |
Ca |
Mg |
O |
С |
|
|
Al |
0,045 |
– |
–0,0515 |
–0,00998 |
–1,62 |
0,0966 |
|
Y |
– |
0,030 |
– |
– |
–4,41 |
–1,21 |
|
Ca |
–0,0718 |
– |
–0,07 |
–0,1084 |
–3,507 |
–0,324 |
|
Mg |
–0,0089 |
– |
–0,064 |
–0,085 |
–3,008 |
0,14 |
|
O |
–0,96 |
–0,79 |
–1,41 |
–1,98 |
–0,2 |
–0,45 |
|
С |
0,043 |
–0,16 |
–0,34 |
0,07 |
–0,34 |
0,14 |
Таблица 3
Температурные зависимость констант равновесия реакций раскисления стали
|
Реакция |
lg K = – A / T + B |
|
|
A |
B |
|
|
(FeO) = [Fe] + [O] |
6320 |
4,734 |
|
(Y 2 O 3 ) = 2[Y] + 3[O] |
67 028 |
20,19 |
|
(Al 2 O 3 ) = 2[Al] + 3[O] |
58 320 |
18,02 |
|
(MgO) = [Mg] + [O] |
22 457 |
6,54 |
|
(CaO) = [Ca] + [O] |
31 480 |
12,55 |
|
|FeO| = [Fe] + [O] |
8069 |
5,80 |
|
|MgO| = [Mg] + [O] |
26 500 |
7,85 |
|
|CaO| = [Ca] + [O] |
34 103 |
13,46 |
|
|Al 2 O 3 | = 2[Al] + 3[O] |
64 000 |
20,48 |
|
|Y 2 O 3 | = 2[Y] + 3[O] |
71 400 |
21,81 |
|
|FeO·Al 2 O 3 |= [Fe] + 2[Al] + 4[O] |
74 580 |
26,37 |
|
|2Y 2 O 3 ·Al 2 O 3 |= 4[Y] + 2[Al] + 9[O] |
200 210 |
59,882 |
|
|Y 2 O 3 ·Al 2 O 3 |= 2[Y] + 2[Al] + 6[O] |
130 560 |
39,057 |
|
|3Y 2 O 3 ·5Al 2 O 3 |= 6[Y] + 10[Al] + 24[O] |
560 500 |
175,785 |
|
|CaO·2Y 2 O 3 |= [Ca] + 4[Y] + 7[O] |
178 305 |
55,181 |
|
|CaO·Y 2 O 3 |= [Ca] + 2[Y] + 4[O] |
106 769 |
34,066 |
|
|3CaO·Y 2 O 3 |= 3[Ca] + 2[Y] + 6[O] |
173 384 |
58,815 |
|
{CO} = [C] +[O] |
1168 |
–2,07 |
|
{CO 2 } = [C] +2[O] |
9616 |
2,51 |
|
{Ca} = [Ca] |
–1912 |
–2,69 |
|
{Mg} = [Mg] |
–6670 |
–6,48 |
На рис. 1, б в области VI заданы составы кипящего металла. Образование Y2O3·Al2O3, и 2Y2O3·Al2O3 в качестве неметаллических включений возможно при температурах выше 1800 °С.
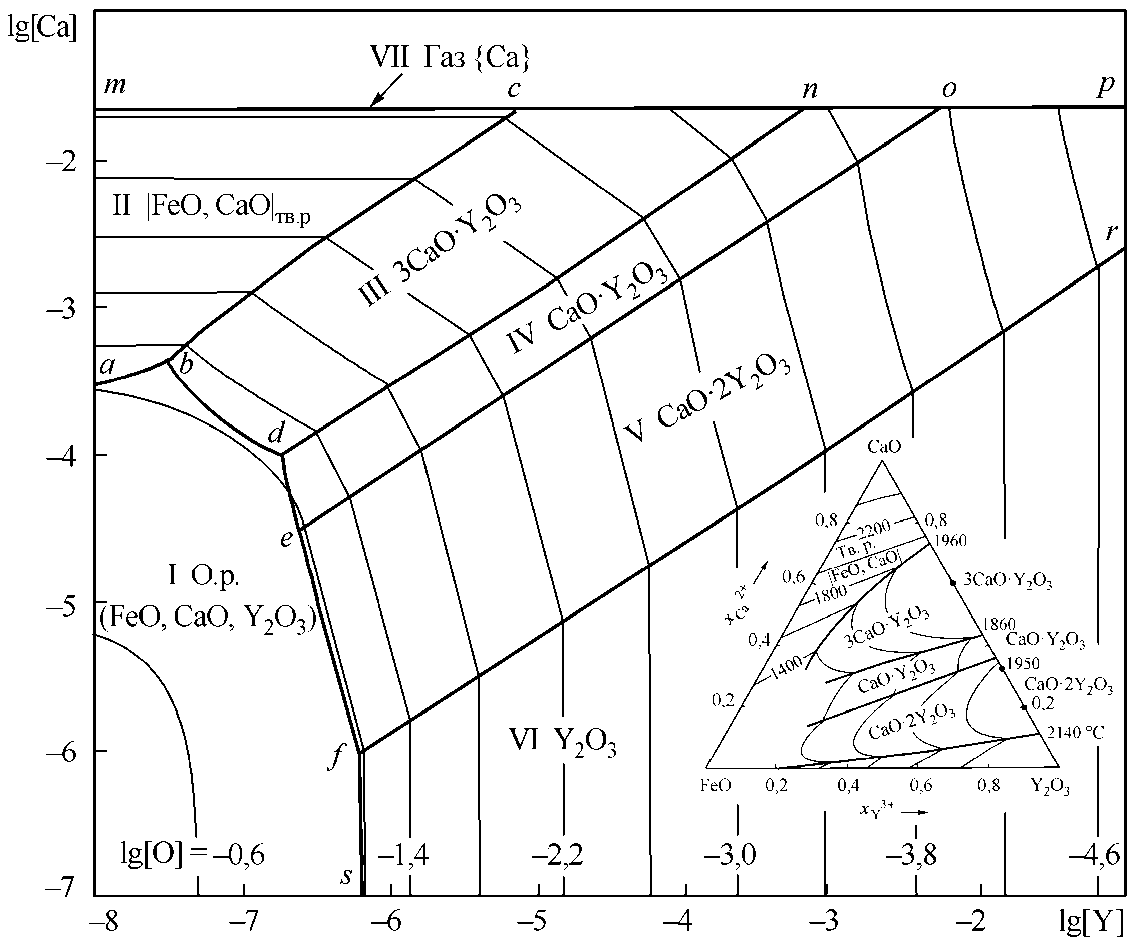
Фазы, образующиеся в жидком металле системы Fe–Y–Ca–O–C в качестве неметаллических включений представлены на рис. 2. На рис. 2, а приведено строение диаграммы FeO–CaO2–Y2O3, сопряженной с областью существования металлических расплавов. Так же на полях представлены составы металла, равновесного с обозначенными фазами. На контрастных линиях заданы составы металла, равновесного с двумя смежными оксидными фазами. Так на линии ab заданы составы металла, равновесного с оксидным расплавом (FeO, CaO, Y2O3) и твердыми растворами FeO в CaO, на линии bd заданы составы металла, равновесного с 3CaO·Y2O3 и с оксидным расплавом. На линии de задан состав металла, равновесного с CaO·Y2O3 и с оксидным расплавом, на линии ef – с CaO·2Y2O3 и с оксидным расплавом, на линии fs – с оксидным расплавом и Y2O3. В точках пересечения трех контрастных линий задан состав металла, равновесного с тремя оксидными фазами. Так, например, в точке f задан состав металла, равновесного с Y2O3, CaO·2Y2O3 и оксидным расплавом. В связи с тем, что кальций имеет высокую упругость пара, при избыточных количествах кальция в условиях закрытой плавки может уста- новиться равновесие с газовой фазой. Линия mcnop есть след от поверхности растворимости кальция в жидком металле, перпендикулярной плоскости рисунка, на которой заданы составы металла, равновесного с парами кальция. На линии mc заданы составы метала, равновесного с твердыми растворами оксидов и паром кальция, на линиях cn, no и op – с паром кальция и 3CaO·Y2O3, CaO·Y2O3 или CaO·2Y2O3 соответственно.
На рис. 2, б видно, что уже при содержании углерода 0,1 мас. % появляется область составов металла, равновесного с газовой фазой {CO, CO2} и примесью паров кальция. Это область IX. Кроме того, вдоль линии tcuhq определены составы металла, равновесного с парами кальция с примесью CO, CO 2 и смежными конденсированными оксидными фазами.
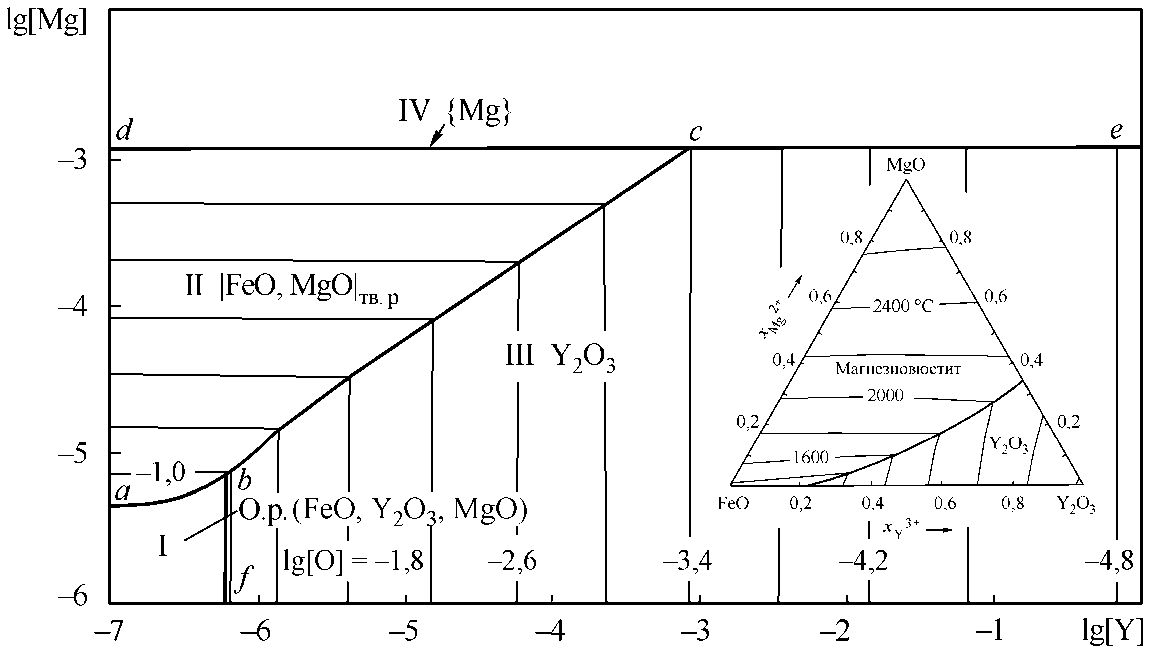
Сведений о наличии двойных или тройных соединений в оксидной системе FeO–MgO–Y2O3 не имеется. ПРКМ систем Fe–Mg–Y–O и Fe–Mg– Y–O–С приведены на рис. 3. Здесь же приведен и проект тройной оксидной диаграммы системы FeO–MgO–Y2O3. Видно, что MgO и FeO образуют непрерывный ряд твердых растворов, и в то же время Y 2 O 3 и FeO – взаимно нерастворимые вещества, и система FeO–Y2O3 где-то вблизи FeO имеет точку эвтектического превращения, как и система MgO–Y 2 O 3 [8]. Тонкими линиями на всех ПРКМ приведены изокислородные сечения.
б)
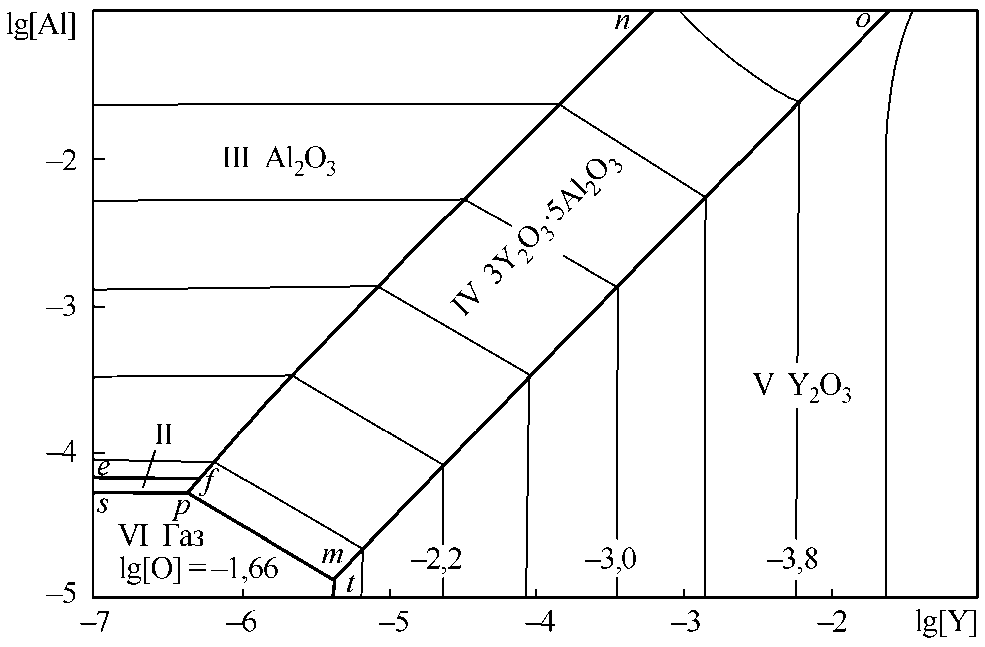
Рис. 1. ПРКМ системы Fe–Al–Y–O–С, Т = 1600 °С, Р общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
а)
б)
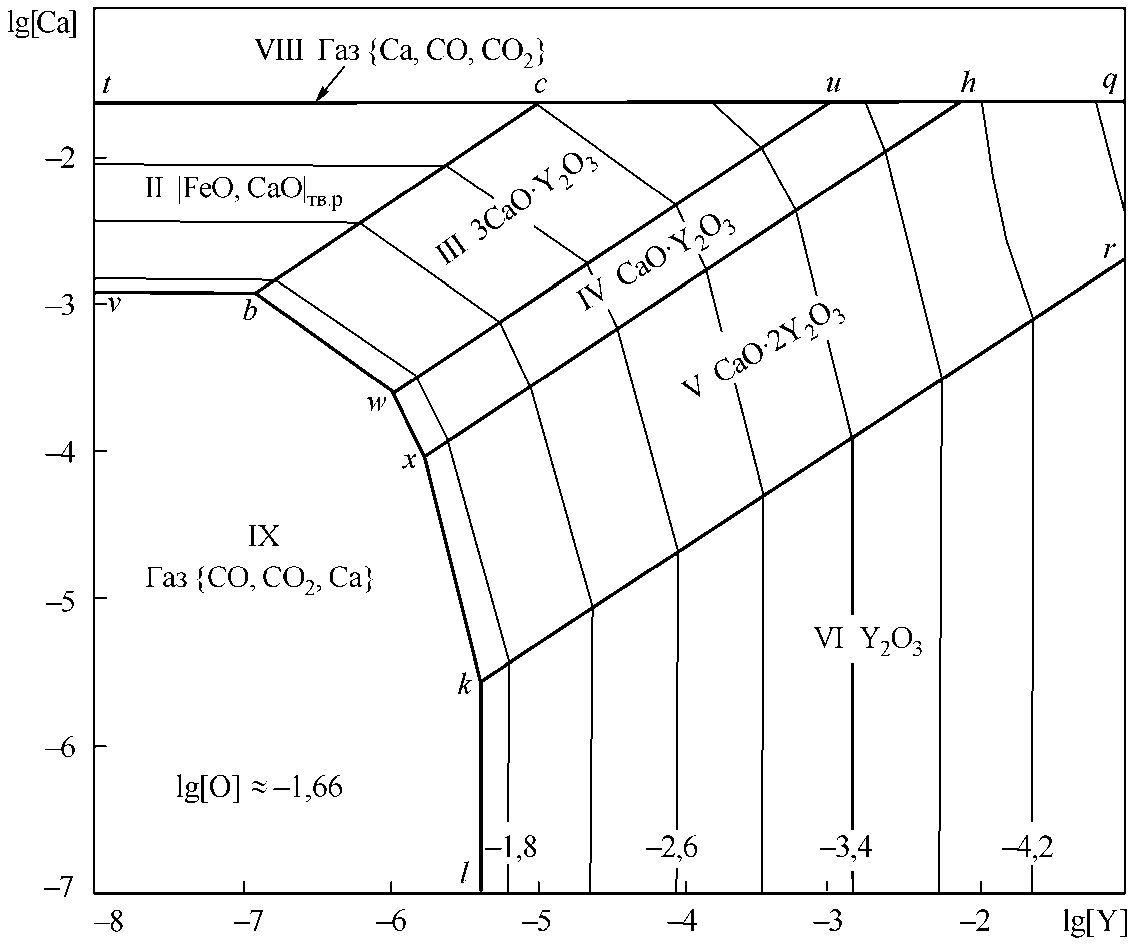
Рис. 2. ПРКМ системы Fe–Ca–Y–O–С, Т = 1600 °С, Р общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
а)
б)
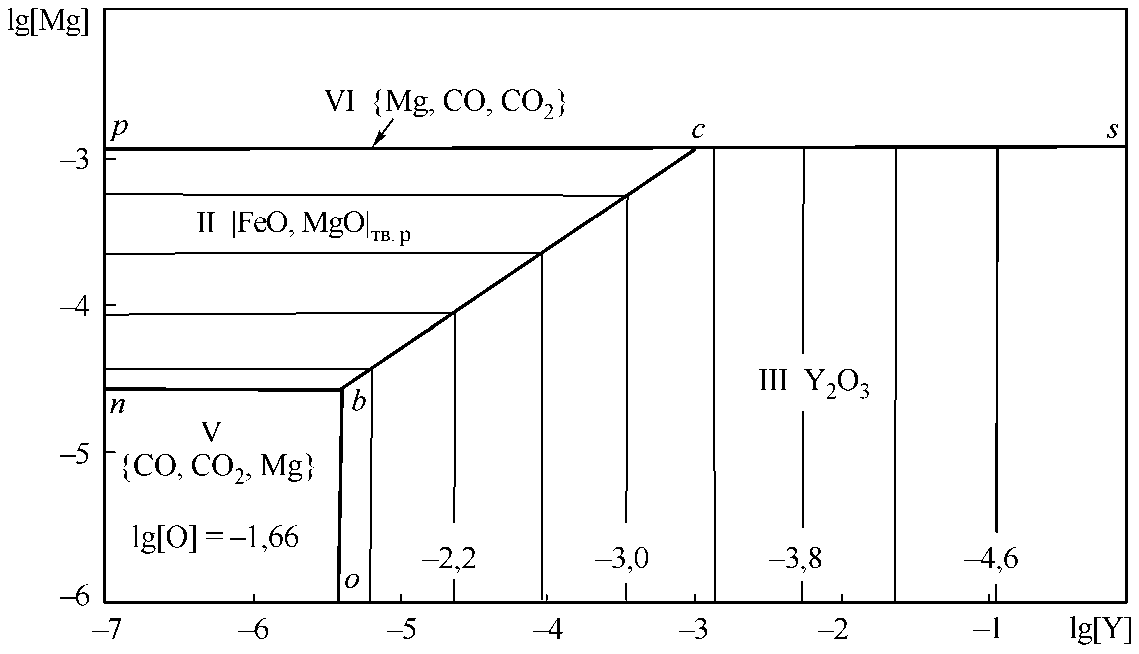
Рис. 3. ПРКМ системы Fe–Mg–Y–O–С, Т = 1600 °С, Р общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
Из вида ПРКМ следует, что раскислительная способность иттрия в среднем на порядок выше раскислительной способности алюминия и на два порядка выше раскислительной способности кальция. Но, тем не менее, следует отметить, что раскисление алюминием и иттрием будет, скорее всего, комплексным. То же самое можно сказать о раскислении кальцием и иттрием. Большие поля составов металла, равновесных с алюминатами иттрия и соединениями иттрия с кальцием позволяют сделать это заключение.
Из вида ПРКМ Fe–Mg–Y–O–С можно сделать заключение о том, что раскисление иттрием и магнием носит альтернативный характер. Либо будут образовываться в качестве неметаллических включений твердые растворы на основе периклаза, либо оксиды иттрия. Раскислительная способность иттрия и магния практически одинакова.
Заключение
-
1. Впервые рассмотрены на основании термодинамического анализа фазовые равновесия, уста-
- навливающиеся в иттрийсодержащем стальном расплаве, раскисленном малыми добавками алюминия, кальция или магния.
-
2. Результаты термодинамических расчетов оформлены в виде диаграмм растворимости компонентов в металле, на которых приводится состав жидкого металла и указывается равновесная с ним оксидная фаза.
-
3. Из общего вида таких диаграмм раскисления иттрийсодержащего металла алюминием, кальцием или магнием следует ожидать, что раскисление стали алюминием и иттрием, кальцием и иттрием будет комплексным. Т.е. при тысячных долях процента компонентов в стали будут образовываться комплексные неметаллические включения. В случае если раскисление будет проводиться иттрием и магнием – это будет альтернативный процесс.
-
4. В целом раскисление высокоактивными элементами в реальном металле может иметь и более сложную картину, вследствие неравновес-ности процесса на начальных стадиях введения иттрия в жидкий металл.
Работа поддержана грантом РФФИ № 13-08-12167.
Список литературы Термодинамика процессов взаимодействия иттрия, кальция, магния и алюминия с кислородом в жидкой стали
- Химия. Справочное руководство/Пер. с нем. под ред. Ф.Г. Гаврюченкова, М.И. Курочкиной, А.А. Потехина, В.А. Рабиновича. -Л.: Химия, 1975. -576 с.
- Диаграммы состояния двойных металлических систем: справ. Т. 2. Кн. 2/Под ред. Н.П. Лякишева. -М.: Машиностроение, 2000. -448 с.
- Совершенствование литейных жаростойких хромоалюминиевых сталей микролегированием и модифицированием. -http://science-bsea.narod.ru/2009/mashin_2009/jamshinsky_sov.htm.
- Тарасюк, Л.И. Термодинамика раскисления железа иттрием/Л.И. Тарасюк, В.В. Морнева, Е.А. Казачков//Вест. Приазов. гос. техн. ун-та. Сер. «Технические науки». -2011. -№ 2 (23). -С. 33-39.
- Тарасюк, Л.И. Формирование неметаллических включений в сталях, модифицированных иттрием/Л.И. Тарасюк, В.В. Морнева, Е.А. Казачков//Вест. Приазов. гос. техн. ун-та. Сер. «Технические науки». -2011. -№ 2 (23). -С. 27-33.
- Применение редкоземельных металлов в металлургии. -http://www.urm.ru/ru/75-journal124-article64.
- Применение редкоземельных металлов в металлургии. -http://viam.ru/public/files/1988/1988-200121.pdf.
- Голубцов, В.А. Модифицирование стали для отливок/В.А. Голубцов, В.В. Лунев. -Челябинск; Запорожье: ЗНТУ, 2009. -356 с.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -519 с.
- Михайлов, Г.Г. Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 2. Диаграммы состояния оксидных систем с Y2O3/Г.Г. Михайлов, Л.А. Макровец//Вестник ЮУрГУ. Серия «Металлургия». -2014. -Т. 14, № 4. -С. 5-10. DOI: DOI: 10.14529/met150401
- Bůžek, Z. Zakladni termodynamicke udaje o metalurgických reakciah/Z. Buzek//Hutnicke aktua¬lity. -1979. -Vol. 20, no. 1-2. -P. 3-111.
- Bůžek, Z. Vliv přechodných kovú na aktivitu a rozpustnost kysliku v železe při 1600 °C/Z. Buzek, M. Macoszek., J. Szlaver//Hutnicke listy. -1972. -Vol. XXVII, no. 8. -P. 547-557.
- Steelmaking Data Sourcebook. Revised Edition by The Japan Society for the Science. The 19th Committee on Steelmaking. New York et al., Gordon and Breach Science Publishers S.A., 1988. -325 p.
- Gloria, M. Inclusion Precepitation Diagram for the Fe-O-Ca-Al System/M. Gloria, S. Faurling, R. Ramalingam//Metall. Trans. B. -1980. -Vol. 11 (1). -P. 125-130 DOI: 10.1007/BF02657181
- Куликов, И.С. Раскисление металлов/И.С. Куликов -М.: Металлургия, 1975. -504 с.
- Туркдоган, Е.Т. Физическая химия высокотемпературных процессов: пер. с англ. -М.: Металлургия, 1985. -344 с.


