Терморадиомодификация в многокомпонентном лечении рака предстательной железы
Автор: Важенин А.В., Карнаух П.А.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 2 (74), 2007 года.
Бесплатный доступ
Для повышения эффективности лучевого лечения рака предстательной железы предложена методика трансуретральной терморадиомодификации. Установлено, что этот метод значительно улучшает результаты лечения в ближайшие сроки и повышает показателей выживаемости больных с I, II и III стадиями рака предстательной железы.
Короткий адрес: https://sciup.org/147152360
IDR: 147152360
Текст научной статьи Терморадиомодификация в многокомпонентном лечении рака предстательной железы
Для повышения эффективности лучевого лечения рака предстательной железы предложена методика трансуретральной терморадиомодификации. Установлено, что этот метод значительно улучшает результаты лечения в ближайшие сроки и повышает показателей выживаемости больных с I, II и III стадиями рака предстательной железы.
В течение ряда последних лет отмечен неуклонный рост заболеваемости раком предстательной железы как в нашей стране, так и за рубежом [1, И, 16, 19]. Это касается как высокоразвитых стран, так и государств, находящихся на подъеме социально-экономического развития [1, 12, 14, 18].
Уже много лет рак предстательной железы является безоговорочным лидером среди онкологических заболеваний у мужчин в США и странах западной Европы [7]. В России рак предстательной железы по уровню заболеваемости в течение последних нескольких лет уверенно занимает четвертую позицию (Матвеев Б.П., 1999). По данным Челябинского областного канцер-регистра уровень заболеваемости раком предстательной железы неуклонно возрастает, и за последние 10 лет удвоился, а за 2005 год составил 25,0 на 100 000 мужского населения области.
Это объясняет актуальность поиска новых эффективных методов лечения этого грозного заболевания.
В связи с тем, что до 30% всех злокачественных опухолей предстательной железы являются гормонорезистентными, а у остальных неизбежно развивается гормонорезистентность, лучевая терапия является одним из наиболее распространенных методов лечения рака предстательной железы на всех стадиях заболевания. Однако отмечена не достаточная ее эффективность [2, 5, 14]. В первую очередь это связано с морфологическими особенностями рака предстательной железы. Более чем в 95 % опухоль имеет строение аденокарциномы [1, 12]. Вместе с тем, известна высокая радиорезистентность аденогенных опухолей. Это связано с бессосудистой солидно-инфильтративной структурой аденокарциномы. Уменьшение кровотока по сравнению с нормальными тканями объясняет наличие большого количества гипо- и анаксических клеток в опухоли. Для гибели этих клеток необходимо подведение дозы в 2-3 раза больше, чем для нормально оксигинированных клеток. Однако известно, что увеличение дозы излучения приводит к поражению рядом расположенных органов [3, 6, 8]. Таким образом, необхо дим способ увеличения радиопоражемости опухоли без увеличения дозы. Очевидным выходом из положения является увеличение кровотока в пораженном органе, что можно достичь его нагреванием [2, 4, 13]. Многими экспериментальными и клиническими исследованиями доказано, что нагревание опухоли совместно с лучевой терапией значительно повышает ее радиопоражаемость [9, 17, 20, 21]. Дополнительными терапевтическими факторами являются непосредственное разрушающее действие нагревания на опухолевые клетки и формированием в ткани белка термального шока, индуцирующего иммунные реакции [15].
Интерес исследователей к обсуждаемой проблеме хорошо демонстрирует большое количество созданных гипертермических систем, используемых для лечения заболеваний предстательной железы. Справедливости ради необходимо отметить, что в основном сферой приложение гипертермии -термотерапии являются неонкологические заболевания предстательной железы. Однако, ряд научных центров уже длительное время целенаправленно изучает возможности использования нагревания предстательной железы в качестве радиомодификатора [2, 9, 10, 13, 15].
Современные гипертермические системы отличаются как частотой поля (от 8 до 915 МГц), так и способом нагрева тканей (излучательный, индуктивный, емкостной). Для лечения заболеваний предстательной железы используются аппараты «Prostatron», «Urawave», «Prostcare», «Hypertherm Et-ЮО», «Тегтех-2», «Uroterm», «Яхта-3», «Яхта-4», «Яхта-5» [12].
Перегрев смежных органов и тканей, возникающий при нагревании предстательной железы до 42-59°, является серьезным препятствием для проведения лечения. Методом борьбы с этим побочным эффектом является охлаждение прилежащих тканей или использование многопольных излучателей, которые позволяют концентрировать энергию на заданной глубине. Этот принцип использован в разработанном в ЗАО «НИИИТ высокочастотные комплексы» г. Челябинска аппарате «Радиотерм».
В течение последних 6 лет в Челябинском ООД с целью радиомодификации используется этот аппарат. Он имеет антенну для трансуретрального нагревания, которое производится комбинированным способом, длинной волны 40,68 МГц, в течении 60 минут до температуры 43-47°, за 1 час до сеанса дистанционной гамма-терапии, 2-3 раза в неделю (всего 6-8 раз за время проведения курса лучевой терапии). На данную методику получен патент на изобретение № 2238776 от 27.10.04. ■
Проведен анализ результатов лечения 101 ■ больного раком предстательной железы при различной распространенности опухолевого процесса. У всех пациентов диагноз морфологически верифицирован. 98 % имели аденокарциномы различной степени дифференцирования. Возраст больных колебался от 3 8 до 77 (средний 66,70 ± 2,03). По стадиям заболевания пациенты распределились. следующим образом: с I стадией заболевания был 1 %, со II - 4,0 %, с III - 64,3 %, с IV - 30,7 %. В связи с небольшим количеством больных в I и II стадией, статистически достоверно оценить результаты представилось возможным только у больных в III и IV стадиях. В связи с идентичными прогностическими и лечебно-тактическими особенностями, а также незначительным объемом наблюдения, больные с I и II стадией были объединены в одну группу. В связи с тем, что всего один пациент с отдаленным метастазом получил гормнонотермо-лучевую терапию, сопоставлялись результаты больных с IV стадией без отдаленных метастазов. Таким образом сформированы группы сравнения: 1 - I и II стадии, 2 - III стадия, 3 - IV стадия без отдаленных метастазов.
Для определения места терморадиомодификации в структуре лечебных методов, проведено сравнение эффективности этого варианта лечения с эффективностью гормонотерапии (п = 206), лучевой терапии (n = 126), сочетания этих видов лечения без терморадиомодификации (п = 247).
Гормонотерапия заключалась в проведении максимальной андрогенной блокады, которая является обязательным видом данного варианта лечения в течение последних лет. Она заключается в сочетании хирургической или медикаментозной кастрации с приемом стероидных или нестероидных антиандрогенов. Наиболее часто применялись хирургическая кастрация в сочетании со стероидные антиандрогены - адрокур-депо по 300 мг 1 раз в 2 недели. Несмотря на наличие побочного эффекта, характерного для всех стероидов, пациенты предпочитали этот препарат в связи с удобством приема. Не стероидные антиандрогены - флутамид, флуцином принимались ежедневно по 250 мг 3 раза. Вторая линия лечения проводилась эстрагенами. Наиболее часто применялся эстрадурин - 160-320 мг 1 раз в 28 дней.
Медикаментозная кастрация осуществлялась агонистами гонадотропин-релизинг гормона: зола-декс 3,6 мг, диферелин 3,75 мг, бусерелин-депо 3,75 мг 1 раз в 28 дней.
Лучевая терапия проводилась в виде дистанционной гамматерапии в динамическом или традиционном режиме сплит-курсом до суммарной общей дозы не менее 70 Гр.
Проведена оценка ближайших и отдаленных результатов методов лечения. В ближайшее сроки в качества критерия оценки эффективности лечения выбран предложенный нами интегральный показатель «коэффициента эффективности лечения» (КЭЛ), который включает в себя оценку качества мочеиспускания по международной шкале IPSS, объем предстательной железы, объем остаточной мочи, уровень в крови общей фракции простатспецифического антигена. Измерение указанных показателей производили до лечения и через 6 месяцев с момента его начала. Величина КЭЛ зависит от совокупности изменения указанных показателей до и после лечения.
В результате оценки КЭЛ по группам было установлено, что при I-П стадии заболевания (п = 98) наиболее эффективно сочетание лучевого лечения с гормональным на фоне терморадиомодификации (рис. 1), (р > 0,05).
0,06
0,05
0,04
0,03
0,02
0,01
о
□ г
-
■ л
-
■ гл
0ГТЛ
Рис. 1. Ближайшая эффективность методов лечения больных в I группе
Гормонолучевое лечение без терморадиомодификации дает наилучшие результаты из оставшихся методов (р < 0,05). Гормональное лечение в монорежиме превосходит лучевое, однако, небольшой объем наблюдения не позволяет сделать статистически достоверных выводов.
При оценке ближайших результатов в самой большой группе больных - с III стадией заболевания (п = 315), статистически достоверно установлено, что сочетание гормонолучевого лечения с терморадиомодификацией существенно провос-ходит все другие варианты лечения (рис. 2). Как и ожидалось, вторую позицию занимает сочетание методов без терморадиомодификации, третью - лучевое лечение, и менее эффективно у данной группы пациентов гормонотерапия в монорежиме.
0,08 0,07 0,06 О,OS-
О.04 0,03 0,02 0,01
О
□г ел игл апл
Рис. 2. Ближайшая эффективность методов лечения больных во II группе
Анализ результатов в 3 группе (п = 151) установил, что по-прежнему наилучшие ближайшие результаты имеет гормонотермолучевое лечение (рис. 3). Гормональное лечение в монорежиме уверенно занимает вторую позицию, опережая гомонолучевую и лучевую терапию.
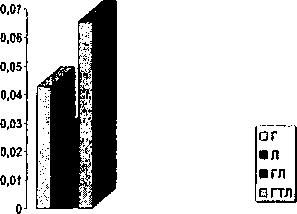
Рис. 3. Ближайшая эффективность методов лечения больных в III группе
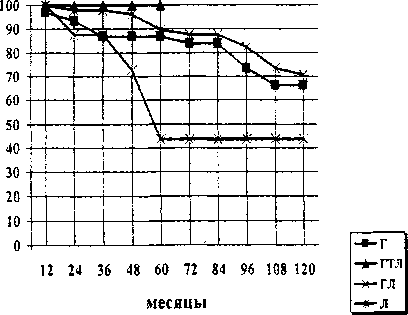
Рис. 4. Показатели выживаемости больных в I группе
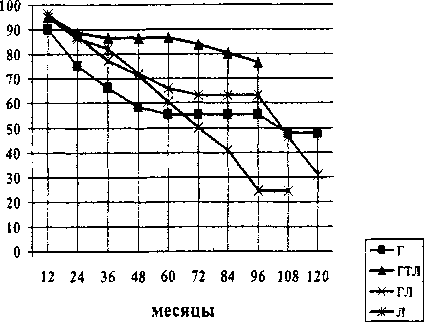
Рис. 5. Показатели выживаемости больных во II группе
Оценка отдаленных результатов произведена в этих же группах с учетом метода лечения путем сопоставления онкоспецифической выживаемости. Для определения степени статистический достоверности результатов произведен расчет стандартной ошибки показателей (т), 95 % доверительного интервала (95 % ДИ), определен уровень статистической достоверности (р).
В результате установлено, что при I и II стадии рака предстательной железы (п = 127) предпочтительным консервативным методом лечения является гормонолучевое с терморадиомодификацией (рис. 4). Однако, выводы статистически не достоверны. Наблюдалось всего 4 пациента в течение 7 лет. Все они живы.
Во 2-й группе сравнения (III стадия заболевания, п = 381) по-прежнему комплексное лечение на фоне терморадиомодификации наиболее эффективно (рис. 5).
Пятилетняя онкоспецифическая выживаемость после проведения терморадиомодификации на фоне гормонотерапии достигла 86,5 % (р < 0,05,
95 % ДИ 0,759-0,970, m = 0,018) а, 8-летняя - 76,8 % (р < 0,05, 95 % ДИ 0,613-0,923, m = 0,036). В группе с гормонолучевой терапией без радиомодификации 5-летняя выживаемость существенно ниже -65,9 % (р < 0,05, 95 % ДИ 0,539-0,781, m = 0,0305), 10-летняя - 31,0 % (р < 0,05, 95 % ДИ 0,084-0,536, m = 0,0693). В результате проведения лучевой терапии 5-летняя выживаемость достигла - 60,4 %, (р < 0,05, 95 % ДИ 0,445-0,763, m = 0,0512), до 10 лет никто из пациентов не дожил. У пациентов, получивших только гормонотерапию, 5-летняя выживаемость составила - 55,2 % (р < 0,05, 95 % ДИ 0,390-0,714, ш = 0,0283), 10-летняя - 47,9 % (р < 0,05, 95 % ДИ 0,202-0,756, m = 0,064).
Изучение результатов лечения у больных с IV местно-распространенной стадией рака предстательной железы (III группа) обнаружило, что наилучшие показатели выживаемости - у пациентов, получивших гормонолучевую терапию без терморадиомодификации (рис. 6): 5-летняя выживаемость - 59,5 % (р < 0,05, 95 % ДИ 0,293-0,898, m = 0,08), 10-летняя - 21,3 % (р < 0,05, 95 % ДИ 0-0,469).
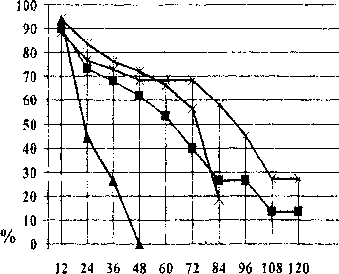
месяцы
Рис. 6. Показатели выживаемости больных в III группе

Гормональная терапия в монорежиме уступила по данным показателям незначительно: 5летняя выживаемость составила 57,4 % (р < 0,05, 95 % ДИ 0,367-0,773, m = 0,067), а 10-летняя -16,9 % (р < 0,05, 95 % ДИ 0-0,345, m = 0,069). На третьей позиции - лучевая терапия в монорежиме, в результате проведения которой получена 5-летняя выживаемость в 55,4 % (р < 0,05, 95 % ДИ 0,375-0,725, m = 0,062), пациенты не доживают до 7 лет. Из всех проведенных методов лечения гормонотермолучевое - менее эффективно. 5-летняя выживаемость в этой группе составила 7,4 % (р <0,05, 95 % ДИ 0-0,155, m = 0,074).
Результаты проведенного исследования убеждает нас в том, что терморадиомодификация в лечении рака предстательной железы должна применятся шире. В начальных стадиях заболевания этот метод лечения имеет преимущества перед лучевым, гормональным лечением и сочетания их по оценке как ближайших, так и отдаленных результатов. Вместе с тем необходимо учитывать, что наличие метастатического поражения является противопоказанием к применению терморадиомодификации.
Список литературы Терморадиомодификация в многокомпонентном лечении рака предстательной железы
- Бухаркин Б.В. Роль Диферелина в гормональной терапии диссеминированного рака предстательной железы/Б.В. Бухаркин//РМЖ. -2004. -Т. 12. -№ 11 (211). -С. 657-660.
- Бухаркин Б.В. Современные методы лечения местно-распространенного и диссеминированного рака предстательной железы: автореф. дис. док. мед. наук/Б.В. Бухаркин; Российский онкологический центр. -М., 1995.
- Голдобенко Г.В. Рак предстательной железы//Лучевая терапия злокачественных опухолей/Г.В. Голдобенко, С.И. Ткачев. -М.: Медицина, 1996. -С. 319-329.
- Гранов A.M. Лучевая терапия в онкогинекологии и онкоурологии/A.M. Гранов, В.Л. Винокуров.-СПб.: Фолиант, 2002. -349 с.
- Кондратьева А.П. Лучевая терапия рака предстательной железы//Клиническая онкология/А.П. Кондратьева -1999 -Т. 1, № 1. -С. 17-21.
- Лопаткин Н.А. Применение Бусерелина-депо -агониста гонадотропин-релизинг гормона у больных раком предстательной железы: пособие для врачей/Н.А. Лопаткин. -М., 2003. -17 с.
- Матвеев Б.П. Рак предстательной железы/Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев. -М., 1999 -153 с.
- Осинский С.П. Гипертермия в клинической онкологии: современное состояние проблем (по итогам 20-й ежегодной конференции Европейского общества гипертермической онкологии)/С.П. Осинский//Онкология. Научно-практический журнал (приложение к журналу «Экспериментальная онкология»). -2002. -Т. 4, № 4. -С. 288-292.
- Ощепков В.Н. Трансректальная микроволновая гипертермия в комплексном лечении больных распространенным раком предстательной железы/
- В.Н. Ощепков, Е.В. Дарий, А.В. Сивков, О.И. Аполихин, Т.Г. Пчелинцева//Пленум правления Российского общества урологов (тезисы докладов). -Омск, 1999. -С. 189-190.
- Переверзев А.С. Рак простаты/А.С. Переверзев, М.И. Коган. -Харьков: Факт, 2004. -С. 231.
- Серняк Ю.П. Консервативная терапия рака предстательной железы//Материалы пленума правления Российского общества урологов.-Омск, 22-24 сентября/Ю.П. Серняк, М.В. Криштопа. -Омск, 1999. -С. 194-195.
- Ткачев С.И. Сочетанное применение лучевой терапии и локальной гипертермии в лечении местно-распространенных новообразований: автореф. дис. д-ра мед. наук/С.И. Ткачев; Российский онкологический центр. -М., 1994.
- Трапезников Н.Н. Заболеваемость злокачественными новообразованиями и смертность от них населения стран СНГ в 1997 г./Н.Н. Трапезников, Е.М. Аксель. -М., 1999. 14.
- Abstracts Book of the 20th Annual Meeting of the European Society for Hyperthermic Oncology, Bergen, Norway, May 23-25, 2002.
- Brasso K. Prostate cancer in Denmark, Incidence, morbidity and mortality/K. Brasso, P. Iverson//Scand. J. Urol. Nephrol. Suppl. -1999. -№ 203. -P. 29-33
- Falk M.H., Issels R.D. Hyperthermia in oncology//Int. J. Hyperthermia. -2001. -№ 17. -P. 1-18.
- Kanamaru H. Long-term treatment results of elderly patients with prostate cancer in Japan; an analysis of prognostic factors/H. Kanamaru, Y. Arai,H. Akino, Y. Suzuki, N. Oyama, H. Yoshida, K. Okada//Jpn. J. Clin. Oncol. -1999 -№ 29 (3). -P. 151.
- Newling D.W. Clinical protocols in treatment of prostatic carcinoma in Europe. The role of EORTC and other organizations/D.W. Newling//Urologe A. -1995. -№ 34 (5). -P. 374-381.
- Nielsen O.S. A future for hyperthermia in cancer treatment?/O.S. Nielsen, M. Horsman, J. Overgaard//Eur. J. Cancer. -2001. -№ 37. -P. 1587-1589.
- Osinsky S. The 20th anniversary of the International Clinical Hyperthermia Society (ICHS): experimental and clinical experience/S. Osinsky, H. Shidnia//Exp. Oncology. -2000. -№ 22. -P. 95-96.


