Time-lapse культивирование in vitro эмбрионов крупного рогатого скота до стадии бластоцисты
Автор: Макутина В.А., Кривоногова А.С., Донник И.М., Исаева А.Г.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Зоотехния и ветеринария
Статья в выпуске: 3, 2025 года.
Бесплатный доступ
Цель исследования - применить time-lapse наблюдение для мониторинга за развитием эмбрионов крупного рогатого скота (КРС) in vitro, а также провести анализ прогностического потенциала морфокинетических параметров дробления как критерия для оценки компетентности эмбриона к формированию бластоцисты. Исследование выполнено на посмортально полученном материале; созревание ооцитов, оплодотворение и культивирование эмбрионов КРС до стадии бластоцисты происходило экстракорпорально. По временным и морфологическим характеристикам первого и трех последующих делений эмбриона (от зиготы до формирования 4-клеточной стадии) можно определить потенциальную способность эмбриона формировать экспандированную бластоцисту хорошего качества. Если деление эмбриона укладывается в определенные нами временные интервалы и отсутствуют признаки аномального мультиполярного или неравного дробления зиготы, эмбрион эффективнее развивается и чаще достигает стадии бластоцисты: первое деление эмбриона должно происходить через (27,77 ± 0,28) ч после оплодотворения ооцита; продолжительность от момента формирования борозды деления до образования двухклеточного эмбриона должна составлять не более (0,38 ± 0,05) ч; второе и третье деления с формированием 4-клеточного эмбриона должны происходить не позднее (36,58 ± 0,27) и (37,77 ± 0,32) ч после оплодотворения. Эмбрионы, развитие которых не укладывалось в указанные временные параметры, как правило, останавливались на разных этапах развития, не развившись до стадии бластоцисты. Мультиполярное деление на три и более бластомера и неравное деление на бластомеры разного размера являлись, по нашим данным, негативными прогностическими признаками раннего эмбриогенеза. Мультиполярное деление встречалось с частотой 29,71 % у эмбрионов, не сформировавших бластоцисту, и только 9,26 % - у эмбрионов, развившихся до стадии бластоцисты, неравное дробление - с частотой 5,86 и 0,93 % сответственно. Жизнеспособные и перспективные эмбрионы следуют гораздо более жестким временным рамкам деления, а эмбрионы, останавливающиеся в развитии, как правило, выходят за пределы временного диапазона и чаще демонстрируют аномалии деления.
Time-lapse культивирование эмбрионов, крупный рогатый скот, экстракорпоральное оплодотворение, вспомогательные репродуктивные технологии
Короткий адрес: https://sciup.org/140309911
IDR: 140309911 | УДК: 619+611.013+636.2 | DOI: 10.36718/1819-4036-2025-3-106-117
Текст научной статьи Time-lapse культивирование in vitro эмбрионов крупного рогатого скота до стадии бластоцисты
Acknowledgments : the study was carried out with the financial support of a grant from the Russian Science Foundation, project No. 19-76-10022.
Введение. Экстракорпоральное оплодотворение и культивирование предимплантационных эмбрионов является широко используемой репродуктивной технологией в фундаментальных и прикладных исследованиях в медицине и ветеринарии. Развитие эмбрионов – это динамический процесс, тем не менее традиционная оценка качества эмбрионов, культивируемых in vitro, основана на морфологической оценке клеточ-ности и соответствия стадии развития в определенные временные интервалы: 16–18 ч после оплодотворения, 40–42 ч после оплодотворения и т. д. Хотя эмбрионы, классифицированные традиционным способом как отличные и хорошего качества, как правило, наиболее компе- тентны к развитию и имплантации по сравнению с эмбрионами низкого качества, но селекция, основанная только на морфологической оценке, не гарантирует дальнейшее успешное развитие эмбриона и отсутствие эмбриональных потерь. Так, известно, что эмбрионы крупного рогатого скота, оплодотворенные и культивированные in vitro, несмотря на высокие морфологические характеристики, достоверно имеют более низкие показатели имплантации и вероятность наступления беременности у коров-реципиентов по сравнению с эмбрионами, полученными технологией in vivo, путем вымывания бластоцист из матки коров-доноров [1]. Некоторые морфокинетические параметры развития эмбриона мо- гут иметь ценное прогностическое значение, но остаются незамеченными при использовании стереомикроскопа и осмотра эмбрионов в определенные временные интервалы [2]. Более точное наблюдение за эмбрионом традиционным способом требует, соответственно, более частого извлечения эмбрионов из контролируемых условий инкубатора для осмотра их в стереомикроскоп. Таким образом, излишняя оценка эмбрионов может также нанести вред их развитию из-за колебаний условий культивирования: изменение температуры и состава газовой смеси (рН питательной среды), что создает метаболический стресс для ранних эмбрионов. Более того, традиционный метод ранжирования и морфологической оценки в определенные временные интервалы развития эмбрионов считается достаточно субъективным из-за изменчивости оценки между специалистами-эмбриологами. В последние годы, в дополнение к морфологической классификации эмбриона, предлагается проводить скрининг хромосомных патологий для улучшения селекции. Однако генетический анализ является достаточно дорогостоящим и требует инвазивной биопсии, которая может сказаться на жизнеспособности эмбриона и его способности к имплантации и живорождению при отсутствии навыков специалиста, проводящего процедуру биопсии.
Технология высокочастотной покадровой съемки time-lapse позволяет осуществлять непрерывный и неинвазивный мониторинг эмбрионального развития от момента оплодотворения до стадии экспандированной или хэтчингованной бластоцисты. Применение такой технологии стало возможным только в последние годы благодаря появлению высокотехнологичных систем видеонаблюдения и съемки, встроенных в муль-тигазовый инкубатор. Данная технология широко используется при культивировании эмбрионов человека в программах экстракорпорального оплодотворения в клиниках лечения бесплодия [2]. Time-lapse наблюдение применяют для обнаружения ключевых событий развития предимплан-тационного эмбриона, таких как время первых делений до восьмиклеточной стадии, продолжительность клеточного цикла и первого митотического деления, появление и реабсорбция фрагментов цитоплазмы, реверсивное и аномальное деление, мультинуклеация бластомеров и вакуолизация клеток, оценка плоидности при несинхронном появлении пронуклеусов. Все перечис- ленные события оказывают влияние на потенциальную способность эмбриона формировать бластоцисту хорошего или отличного качества, а также и на успешность имплантации. Более того, показан неблагоприятный прогностический исход при отклонениях от нормального деления зигот млекопитающих на два бластомера одинакового размера. Многополярное деление на три или более бластомера, а также деление на бластомеры неравного размера связаны с хромосомными аномалиями и анэуплоидиями эмбрионов, поэтому было высказано предположение, что данная технология мониторинга может предсказать статус плоидности эмбриона [2].
Развитие эмбриона – это динамический процесс, и критические стадии могут остаться незамеченными при использовании традиционных морфологических оценок. По данным многочисленных наблюдений за развитием эмбрионов человека, подробный мониторинг морфокинетических показателей развития предимпланта-ционных эмбрионов способствует лучшей селекции и неинвазивному отбору максимально перспективных эмбрионов для переноса в матку или криоконсервации. Полученные при time-lapse мониторинге данные также позволяют эффективно сравнивать развитие эмбрионов в различных условиях культивирования (питательные среды, масло для культивирования, культуральный пластик), а также воздействие экзогенных (температурный режим) и эндогенных (индекс массы тела, гормональный статус, возраст, наличие сопутствующих заболеваний) факторов на гаметы и предимплантационные эмбрионы.
Действительно, развитие эмбрионов человека изучено достаточно подробно, но исследования на других млекопитающих крайне немногочисленны. Известно, что сроки делений эмбрионов млекопитающих, по-видимому, определяют их потенциальную возможность формировать бластоцисту и имплантироваться [3–6]. В нашем исследовании мы провели time-lapse оценку морфокинетических показателей развития эмбрионов крупного рогатого скота, полученных из посмортально отобранных донорских ооцитов после их in vitro созревания, оплодотворения и криоконсервации методом витрификации с последующим оттаиванием и культивированием до стадии бластоцисты. При процессе витрификации клетки интенсивно дегидратируют, накапливают проникающие криопротекторы с последующим сверхбыстрым охлажде- нием, переходя в «стеклообразное» состояние. И наоборот, в процессе оттаивания ооциты быстро набирают воду, а криопротекторы удаляются. Резкое изменение осмолярности и токсичность большинства криопротекторов могут оказать влияние на веретено деления ооцита и его цитоскелет, что скажется на жизнеспособности и компетентности эмбриона. Однако криоконсервация в настоящее время является важнейшим инструментом в репродуктивной биотехнологии и используется повсеместно для долгосрочного хранения и накопления гамет и эмбрионов.
Цель исследования – предоставить базовые характеристики преимплантационной мор-фокинетики дроблений эмбрионов крупного рогатого скота, полученных из витрифицированных ооцитов.
Задачи: определить временные интервалы и характеристики дробления предимплантацион-ных эмбрионов КРС; сравнить эти параметры в группах эмбрионов, сформировавших бластоцисту, и эмбрионов, остановившихся в развитии; оценить возможность использования морфокинетических параметров дробления как критерия для оценки компетентности эмбриона к формированию бластоцисты.
Прогнозирование выхода бластоцист и создание нового алгоритма неинвазивной селекции эмбрионов, специализированного для крупного рогатого скота, в перспективе позволят уменьшить количество коров-реципиентов на одного рожденного теленка. Более того, знания о соответствующих морфокинетических показателях могут быть использованы для оптимизации протоколов культивирования эмбрионов и криоконсервации ооцитов и зигот крупного рогатого скота.
Материалы и методы. Яичники КРС от животных-доноров отбирали postmortem, пункцию видимых фолликулов проводили в лабораторных условиях с помощью иглы 18G согласно описанной ранее методике [3]. Созревание ооцитов проводили в течение 24 часов в культуральной среде BO-IVM (IVF-Bioscience, Великобритания) при температуре 38,5 °С, уровне углекислого газа 6,5 %. Для экстракорпорального оплодотворения использовали криоконсерви-рованные сперматозоиды быка. Соломины размораживали на водяной бане, сперматозоиды центрифугировали в градиенте плотности Sperm Guard (Vitrolife, Швеция), промывали буферной средой Sperm Rinse (Vitrolife, Швеция). Оплодотворение проводили в среде BO-IVF (IVF-Bioscience, Великобритания) с созревшими ооцит-кумулюсными комплексами в концентрации 1,0–2,0 · 106 сперматозоидов на 1 мл питательной среды. Через 18 ч оплодотворенные ооциты, имеющие два полярных тела, были криоконсервированы методом витрификации согласно описанной ранее методике ультрабыс-трого замораживания зигот [4]. Кратко, ооциты денудировали для удаления оставшихся клеток кумулюса и сперматозоидов и витрифицировали с использованием набора Vitrification Media (Kitazato, Япония) и носителей Cryotop (Kitazato, Япония). Процедуру криоконсервации проводили в два этапа: 1 мин в растворе для эквилибрации – ES 7,5 % v/v ДМСО + 7,5 % v/v этиленгликоля. После зиготы помещали в среду для витрификации, содержащую 15 % v/v ДМСО + 15 % v/v этиленгликоля, на 1 мин. После нанесения на носитель биоматериалы немедленно помещали в жидкий азот. На один носитель помещали не более 4 ооцитов. Витрифицированные биоматериалы хранили в жидком азоте – 196 °С в сосудах Дьюара.
Непосредственно перед проведением timelapse-исследований ооциты размораживали в растворах набора для оттаивания Thawing Media (Kitazato). Для оттаивания носитель с биоматериалом (зиготы) погружали в 0,75 мл среды, содержащей 0,5–1,0 моль/л сахарозы при температуре 37 °С на 1 мин. После первого раствора ооциты/зиготы переносили в растворы со снижающейся концентрацией сахарозы на 3– 5 мин в каждой среде по рекомендации производителя.
После оттаивания зиготы переносили в каплю 50 мкл среды культивирования BO-IVС (IVF-Bioscience, Великобритания) в WOW-чашку (well-of-the-well) для покадровой сьемки (рис. 1). Каждый ооцит помещали в отдельную микролунку для видеонаблюдения. Эмбрионы культивировали без смены среды под маслом для клеточных культур Sage (Дания) весь период развития до стадии бластоцисты (6,5 % CO 2 , 38,5 °С). Компактный цифровой инвертированный микроскоп (Primo Vision, Vitrolife, Швеция) был установлен внутри инкубатора для культивирования. Чашки WOW устанавливались в держатель на микроскопе. Все зиготы и эмбрионы фокусировались в поле зрения. Сьемка фотоизображений была настроена на получение 1 кадра в 10 мин через 7 фокальных полостей весь период культивирования до – 190 ч.
Полученные изображения выстраивались в видеоряд и ежедневно анализировались на встроенном программном обеспечении системы Primo Vision одним специалистом-эмбриологом. Регистрировали следующие показатели: сроки дробления на две, три, четыре и пять клеток; время формирования ранних и экспандирован-ных бластоцист. Определяли время начала деления по появлению борозды деления и окончание деления – по полному завершению цитокинеза и формированию отдельных бластомеров. Эмбрион определяли как нормально дробившийся, когда деление клеток приводило к образованию двух бластомеров одинакового размера. Мелкие клетки небольшого размера, образующиеся при разделении бластомера пополам, классифицировались как фрагменты цитоплазмы. Деление одной клетки на три и более равных частей оценивалось как аномальное мультиполярное дробление (рис. 2).
Неравное дробление было классифицировано как деление, которое привело к асимметричным неравным размерам бластомеров. Обрат- ное реверсивное дробление определяли как полное деление клетки на два или более бластомера с последующим обратным слиянием в одну клетку. Стадию бластоцисты определи по началу формирования полости (бластоцеля). Бластоциста классифицировалась как экспанди-рованная, когда диаметр ее увеличивался, блестящая оболочка истончалась и размер бласто-целя превышал 50 % от объема бластоцисты.
Статистический анализ . Эксперименты проводились в 25 сериях. Было проанализировано развитие 347 предимплантационных эмбрионов крупного рогатого скота. По результатам рассчитывалось среднее значение ± SEM. Таблицы сопряженности 2 х 2 и критерий хи-квадрат использовались для анализа различий в патологиях дробления между группами. Программа Statictica 10.0 применялась для оценки достоверности различий между временными интервалами дроблений по t-тесту.
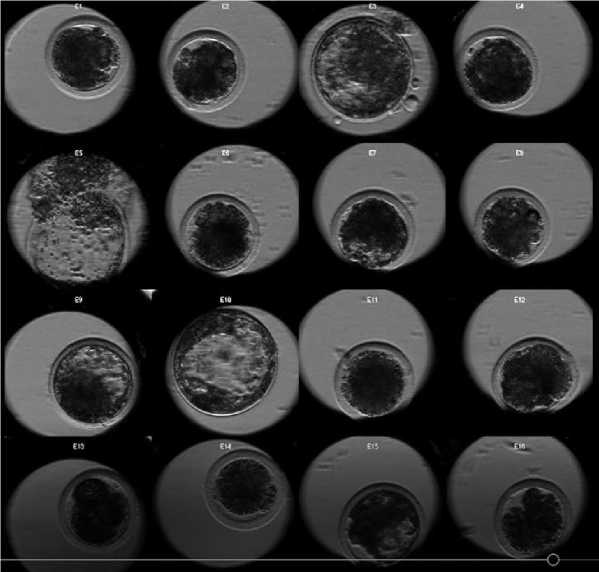
Рис. 1. Культивирование эмбрионов КРС в WOW-чашках 180 ч. Эмбрионы № 3 и № 10 – крупные экспандированные бластоцисты; эмбрион № 5 вылупился из зоны (хэтчинг); эмбрионы № 7 и № 15 начинают формировать бластоцель; остальные эмбрионы остановились в развитии
Cultivation of cattle embryos in WOW cups 180 h. Embryo No. 3 and No. 10 are large expanded blastocysts; embryo No. 5 hatched from the zone (hatching); embryos No. 7 and No. 15 begin to form a blastocele; the remaining embryos have stopped developing
Результаты и их обсуждение. Покадровая сьемка эмбрионов крупного рогатого скота затруднена высокой концентрацией липидных гранул в цитоплазме бластомеров, что снижает визуализацию пронуклеусов и оценку оплодотворения. Наибольшую сложность представляет оценка морфокинетики дробления эмбрионов КРС, полученных из посмортально отобранного материала. В таком случае мы получали нести-мулированные яичники коров и аспирированные ооцит-кумулюсные комплексы находились на разных этапах созревания, поэтому требовалась предварительная инкубация и созревание ооцитов in vitro с последующей витрификацией оплодотворенных ооцитов для набора групп клеток. Так как не все ооциты, полученные по-смортально из нестимулированных яичников, потенциально способны дозреть до стадии MII и сформировать бластоцисту, важно оценить временные интервалы ранних делений и определить возможные предикторы компетенции развития.
Исследовали морфокинетику развития 347 ранних эмбрионов, полученных постмортально от неподготовленных коров-доноров, не прошедших предварительную медикаментозную стимуляцию. Всего было записано 25 серий покадровой сьемки. Уровень формирования бластоцист оставил 31,12 %, остальные эмбрионы останавливались в развитии на разных этапах дробления. Время первого, второго, третьего, четвертого и пятого деления эмбриона удавалось определить с высокой степенью достоверности. Точное время последующих делений и количество клеток не могли быть однозначно определены из-за наложения бластомеров друг на друга и из-за липидных гранул и темной цитоплазмы, что затрудняло визуализацию бластомеров в инвертированном микроскопе. В случаях, если не было возможности оценить конкретное время дробления, при расчете статистических показателей данные рассматривались как отсутствующие. Данные по морфокинетическим показателям развития эмбрионов приведены в таблице 1.
Таблица 1
Морфокинетические показатели развития эмбрионов крупного рогатого скота при in vitro культивировании зигот после витрификации
Morphokinetic parameters of the development of bovine embryos during in vitro cultivation of zygotes after vitrification
|
Показатель |
Эмбрионы, развившиеся до бластоцисты |
Эмбрионы, арестованные в развитии |
t-тест |
|
Количество |
108 |
239 |
|
|
Первое деление, ч |
27,77 ± 0,28 |
30,37 ± 0,33 |
0,0004 |
|
Продолжительность первого деления, ч |
0,38 ± 0,05 |
1,18 ± 0,18 |
0,004 |
|
Второе деление, ч |
36,58 ± 0,27 |
40,00 ± 0,50 |
< 0,00001 |
|
Интервал от 2-клеточного до 3-клеточного эмбриона, ч |
9,47 ± 0,17 |
12,07 ± 1,37 |
0,017 |
|
Третье деление, ч |
37,77± 0,32 |
40,92 ± 0,45 |
< 0,00001 |
|
Интервал от 3-клеточного до 4-клеточного эмбриона, ч |
1,17 ± 0,17 |
2,65 ± 0,38 |
0,003 |
|
Четвертое деление, ч |
47,92 ± 0,72 |
48,50 ± 0,70 |
|
|
Интервал от 4-клеточного до 5-клеточного эмбриона, ч |
10,13 ± 0,63 |
9,25 ± 0,53 |
|
|
Время формирования бластоцисты, ч |
166,93 ± 1,60 |
Бластоциста не сформирована |
|
|
Экспандированная бластоциста, ч |
245,07 ± 40,78 |
Бластоциста не сформирована |
|
|
Размер ооцита, мкм |
151 ± 0,8 |
151 ± 0,8 |
Согласно результатам, приведенным в таблице 1, первое деление эмбриона должно происходить через (27,77 ± 0,28) ч после оплодотворения ооцита; второе деление (формирование трехклеточного эмбриона) – (36,58 ± 0,27) ч после оплодотворения; третье деление с формированием четырехклеточного эмбриона – не позднее (37,77 ± 0,32) ч после оплодотворения. В группе эмбрионов, не сформировавших бластоцисту, первые клеточные циклы были значимо длиннее: первое деление происходило через (30,37 ± 0,33) ч; второе деление – через (40,00 ± 0,50); третье деление – (40,92 ± 0,45) ч. Быстрое по продолжительности первое деление (от момента появления борозды деления до формирования двухклеточного эмбриона) свидетельствует о хорошем потенциале эмбриона: в группе развившихся до стадии бластоцисты эмбрионов данных показатель составлял (0,38 ± 0,05) ч; у эмбрионов, остановившихся в развитии, – около (1,18 ± 0,18) ч.
Из 347 разделившихся зигот 240 (69,16 %) продемонстрировали нормальное дробление на два ровных бластомера. Наиболее распространенным аномальным дроблением было прямое деление на три или более клеток (мультиполяр-ное деление), отмеченное у 81 зиготы (23,34 %) (рис. 2), у 15 зигот из 347 отмечено неравное дробление (4,32 %), обратное реверсивное дробление наблюдали у 3 зигот (0,86 %), образование фрагментов цитоплазмы – у 8 зигот (2,31 %), у 3 зигот наблюдали два или более из этих аномальных событий дробления одновременно (0,86 %). В таблице 2 приведена частота аномальных событий делений в группе эмбрионов, развившихся до бластоцисты, и в группе эмбрионов, остановившихся в развитии.
По данным, приведенным в таблицах 1 и 2, можно сделать вывод, что временные интервалы и аномалии первого, второго и третьего митотических делений эмбриона прогнозируют его способность к дальнейшему развитию до стадии бластоцисты.
Таблица 2
Частота встречаемости патологий деления эмбрионов КРС
Frequency of occurrence of pathologies of division of cattle embryos
|
Показатель |
Эмбрионы, развившиеся до бластоцисты |
Эмбрионы, арестованные в развитии |
Хи-квадрат |
|
Количество |
108 |
239 |
|
|
Мультиполярное деление |
10 (9,26 %) |
71(29,71 %) |
< 0,001 |
|
Неравное дробление |
1 (0,93 %) |
14 (5,86 %) |
0,044 |
|
Реверсивное дробление |
0 |
3 (1,26 %) |
|
|
Фрагментация цитоплазмы |
0 |
8 (3,35 %) |
|
|
Сочетание двух и более аномалий |
0 |
3 (1,26 %) |
т
|T
.orovai
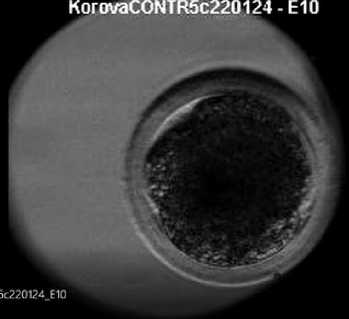
Рис. 2. Покадровая сьемка деления зиготы на три бластомера
Frame-by-frame recording of the division of the zygote into three blastomeres
Прогностическую ценность имеет также наблюдение мультиполярного деления зиготы на три бластомера и более (см. рис. 2). Аномальное событие мультиполярного дробления достоверно чаще встречалось в группе эмбрионов, не сформировавших бластоцисту, - 29,71 % (71 из 239 эмбрионов); по сравнению с хорошими эмбрионами - 9,26 % (10 из 108 эмбрионов). Еще одним неблагоприятным фактором было деление зиготы с формированием бластомеров неравного размера: в группе эмбрионов хорошего качества такое событие наблюдали только в 0,93 % случаев (у одного из 108 эмбрионов), тогда как у эмбрионов, не сформировавших бластоцисту, - в 5,86 % (14 из 239 эмбрионов). Реверсивное деление (слияние двух бластомеров в один) мы наблюдали только в группе эмбрионов, не развившихся до бластоцисты, с частотой 1,26 %, т. е. всего у трех эмбрионов. Наиболее часто встречающаяся аномалия, наблюдаемая у эмбрионов ЭКО человека, - это фрагментация цитоплазмы при дроблении клеток. Этот показатель учитывается во всех системах классификации и определяет качество эмбриона.
По нашим данным, у эмбрионов крупного рогатого скота фрагментация встречалась крайне редко, всего в 2,31 % случаев (8 эмбрионов из 347), и только у эмбрионов, в дальнейшем не сформировавших бластоцисту. Таким образом, некоторые из аномально разделившихся зигот, по нашим данным, также достигают стадии бластоцисты, поэтому эти ключевые показатели необходимо рассматривать в совокупности. При этом сочетание нескольких аномальных событий дробления наблюдалось у трех эмбрионов -1,26 %, ни один из которых не развился до стадии бластоцисты. Мы не выявили ни одного уникального кинетического параметра, который бы позволял однозначно предсказать потенциал эмбриона к развитию до бластоцисты. Однако, по нашим данным, совокупность определенных морфокинетических показателей развития пре-димплантационных эмбрионов крупного рогатого скота может быть использована для оценки компетентности эмбриона к формированию бластоцисты неинвазивным способом. Так, продолжительность первого митотического деления, скорость последующих двух делений кри- тическим образом сказываются на возможности эмбриона развиться до бластоцисты.
Также важно наблюдение аномальных событий во время дробления. Мультиполярное деление на три и более бластомера и неравное деление на бластомеры разного размера являются негативным прогностическим признаком раннего эмбриогенеза. Как подтверждается исследованиями на эмбрионах человека, многополюсное зиготическое деление часто связано с ошибками расхождения хромосом и формированием анэуплоидных эмбрионов [5, 7]. Кроме того, известно, что аномалии деления снижают вероятность имплантации эмбриона. Sugimura и соавторы получали эмбрионы КРС после гормональной стимуляции яичников и наблюдали у эмбрионов с правильным митотическим делением более высокий потенциал к имплантации в матку (66,7 %), чем у эмбрионов с аномальным делением (33,3 %) [6].
В данном исследовании мы оценили морфо-кинетику зигот, полученных из витрифицированных созревших и оплодотворенных in vitro ооцитов крупного рогатого скота. Нужно отметить, что, согласно дизайну нашего исследования, ооциты витрифицировали после оплодотворения на стадии зиготы, очистив их от клеток кумулюса, которые могут снижать выживаемость ооцитов. В работе D. Angel-Velez с соавторами (2023) показаны морфокинетические показатели развития эмбрионов после витрификации неоплодотво-рившихся ооцитов с клетками кумулюса, при этом оплодотворение авторы проводили после оттаивания ооцитов [8]. Уровень формирования бластоцист при использовании такого подхода составлял 28,8 %, что сопоставимо с полученными нами результатами - 31,1 %.
Наши данные, полученные на витрифицированных зиготах КРС, имеют схожую тенденцию, что и ранее опубликованные нами данные результатов исследований на зиготах, не подвергавшихся криоконсервации: первые быстрые дробления во многом определяют дальнейшее развитие эмбриона [9]. Витрификация ооцитов в нашем исследовании не повлияла значительным образом на уровень формирования блас-тоцист.Тем не менее необходимо отметить, что нельзя напрямую некритически применять временные показатели, полученные в нашем исследовании, с результатами, полученными в других условиях. Так как, безусловно, очень многие факторы могут сдвигать временные рамки дробления эмбриона: метод получения биологического материала (прижизненная пункция или посмортальная аспирация из яичников), условия культивирования (среда, масло, рН, температура, уровень кислорода и т. д.), применение криоконсервированного или нативного материала и способ его замораживания, метод оплодотворения (инъекция сперматозоида в цитоплазму или инсеминация комплекса с ооцитом), возраст или сопутствующие заболевания донора генетического материала и т. д. В целом можно сделать однозначное заключение, что медленно дробящиеся эмбрионы имеют низкую жизнеспособность и низкий потенциал к формированию бластоцисты. И наоборот, у жизнеспособных эмбрионов клеточные циклы короче. Так, было показано, что эмбрионы, клеточные циклы которых более длительны и временные интервалы сдвинуты в сторону увеличения во время первых митотических делений, имеют повышенную экспрессию генов, связанных с апоптозом и клеточным стрессом, по сравнению с быстроразвивающимися эмбрионами [10].
Наши данные, полученные на посмортально аспирированных фолликулах и in vitro созревших ооцитах, в основных тенденциях согласуются с данными Sugimura, полученными прижизненной пункцией коров-доноров после гормональной стимуляции яичников [6], и с данными D. Аngel-Velez, полученными при витрификации неоплодотворенных ооцитов [8]. К сожалению, в дизайн нашего исследования не входил перенос полученных бластоцист коровам-реципиентам, поэтому мы не смогли оценить способность к имплантации бластоцист, сформированных на седьмой или девятый день развития эмбрионов in vitro.
В настоящее время в большинстве клинических, ветеринарных и исследовательских лабораторий стандартом является использование морфологии как критерия для селекции эмбрионов. На основе морфологических характеристик эмбрионы могут быть оценены на разных стадиях развития (пронуклеарная, дробление, бластоциста). Вместе с тем общепризнано, что этот подход далек от совершенства. Система покадровой съемки эмбрионального развития является одной из передовых технологий, ис- пользуемых при получении эмбрионов in vitro у людей и сельскохозяйственных животных. Ожидается, что данная технология улучшит способность специалиста эмбриолога отбирать компетентный к развитию эмбрион. На основании нашего исследования можно заключить, что характеристики и временные показатели первых дроблений зиготы крупного рогатого скота имеют важный прогностический потенциал, свидетельствуют о компетентности эмбриона к дальнейшему развитию и могут быть использованы для селекции жизнеспособных эмбрионов. Атипичные паттерны дробления и увеличение времени между делениями являются негативными прогностическими факторами, снижающими вероятность формирования бластоцисты.
Одним из ограничений нашего исследования было то, что часть данных (например деление эмбриона от 5-клеточной до 8-клеточной стадии) была пропущена из-за липидных гранул в цитоплазме эмбриона и сложности достоверного определения клеточности эмбриона. Кроме того, морфокинетические параметры были аннотированы одним специалистом, что снизило вероятность сильной дисперсии между измерениями при оценке разными эмбриологами. Одним из решений, позволяющих избежать проблем потери данных и снизить субъективность измерений, было бы получение морфокинетических параметров с использованием автоматических систем распознавания изображений. Так, для применения в медицине в программах вспомогательной репродукции на базе морфокинетических параметров дробления эмбрионов человека в совокупности с технологией машинного обучения был разработан алгоритм, помогающий специалисту получить объективную оценку качества эмбриона для лучшего отбора и снижения субъективности при интерпретации и понимании данных эмбрионального развития [11, 12]. Применение технологии мониторинга развития предимплантационных эмбрионов при in vitro культивировании в репродуктивной биотехнологии крупного рогатого скота для исследовательских целей и для оптимизации селекции эмбрионов с целью последующего переноса коровам-реципиентам позволит не только создать алгоритм неинвазивного отбора эмбрионов на основе количественных и качественных параметров. Неинвазивность технологии позво- ляет сочетать time-lapse наблюдение с другими методами селекции эмбрионов, например с генетическим анализом биопсированных клеток трофэктодермы эмбриона на хромосомные анэуплоидии или моногенным тестированием целевых генов, ассоциированных с наследственными заболеваниями или продуктивными характеристиками.
Заключение. Использование неинвазивной технологии time-lapse позволяет наблюдать развитие предиплантационного эмбриона в динамике, оценивать его морфокинетические показатели, а также делать прогноз о потенциале к формированию бластоцисты и имплантации без снижения его жизнеспособности. Данная технология представляет собой очень полез- ный, хотя и дорогой инструмент, генерирующий большие объемы данных предимплантационно-го развития эмбрионов, что позволит повысить эффективность репродуктивной биотехнологии и оптимизировать условия культивирования эмбрионов in vitro за счет эффективной неинвазивной селекции эмбрионов с максимальным потенциалом к развитию. Концепция непрерывного наблюдения за эмбрионами позволяет сделать однозначное утверждение о том, что жизнеспособные и перспективные эмбрионы следуют гораздо более жестким временным рамкам и деления, а эмбрионы, останавливающиеся в развитии, как правило, выходят за пределы временного диапазона и чаще демонстрируют аномалии деления.


