Тионины пшеницы Triticum kiharae Dorof. et Migush. - новые эффективные ингибиторы Candida albicans (C.P. Robin) Berkhout
Автор: Слезина М.П., Истомина Е.А., Одинцова Т.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоактивные метаболиты
Статья в выпуске: 1 т.54, 2019 года.
Бесплатный доступ
Растения служат источником биологически активных веществ, важнейшими из которых являются антимикробные пептиды (АМП). АМП - неотъемлемая часть защитного арсенала всех живых существ. Представители семейства тионинов, характерного только для растений, - эффективные ингибиторы растительных патогенов, в том числе бактерий и грибов, что открывает перспективы их практического использования в качестве биопестицидов для защиты растений от болезней. Однако действие тионинов на возбудителей заболеваний животных и человека, практически не изучено. Дрожжеподобные грибы рода Candida - условно-патогенные микроорганизмы, которые встречаются у 70 % людей, не вызывая заболеваний (M. Dadar с соавт., 2018). Однако при ослаблении иммунитета они могут стать причиной серьезных болезней, частота которых значительно возросла в последние два десятилетия. Антимикотики, традиционно используемые для лечения инфекций, вызванных грибами рода Candida, не всегда эффективны и безопасны для человека. В связи с этим в мире ведется постоянный поиск новых природных антифунгальных агентов...
Иммунитет растений, антимикробные пептиды, пшеница, тионины, микозы
Короткий адрес: https://sciup.org/142220085
IDR: 142220085 | УДК: 577.112:615.322 | DOI: 10.15389/agrobiology.2019.1.169rus
Текст научной статьи Тионины пшеницы Triticum kiharae Dorof. et Migush. - новые эффективные ингибиторы Candida albicans (C.P. Robin) Berkhout
Хотя у растений нет системы приобретенного иммунитета, как у высших позвоночных, они обладают врожденным иммунитетом, что позволяет им узнавать патогены и подавлять их рост в растительных тканях (1). Для ингибирования патогенов растения используют арсенал «химических средств» защиты, в том числе вторичные метаболиты и вещества белковой природы — антимикробные белки (АМБ) и пептиды (АМП) (2-4). Антимикробные пептиды — важнейшие компоненты врожденного иммунитета как у животных, так и у растений. Это короткие (менее 100 аминокислотных остатков), положительно заряженные, амфифильные полипептиды, которые различаются между собой по первичной и пространственной структуре, а также по так называемому цистеиновому мотиву — порядку расположения остатков цистеина в молекуле пептида (5-9). На основании сходства структуры выделяют несколько семейств АМП растений: тионины, дефензины, неспецифические липид-переносящие белки, геве-ино- и ноттиноподобные пептиды, гарпинины, а также макроциклические пептиды (циклотиды) (5-7). АМП могут использоваться на практике — в
Работа выполнена в рамках государственного задания ¹ 0112-2019-0002. Установление нуклеотидных последовательностей генов тионинов методом NGS поддержано грантом РНФ (¹ 16-16-00032).
сельском хозяйстве в качестве биопестицидов для защиты растений от болезней, а также в медицине при разработке на их основе лекарственных препаратов нового поколения. По сравнению с традиционными антибиотиками АМП имеют ряд преимуществ: действуют быстро, обладают широким спектром антимикробной активности, активны против изолятов патогенов, устойчивых к антибиотикам, не вызывают появления устойчивых форм патогенов, при совместном применении с антибиотиками усиливают эффект последних, обладают дополнительными полезными для человека активностями (например, подавляют развитие сепсиса).
Тионины — короткие (∼ 5 кДа), обогащенные остатками цистеина пептиды, которые впервые были обнаружены в муке пшеницы (10). Позднее их нашли у разных одно- и двудольных растений. В настоящее время известно около 100 последовательностей тионинов из 15 видов растений (11). По числу остатков цистеина, образующих дисульфидные связи, тионины подразделяют на две основные группы — пептиды, содержащие соответственно 6 и 8 остатков цистеина (5). На основании особенностей структуры выделяют пять классов тионинов (12). Уже более 60 лет известно, что тионины ингибируют рост фитопатогенных бактерий и грибов in vitro (13). R. Fernandez de Caleya с соавт. (14) впервые показали, что тионины подавляют рост фитопатогенных бактерий, и выдвинули предположение о защитной роли этих белков in planta. Дальнейшие исследования показали, что тионины ингибируют рост как грамположительных, так и грамотрицательных бактерий, а также ряда фитопатогенных грибов и оо-мицетов, причем IC50 обычно составляет от 1 до 15 мкг/мл (11, 15, 16). В то же время биологическая активность тионинов в отношении патогенных, а также условно-патогенных микроорганизмов человека изучена недостаточно.
Candida albicans представляет собой дрожжеподобный гриб, который присутствует в нормальной микрофлоре 70 % людей (в ротовой полости, пищеводе, кишечнике, половых путях и на коже), не вызывая заболеваний (17). У людей с ослабленным иммунитетом (ВИЧ-инфицированных, онкобольных и пациентов после трансплантации органов) этот гриб может вызвать серьезные заболевания, включающие поражения слизистых оболочек и общие поражения организма (18-20) . Инфекции, вызванные Candida spp., включают широкий спектр серьезных заболеваний, таких как инвазивный кандидоз (наличие грибов рода Candida в крови), хронический диссеминированный кандидоз, эндокардит, менингит и эндофтальмит (19).
При инвазивных микозах используют пять классов антимикотиков: азолы (производные имидазола и триазола), полиены (полиеновые антибиотики), аллиламины, эхинокандины и фторпиримидины (21, 22). Однако лечение таких инфекций перечисленными лекарственными средствами в ряде случаев затруднено из-за ограниченного спектра активности, развития резистентности у патогена и фунгистатического, а не фунгицидного действия препаратов (23). Кроме того, многие из известных антимикотиков токсичны для клеток млекопитающих. Поэтому природные антибиотики (АМП, в частности тионины) могут рассматриваться как перспективные молекулы для борьбы с микозами человека и животных.
В настоящей работе мы исследовали тионины синтетического вида гексаплоидной пшеницы Triticum kiharae Dorof. et Migush. Он обладает высокой устойчивостью к фитопатогенам, что связано с большим разнообразием АМП, выявленных нами в семенах растений этого вида, среди которых два тионина, названные Tk-AMP-BP и Tk-AMP-АP (24). Ранее мы установили их короткие N-концевые аминокислотные последователь-170
ности, и показали, что эти АМП эффективно ингибируют фитопатогенные грибы (24, собственные неопубликованные данные) и проявляют антиму-тагенную активность, защищая клетки человека от токсического воздействия ионов кадмия (25). В то же время полная первичная структура этих АМП оставалась неизученной, как и их способность ингибировать рост и развитие патогенов человека.
В представленной работе мы впервые установили первичную структуру двух тионинов пшеницы T. kiharae , последовательность одного из них ― Tk-AMP-BP ― подтвердили методом NGS (next-generation sequencing) и показали, что этот тионин обладает фунгицидным действием на клетки С. albicans при очень низких концентрациях.
Цель исследования состояла в выделении тионинов из семян пшеницы T. kiharae , установлении их полной аминокислотной последовательности и изучении антифунгальной активности против C. albicans .
Методика. Тионины выделяли из семян T. kiharae (10 г), измельченных в кофемолке. Полученную муку экстрагировали 50 мл смеси кислот (1 M HCl и 5 % HCOOH, «Химмед», Россия) в течение 1 ч при постоянном перемешивании. После центрифугирования (10000 g, 15 мин) бел-ково-пептидную фракцию осаждали из супернатанта пятью объемами охлажденного ацетона (осч, «Химмед», Россия) в течение ночи при 4 °С. Осадок подсушивали на воздухе, растворяли в 5 мл 50 мМ аммоний-бикарбонатного буфера (рН 7,8), центрифугировали (10000 g, 10 мин) и осадок отбрасывали. Супернатант перемешивали в течение 1 ч с 1 г хитина («Sigma», США), предварительно промытого двумя объемами 0,1 % трифторуксусной кислоты (ТФУ) (puriss. p.a., «Fluka», Швейцария), двумя объемами воды MQ и уравновешенного тремя объемами 50 мМ NH4HCO3 (хч, «Реахим», Россия). После иммобилизации белково-пептидной фракции на хитине хитин 3 раза промывали 20 мл 50 мМ NH4HCO3 для удаления несвязавшихся компонентов, после чего связавшуюся с хитином бел-ково-пептидную фракцию элюировали 30 мл 0,1 % ТФУ и разделяли методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ, High performance liquid chromatography, HPLC) на колонке Reprosil C18 (4½250 мм, «Dr. Maisch GmbH», Германия) в градиенте концентрации ацетонитрила (UHPLC Supergradient, «PanReac Quimica SLU», Испания): 10-50 % раствора Б (80 % ацетонитрил в 0,1 % ТФУ) в растворе А (0,1 % ТФУ), в течение 60 мин (скорость элюции 1 мл/мин, детекция при X = 214 нм). Фракции анализировали масс-спектрометрически («Bruker Daltonik GmbH», Германия).
Для выделения индивидуальных компонентов фракцию, содержавшую тионины, подвергали рехроматографии на колонке Luna C18 (4,6½150 мм, «Phenomenex, Inc.», США) в градиенте концентрации ацетонитрила (20-50 % раствора Б в растворе А) в течение 30 мин (скорость элюции 0,75 мл/мин, детекция при X = 214 нм).
Восстановление и алкилирование дисульфидных связей проводили, как описано ранее (24). Для этого 10 мкг высушенного пептида растворяли в 40 мкл раствора, содержащего 6 М гидрохлорид гуанидина и 2 мМ EDTA (BioUltra, «Sigma-Aldrich», США) в 0,5 М Тris-HCl буфере (рН 8,5). Затем к раствору добавляли 2 мкл 1,4 М водного раствора дитиотреитола (BioUltra, «Sigma-Aldrich», США). Полученную реакционную смесь вортек-сировали и инкубировали 4 ч при 40 °С, после чего добавляли 2 мкл 4-винилпиридина (M w ~ 60000, «Sigma-Aldrich», США). Смесь инкубировали 20 мин при комнатной температуре в темноте, затем разбавляли 100 мкл 0,1 % ТФУ и наносили на колонку Luna C18 (4,6½150 мм, «Phenomenex,
Inc.», США). Продукты реакции разделяли в градиенте концентрации ацетонитрила (0-50 % в 0,1 % ТФУ) в течение 30 мин.
РНК выделяли из проростков пшеницы с использованием набора Plant RNA Isolation Aid ( « Ambion, Inc. » , США). Качество полученного препарата РНК проверяли с помощью анализатора Agilent 2100 Bioanalyzer ( « Agilent » , США). Тотальную РНК очищали от фракции рибосомальной РНК, несвязанных рибонуклеотидов и возможных остатков геномной ДНК с использованием готовых реактивов фирмы « Illumina, Inc. » (США) по протоколу производителя.
Библиотеки кДНК получали, как описано (26). Cеквенирование библиотек кДНК проводили на приборе Genome Analyzer IIx ( « Illumina, Inc. » , США). Сборку транскриптомов осуществляли с помощью программы Trinity (версия 2.1.0) (27) с цифровой нормализацией на 50-кратное покрытие.
Для поиска транскриптов предшественников тионинов применяли разработанный нами алгоритм, описанный ранее (26).
Масс-спектры снимали на МАЛДИ-времяпролетном масс-спектрометре (матрично-активированная лазерная десорбция/ионизация, Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry, MALDI-TOF-MS) Ultraflex II TOF/TOF («Bruker Daltonik GmbH», Германия) в линейном режиме или режиме положительных ионов с использованием ре-флектрона. Матрицей служила 2,5-дигидроксибензойная кислота (Ultra pure, «Sigma-Aldrich», США) в концентрации 10 мг/мл в 50 % (объем/объем) ацетонитриле, содержащем 0,1 % (объем/объем) ТФУ. Для калибровки прибора использовали стандартный набор пептидов и белков в диапазоне молекулярных масс 700-66000 Да («Sigma-Aldrich», США).
При установлении аминокислотной последовательности восстановленные и алкилированные тионины упаривали на вакуумном концентраторе Savant SpeedVac Concentrator («Thermo Fisher Scientific», США) до объема 50 мкл. Первичную структуру определяли методом ступенчатой деградации по Эдману на секвенаторе Procise 492 («Applied Biosystems, Inc.», США) согласно протоколу фирмы-производителя.
Поиск гомологичных последовательностей проводили с использованием баз данных GenBank /EMBL-Bank .
Антифунгальную активность изучали, используя 3-суточную культуру C. albicans , выращенную на агаре Сабуро. Клетки гриба суспендировали в жидкой питательной среде Сабуро (1½106 кл/мл). Образец пептида растворяли в питательной среде до концентрации 200 мкг/мл и готовили серию из десяти 2-кратных разведений. В лунки 96-луночных полистироловых планшетов для биологических испытаний («BioCell», США) вносили по 50 мкл суспензии гриба и 50 мкл раствора пептида. Отрицательным контролем служила питательная среда, положительным — 50 мкл суспензии гриба и 50 мкл питательной среды. Плашки инкубировали в течение 72 ч при 28 °С. Затем контрольный образец (без пептида) разбавляли жидкой средой Сабуро (1:1000) и 100 мкл наносили на агар Сабуро в чашках Петри. Чашки инкубировали при 28 °С в течение 48 ч. Рост гриба в контроле принимали за 100 %. Аналогичным образом анализировали опытные образцы, содержащие разные концентрации пептида. Определяли минимальную ингибирующую концентрацию пептида (МИК), при которой происходило полное (100 %) подавление роста гриба. Эксперимент проводили в 3 повторностях.
Результаты. Тионины пшеницы выделяли в несколько этапов: на первом этапе белково-пептидную фракцию экстрагировали смесью кислот 172
(24), на втором — АМП иммобилизовали на хитине (28), на третьем — АМП разделяли методом ОФ-ВЭЖХ и получали фракцию тионинов; на заключительном этапе индивидуальные тионины очищали с применением рехроматографии. На рисунке 1 приведен профиль хроматографического разделения АМП пшеницы на обращенно-фазовой колонке Reprosil C18.
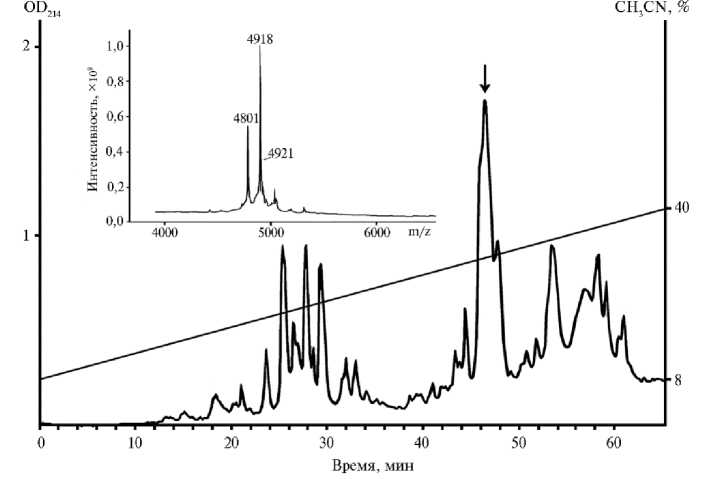
Рис. 1. Разделение антимикробных пептидов, выделенных из семян пшеницы Triticum kiharae , методом ОФ-ВЭЖХ ( обращенно-фазовая высокоэффективная жидкостная хроматография) на колонке Reprosil C 18 (4½250 мм, «Dr. Maisch GmbH», Германия) в градиенте концентрации ацетонитрила. Фракция, содержащая тионины, отмечена стрелкой. На вставке приведен масс-спектр этой фракции (МАЛДИ-ТОФ масс-спектрометр, « Bruker Daltonik GmbH», Германия). Описание условий хроматографии и масс-спектрометрии см. в разделе «Методика».
Масс-спектрометрический анализ показал, что смесь тионинов элюируется со временем удерживания 46,35 мин. В этой фракции были обнаружены компоненты с молекулярными массами 4918 Да, 4801 Да и 4921 Да, причем первые два преобладали (см. рис. 1). Для очистки тионинов провели рехроматографию содержащей тионины фракции на колонке Luna C18 (данные не представлены). В результате были очищены два пептида с молекулярными массами 4918 Да и 4801 Да.
Аминокислотные последовательности восстановленных и алкилированных тионинов были определены методом автоматического секвенирования по Эдману (рис. 2). Для сравнения также приведены депонированные в GenBank аминокислотные последовательности тионинов гекса-плоидной пшеницы T. aestivum и диплоидных видов T. urartu и T. monococ-cum — предполагаемых доноров генома А полиплоидных видов пшеницы, а также тионинов ячменя и ржи. Длина полипептидной цепи у обоих выделенных нами пуротионинов составляет 45 аминокислотных остатков. Тионин T. kiharae с молекулярной массой 4918 Да соответствовал по массе и времени элюции с обращенно-фазовой колонки тионину Tk-AMP-BP, охарактеризованному нами ранее по N-концевой аминокислотной последовательности (24). Определение полной аминокислотной последовательности этого пептида подтвердило его идентичность тионину Tk-AMP-BP. Второй пептид с молекулярной массой 4801 Да оказался новым и не описанным ранее. Установление его аминокислотной последовательности и ее сравнение с известными тионинами злаков показало, что он также пред- ставляет собой тионин, но в отличие от Tk-AMP-BP относится к семейству α-тионинов. Этот тионин был обозначен нами Tk-AMP-AP1. Оба тионина T. kiharae, как и другие тионины злаков, содержат по 8 остатков цистеина (см. рис. 2). Проведенное нами алкилирование невосстановленных пептидов винилпиридином не привело к изменению их молекулярной массы, следовательно, в их молекулах нет свободных сульфгидрильных групп, а все SH-группы образуют дисульфидные связи, что является характерным признаком АМП растений.
Вид
Triticum kiharae
T. kiharae
T. aestivum (CAA65312.1)
T. aestivum (CAA65313.1)
T. urartu (АСЫ 1920.1)
T urartu (ACL11926.1)
Г monococcum (ACL11901.1)
T. monococcum (ACL11917.1)
Secale cereale (CAA65316.1) Hordeum culgare (AAA32966.1)
H. vulgare (1206255A)
Аминокислотная последовательность Пептид
KS^KSTLGRNSYNbjRARGAQKLgANV^BSKLTSGLsSpKDFPK TK-AMP-BP KS^RSTLGRNgYNLgRARGAQKigAGVgBgKIASGLSgPKGFPK TK-AMP-AP1 KS^KSTLGRNgYNigRARGAQKL3ANV3R3KLTSGLS3PKDFPK p-pUTOthlonln KS^RSTLGRNgYNLgRARGAQKLgAGV^P^ISSGLSgPKGFPK ав-рШО1Ыоп!п KsSSKSTLGRNHYNLSRARGAOKlflANVfflRSKLTSGLsHPKDFPK p-pUTOthionin KS^KSTLGRDSYNlSRARGAOKLSANVHnSKLTSGLSgPKDFPK p.p urothionin KS[£KSILGRNg¥NL3RARGAQKL3ANV3li2KLTSGLS3PKDFPK P-purothlonin KS^KSTLGRNgYNbgRARGAQKbgANVgRgKLTSGLSgPKDFPK p-р urothionin KS^KSTLGRNgYNLgRTRGAQKLgANFgBgKLISSTSgPKEFPK purothionin KS^RSTLGRNgYNI^RVRGAQKI^AGVgsSKLTSSGKgPTGFPK u-hordothionin
KS^RSTLGRN0YNl3RVRGAQKb3ANA0p2KLTSGLKgPSSFPK p-hordothionin
Рис. 2. Аминокислотные последовательности выделенных тионинов Triticum kiharae и тионинов других видов злаков. Множественное выравнивание выполнено в программе CLUSTAL W2. В скобках указаны номера последовательностей в GenBank. В выравнивании белыми буквами на черном фоне обозначены остатки цистеина, серым цветом выделены различающиеся аминокислотные остатки.
Аминокислотная последовательность пуротионина Tk-AMP-BP пшеницы T. kiharae была подтверждена нами при анализе транскриптомов проростков методом NGS. Для поиска транскриптов предшественников тионинов в массиве данных (data set) секвенирования использовался алгоритм, разработанный нами ранее (26). В результате у пшеницы обнаружили 15 транскриптов, кодирующих предшественники тиониноподоб-ных пептидов, которые состоят из сигнального пептида, зрелого пептида и С-концевого продомена. У одного предшественника последовательность зрелого пептида полностью совпадала с выделенным из зерновок пуро-тионином Tk-AMP-BP (рис. 3). Помимо этого транскрипта был найден транскрипт Tk-amp-ap2, кодирующий близкий гомолог пуротионина Tk-AMP-AP1.
Tk-amp-bp
Tk-amp-ap2
MGSKGLKGVMVCLLILGLVLEQVQVEG KSgKSTLGRNSYNLgRARGAQKLgANVSRSKLTSGLSHPKDFPK MGSKGLKGVWCLLILGLVLEQVQVEG KSMSRTTLGMiSYNLSRSRGAQKL"sTv5®SKLTSGLs!8pKGFPK
Tk-amp-bp LVLESNSDEPDTMEYCNLGCRSSLCDYMVNMADDEEMKLYVEQCGDACVNFCNADAGLTSLDA
Tk-amp-ap2 lalesnsdepdtieycnlgcrssvcdymvnaaaddeemklyvencgdacvnfcngdagltslda
Рис. 3. Аминокислотные последовательности предшественников тионинов пшеницы T. kiharae . Сигнальный пептид выделен подчеркиванием, зрелый пептид — жирным шрифтом, С-кон-цевой продомен — подчеркиванием и курсивом. В зрелом пептиде белыми буквами на черном фоне обозначены остатки цистеина, серым цветом выделены различающиеся аминокислотные остатки.
Сравнение последовательностей полученных пуротионинов с таковыми тионинов других видов злаков показало, что последовательность Tk-AMP-BP T. kiharae совпадает с последовательностью β-пуротинина T. aes-tivum, а также с одной из двух известных последовательностей β-пуро-тионинов T. urartu и T. monococcum (см. рис. 2). Известно, что у гексапло-идной пшеницы T. aestivum три тионина, обозначенные как пуротионины β, αB и αD. Их кодируют гены pur A1 , pur B1 и pur D1 , расположенные соответственно на длинных плечах хромосом 1A, 1B и 1D (29). Поскольку ген β-пуротинина связан с геномом А, выявленное нами сходство последовательностей этих тионинов у носителей генома А — T. kiharae (AAGGDD),
T. aestivum (AABBDD), T. urartu (AuAu) и T. monococcum (AmAm) неудивительно. Последовательности α-пуротионинов также высококонсервативны: у Tk-AMP-AP1 T. kiharae и α-пуротионина T. aestivum последовательности различаются одной заменой в положении 34 (Ser → Ala).
Поскольку тионин Tk-AMP-BP T. kiharae получили в количестве, достаточном для биологических испытаний, именно его использовали для анализа ингибирующей активности против C. albicans . Проведенные исследования показали, что этот тионин при очень низкой концентрации (МИК = 0,78 мкг/мл) способен полностью ингибировать рост С. аlbicans , то есть он обладает мощным фунгицидным действием в отношении этого патогена. Следует отметить, что активность тионинов других видов растений была ниже. Так, тионин арабидопсиса подавлял рост С. аlbicans на 80 % лишь при концентрации 2,5 мкг/мл (18), а тиониноподобный белок Capsicum annuum проявлял еще меньшую активность (IC50 = 10 мкг/мл) (30). Механизм действия тионина пшеницы на клетки С. аlbicans неизвестен. Cчитается, что биологическая активность тионинов связана с непосредственным взаимодействием с мембранами клеток-мишеней, и были предложены три модели такого взаимодействия (11). Исследования действия пуротионинов на Rhizoctonia solani показали, что лизис клеток этого гриба вызван резким увеличением проницаемости мембран (31), по всей видимости, за счет образования пор (32). Можно предположить, что аналогичный механизм реализуется и в случае гриба С. albicans, однако подобное предположение нуждается в экспериментальной проверке.
Итак, из зерновок пшеницы Triticum kiharae нами впервые выделены два пуротионина Tk-AMP-BP и Tk-AMP-AP1 и определена их полная аминокислотная последовательность. Последовательность пуротионина Tk-AMP-BP была подтверждена при анализе транскриптомов проростков методом NGS. Впервые показано, что пуротионин Tk-AMP-BP обладает мощным фунгицидным действием на клетки Candida аlbicans, действуя в очень низких концентрациях (МИК = 0,78 мкг/мл) и превосходя по активности тионины других видов растений. Высокая фунгитоксичность тионина пшеницы в отношении С. аlbicans открывает перспективы использования этого антимикробного пептида для создания на его основе новых лекарственных препаратов для борьбы с кандидозами.
Список литературы Тионины пшеницы Triticum kiharae Dorof. et Migush. - новые эффективные ингибиторы Candida albicans (C.P. Robin) Berkhout
- Dangl J.L., Jones J.D.G. Plant pathogens and integrated defense responses to infection. Nature, 2001, 411: 826-833 ( ) DOI: 10.1038/35081161
- Selitrennikoff C.P. Antifungal proteins. Appl. Environ. Microbiol., 2001, 67: 2883-2894 ( ) DOI: 10.1128/aem.67.7.2883-2894.2001
- Manners J.M. Hidden weapons of microbial destruction in plant genomes. Genome Biology, 2007, 8: 225-234 ( ) DOI: 10.1186/gb-2007-8-9-225
- Sels J., Mathys J., De Coninck B.M.A., Cammue B.P.A., De Bolle M.F.C. Plant pathogenesis-related (PR) proteins: a focus on PR peptides. Plant Physiol. Biochem., 2008, 46(11): 941-950 ( ) DOI: 10.1016/j.plaphy.2008.06.011
- Broekaert W.F., Cammue B.P.A., De Bolle M.F.C., Thevissen K., De Samblanx G.W., Osborn R.W., Nielson K. Antimicrobial peptides from plants. Critical Reviews in Plant Sciences, 1997, 16(3): 297-323 ( ) DOI: 10.1080/07352689709701952
- Garcia-Olmedo F., Molina A., Alamillo J.M., Rodriguez-Palenzuela P. Plant defense peptides. Biopolymers, 1998, 47(6): 479-491 (doi: 10.1002/(sici)1097-0282(1998)47:63.0.co;2-k).
- Garcia-Olmedo F., Rodriguez-Palenzuela P., Molina A., Alamillo J.M., Lopez-Solanilla E., Berrocal-Lobo M., Poza-Carrion C. Antibiotic activities of peptides, hydrogen peroxide and peroxynitrite in plant defence. FEBS Lett., 2001, 498(2-3): 219-222 ( )
- DOI: 10.1016/s0014-5793(01)02456-5
- Егоров Ц.А., Одинцова Т.И. Защитные пептиды иммунитета растений. Биоорганическая химия, 2012, 38(1): 7-17.
- Tam J.P., Wang S., Wong K.H., Tan W.L. Antimicrobial peptides from plants. Pharmaceuticals (Basel), 2015, 8(4): 711-757 ( )
- DOI: 10.3390/ph8040711
- Balls A.K., Hale W.S., Harris T.H. A crystalline protein obtained from a lipoprotein of wheat flour. Cereal Chemistry, 1942, 58: 360-361.
- Stec B. Plant thionins -the structural perspective. Cell. Mol. Life Sci., 2006, 63(12): 1370-1385 ( )
- DOI: 10.1007/s00018-005-5574-5
- Bohlmann H., Apel K. Isolation and characterization of cDNAs coding for leaf-specific thionins closely related to the endosperm-specific hordothionin of barley Hordeum vulgare L. Mol. Gen. Genet., 1987, 207(2-3): 446-454 ( )
- DOI: 10.1007/BF00331614
- Stuart L.S., Harris T.H. Bactericidal and fungicidal properties of a crystalline protein isolated from unbleached wheat flour. Cereal Chemistry, 1942, 19: 288-300.
- Fernandez de Caleya R., Gonzalez-Pascual B., Garcia-Olmedo F., Carbonero P. Susceptibility of phytopathogenic bacteria to wheat purothionins in vitro. Journal of Applied Microbiology, 1972, 23(5): 998-1000.
- Bohlmann H., Broekaert W.F.A The role of thionins in plant protection. Critical Reviews in Plant Sciences, 1994, 13: 1-16 ( )
- DOI: 10.1080/07352689409701905
- Loeza-Ángeles H., Sagrero-Cisneros E., Lara-Zárate L., Villagόmes-Gόmez E., Lόpez-Meza J.E., Ochoa-Zarzosa A. Thionin Thi2.1 from Arabidopsis thaliana expressed in endothelial cells shows antibacterial, antifungal and cytotoxic activity. Biotechnol. Lett., 2008, 30(10): 1713-1719 ( )
- DOI: 10.1007/s10529-008-9756-8
- Dadar M., Tiwari R., Karthik K., Chakraborty S., Shahali Y., Dhama K. Candida albicans -biology, molecular characterization, pathogenicity, and advances in diagnosis and control -an update. Microbial Pathogenesis, 2018, 117: 128-138 ( )
- DOI: 10.1016/j.micpath.2018.02.028
- Божко А.В., Котова А.Л. Микологические и клинико-патанатомические аспекты кандидоза. Мат. II Всесоюз. конф. «Актуальные вопросы клинической микробиологии в неинфекционной клинике». Барнаул, 1988, ч. 2: 154-156.
- Antinori S., Milazzo L., Sollima S., Galli M., Corbellino M. Candidemia and invasive candidiasis in adults: A narrative review. European Journal of Internal Medicine, 2016, 34: 21-28 ( )
- DOI: 10.1016/j.ejim.2016.06.029
- Kim J.Y. Human fungal pathogens: why should we learn? J. Microbiol., 2016, 54(3): 145-148 ( )
- DOI: 10.1007/s12275-016-0647-8
- Bassetti M., Peghin M., Timsit J.F. The current treatment landscape: candidiasis. Journal of Antimicrobial Chemotherapy, 2016, 71(suppl 2): ii13-ii22 ( )
- DOI: 10.1093/jac/dkw392
- Robbins N., Wright G.D., Cowen L.E. Antifungal drugs: the current armamentarium and development of new agents. Microbiology Spectrum, 2016, 4(5): FUNK-0002-2016 ( )
- DOI: 10.1128/microbiolspec.FUNK-0002-2016
- Sanguinetti M., Posteraro B., Lass-Flörl C. Antifungal drug resistance among Candida species: mechanisms and clinical impact. Mycoses, 2015, 58(S2): 2-13 ( )
- DOI: 10.1111/myc.12330
- Egorov T.A., Odintsova T.I., Pukhalsky V.A., Grishin E.V. Diversity of wheat antimicrobial Peptides. Peptides, 2005, 26: 2064-2073 ( )
- DOI: 10.1016/j.peptides.2005.03.007
- Одинцова Т.И., Васильева И.М., Коростылева Т.В., Уткина Л.Л., Славохотова А.А., Рогожин Е.А., Шиян А.Н., Пухальский В.А., Засухина Г.Д. Антимутагенная активность β-пуротионина TK-AMP-BP пшеницы. Генетика, 2011, 47(9): 1267-1270.
- Odintsova T.I., Slezina M.P., Istomina EA, Korostyleva T.V., Kasianov A.S., Kovtun A.S., Makeev V.J., Shcherbakova L.A., Kudryavtsev A.M. Defensin-like peptides in wheat analyzed by whole-transcriptome sequencing: a focus on structural diversity and role in induced resistance. Peer J., 2019, 7: e6125 ( )
- DOI: 10.7717/peerj.6125
- Grabherr M.G., Haas B.J., Yassour M., Levin J.Z., Thompson D.A., Amit I., Adiconis X., Fan L., Raychowdhury R., Zeng Q., Chen Z., Mauceli E., Hacohen N., Gnirke A., Rhind N., di Palma F., Birren B.W., Nusbaum C., Lindblad-Toh K., Friedman N., Regev A. Trinity: reconstructing a full-length transcriptome without a genome from RNA-Seq data. Nature Biotechnology, 2011, 29(7): 644-652 ( )
- DOI: 10.1038/nbt.1883
- Oita S., Ohnishi-Kameyama M., Nagata T. Binding of barley and wheat alpha-thionins to polysaccharides. Bioscience, Biotechnology, and Biochemistry, 2000, 64(5): 958-964 ( )
- DOI: 10.1271/bbb.64.958
- Sánchez-Monge R., Delibes A., Hernandéz-Lucas C., Carbonero P., García-Olmedo F. Homoeologous chromosomal location of the genes encoding thionins in wheat and rye. Theor. Appl. Genet., 1979, 54(2): 61-63 ( )
- DOI: 10.1007/BF00265470
- Taveira G.B., Mathias L.S., da Motta O.V., Machado O.L., Rodrigues R., Carvalho A.O., Teixeira-Ferreira A., Perales J., Vasconcelos I.M., Gomes V.M. Thionin-like peptides from Capsicum annuum fruits with high activity against human pathogenic bacteria and yeasts. Biopolymers, 2014, 102(1): 30-39 ( )
- DOI: 10.1002/bip.22351
- Oard S., Rush M.C., Oard J.H. Characterization of antimicrobial peptides against a US strain of the rice pathogen Rhizoctonia solani. Journal of Applied Microbiology, 2004, 97(1): 169-180 ( )
- DOI: 10.1111/j.1365-2672.2004.02291.x
- Llanos P., Henriquez M., Minic J., Elmorjani K., Marion D., Riquelme G., Molgo J., Benoit E. Neuronal and muscular alterations caused by two wheat endosperm proteins, puroindoline-a and alpha-purothionin, are due to ion pore formation. Eur. Biophys. J., 2004, 33(3): 283-284 ( )
- DOI: 10.1007/s00249-003-0353-4


