Тип конфлюенса желчных протоков: неочевидный предрасполагающий фактор развития гилюсной холангиокарциномы?
Автор: Шориков Максим Андреевич, Сергеева Ольга Николаевна, Францев Дмитрий Юрьевич, Лаптева Мария Георгиевна, Решетаров Игорь Дмитриевич, Мороз Екатерина Анатольевна, Кукушкин Андрей Всеволодович, Виршке Эдуард Рейнгольдович, Долгушин Борис Иванович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.19, 2020 года.
Бесплатный доступ
Цель исследования - сравнить распространенность различных вариантов слияния желчных протоков у больных гилюсной холангиокарциномой и пациентов без билиарной патологии. Материал и методы. В исследование было включено 203 больных с опухолью Клацкина (основная группа) и 191 пациент без билиарной патологии (контрольная группа). Всем больным была проведена МРТ брюшной полости с МР-холангиопанкреатографией (МРХПГ). Кроме того, 141 больному гилюсной холангиокарциномой была выполнена прямая холангиография. Конфлюенсы желчных протоков типировались по классификации Накамура. Результаты. В основной группе конфлюенсы I, II, III, IV и V типов по Накамура встречались в 27,6; 22,2; 1,5; 36,0 и 2,4 % случаев соответственно; в 10,3 % наблюдений типировать конфлюенс не удалось. В контрольной группе распределение типов конфлюенса желчных протоков в целом соответствовало общепопуляционному: I, II, III, IV и V типы были выявлены у 75,0; 9,3; 0,5; 14,2 и 1,0 % больных соответственно. Различия между группами были значимыми (p
Опухоль клацкина, холангиокарцинома, аденокарцинома желчных протоков, мрт, мрхпг, рентгенконтрастная холангиография, конфлюенс желчных протоков, анатомия печени, анатомия желчного дерева
Короткий адрес: https://sciup.org/140254338
IDR: 140254338 | УДК: 616.361-002-006.6-036 | DOI: 10.21294/1814-4861-2020-19-2-5-16
Текст научной статьи Тип конфлюенса желчных протоков: неочевидный предрасполагающий фактор развития гилюсной холангиокарциномы?
Гилюсная холангиокарцинома неразрывно связана с именами двух исследователей – Джеральда Клацкина, подробно описавшего ее в 1965 г. на основании серии из 13 наблюдений, и Анри Бисмута, предложившего свою классификацию распространенности поражения желчных протоков 10 годами позже [1, 2]. Типирование опухолей Клацкина по Бисмуту за прошедшие с того времени четыре десятилетия настолько прочно вошло в хирургическую практику, что уже никому не приходило в голову усомниться в его анатомической обоснованности.
Появление мало- и неинвазивных методов прижизненной визуализации желчного дерева – эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) и магнитно-резонансной холангиопанкреатографии (МРХПГ) – существенно изменило представления о билиарной системе в норме и патологии [3, 4]. Прежде всего, это касалось вариантной анатомии, поскольку развивающиеся быстрыми темпами интервенционная радиология, резекционная и трансплантационная хирургия печени создавали потребность в индивидуализированной оценке желчных протоков для предоперационного планирования [5]. Сорокалетняя пауза, возникшая в анатомических исследованиях билиарной системы после работ Клода Куино [6], была прервана серией публикаций конца XX – начала XXI века [3, 5, 7–9], предлагавших различные типологические схемы ветвления желчного дерева. Несмотря на некоторые различия этих схем, все они совпадали в том, что основным типом конфлюенса желчных протоков, наблюдающимся в 57–66 % случаев, является слияние правого и левого долевого протоков в общий печеночный проток. Из подобных представлений исходил и Анри Бисмут, выделяя в cвоей классификации в отдельные подтипы IIIa и IIIb распространение опухолевой инфильтрации на правый и левый долевые протоки соответственно.
С тех пор, как хирурги-гепатологи передали билиарную декомпрессию интервенционным радиологам и эндоскопистам, именно эти специалисты видят максимально широкий спектр гилюсных холангиокарцином, включающий в себя 19–31 % резектабельных и 69–81 % нерезектабельных случаев [10–12]. У авторов настоящей работы, имеющих большой опыт планирования и проведения чрескожной чреспеченочной холангиостомии, сложилось впечатление, что типичный вариант конфлюенса, на котором базируется классификация Бисмута, встречается у этой категории больных существенно реже, чем в общей популяции. Однако мы не исключали влияния субъективного фактора на формирование подобных представлений: больные с нетипичными конфлюенсами требуют установки большего числа холангиостомических дренажей, обладают «неудобными» с точки зрения рентгенохирургической техники углами слияния желчных протоков, а также чаще сталкиваются с проблемой частичной или полной миграции дренажей; это делает их «запоминающимися».
Целью исследования стала оценка распространенности вариантов слияния желчных протоков у больных опухолью Клацкина в сравнении с таковой у пациентов без билиарной патологии по данным МРТ с МРХПГ и прямой холангиографии.
Материал и методы
Первично из госпитальной информационной системы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» МЗ РФ было отобрано 7 513 записей, сделанных в период 1987–2018 гг., о пациентах с диагнозами рак внепеченочного желчного протока (С24.0, 618 записей), злокачественное новообразование других и неуточненных частей желчевыводящих путей (С24, 203 записи), поражение желчных путей, выходящее за пределы одной и более вышеуказанных локализаций (С24.8, 22 записи), поражение желчных путей неуточненное (С24.9, 618 записей), злокачественное новообразование печени и внутрипеченочных желчных протоков (С22, 5955 записей) и рак внутрипеченочного желчного протока (С22.1, 97 записей).
После удаления неуникальных записей был проведен отбор больных по следующим критериям: диагноз «аденокарцинома желчного протока» в соответствии с данными выписки и/или патоморфологического исследования; локализация опухоли в области конфлюенса желчных протоков; наличие МРТ-исследования, включающего в себя МРХПГ; отсутствие операций на печени и желчных протоках до МРТ-исследования, за исключением холецистэктомии. После отбора по указанным критериям осталось 203 больных (108 мужчин и 95 женщин, в возрасте 21–84 года, средний возраст – 57 лет), обследованных в ФГБУ НМИЦ онкологии им. Н.Н. Блохина МЗ РФ в период 2003–18 гг.
Независимо 2 врачами-рентгенологами с опытом работы 5 и 10 лет производилась оценка типа конфлюенса по Накамура. Для оценки использовались данные МРХПГ, Т2-взвешенных изображений (Т2ВИ), диффузионно-взвешенных изображений (ДВИ), нативные Т1-ВИ и полученные после введения МР-контрастного средства (МРКС, 54 % больных в основной группе, 100 % больных в контрольной группе) и при наличии данные рентгенконтрастной холангиографии (141 пациент основной группы, в контрольной группе исследование не проводилось).
По Накамура существуют следующие анатомические варианты слияния правых секторальных желчных протоков (рис. 1):
– тип I: правый задний печеночный проток сливается с правым передним, образуя правый печеночный проток,
– тип II: правый задний печеночный проток сливается с правым передним и левым печеночным протоком,
– тип III: правый задний печеночный проток впадает в общий печеночный проток,
– тип IV: правый задний печеночный проток впадает в левый печеночный проток,
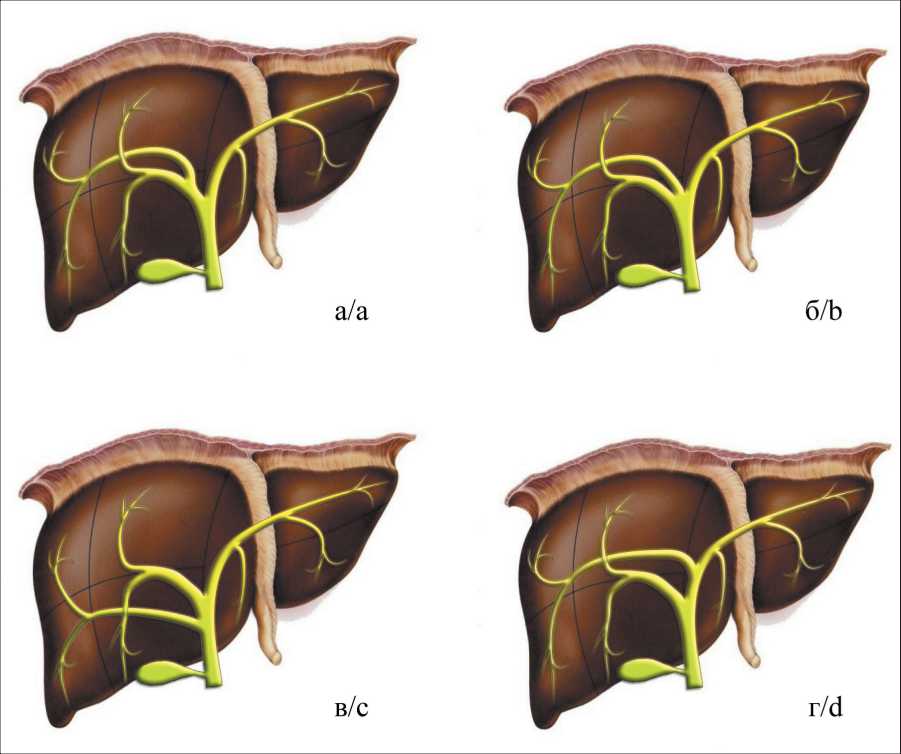
Рис. 1. Анатомические варианты слияния правых секторальных желчных протоков по Накамура: а) тип I: правый задний печеночный проток сливается с правым передним, образуя правый печеночный проток, б) тип II: правый задний печеночный проток сливается с правым передним и левым печеночным протоком, в) тип III: правый задний печеночный проток впадает в общий печеночный проток, г) тип IV: правый задний печеночный проток впадает в левый печеночный проток
Fig. 1. Anatomical variations in right sectoral bile ducts confluence according to Nakamura: a – type I: right posterior hepatic duct converges with right anterior hepatic duct, b – type II: right posterior hepatic duct converges with right anterior and left hepatic ducts, c – type III: right posterior hepatic duct converges with common hepatic duct, d – type IV: right posterior hepatic duct converges with left hepatic duct
– тип V: редкие варианты, отток от заднего сегмента представлен двумя протоками: один впадает в общий печеночный проток, второй – в область слияния правого переднего и левого печеночных протоков; или когда оба протока впадают в левый печеночный проток.
Оценка типа конфлюенса, как правило, предусматривала просмотр нескольких серий МРТ-изображений, МРХПГ и полипозиционных рентгенконтрастных холангиограмм. Представление такого материала в формате журнальной статьи затруднительно, поэтому иллюстрации в нашей работе состоят из наиболее информативных рентген- и МРТ-изображений, дополненных поясняющими схемами. Согласованность между врачами была оценена с помощью критерия Коэна по стандартной шкале [13]: <0 – нет согласованности; 0–0,2 – незначительная; 0,2–0,4 – слабая; 0,4–0,6 – удовлетворительная; 0,6–0,8 – хорошая; 0,8–1,0 – высокая.
Межгрупповые различия оценивались по критериям χ2 и точному критерию Фишера, различия на уровне p<0,05 считались статистически достоверными.
Результаты
В основной группе тип конфлюенса не был определен из-за большой распространенности опухоли в 15 наблюдениях, сниженного качества исследования вследствие артефактов движения – в 4, тромбоза ветвей воротной вены с атрофией доли печени, затрудняющего визуализацию области слияния желчных протоков, – в 2 случаях. В контрольной группе тип конфлюенса был определен у всех пациентов. Левый долевой проток присутствовал у всех пациентов обеих групп.
При типировании конфлюенса по Накамура двумя рентгенологами критерий согласованности Коэна между ними составил 0,7 (хорошая согласованность) и 0,9 (высокая согласованность) для больных опухолью Клацкина и пациентов без билиарной патологии соответственно. Тем не менее случаи разночтений до обработки данных окончательно разрешались путем нахождения консенсуса.
Наиболее часто в основной группе встречался IV тип конфлюенса (36 %), в контрольной – I тип конфлюенса (75 %). Более того, оказалось, что у больных опухолями Клацкина в целом преобладают варианты конфлюенсов без формирования правого долевого протока: в основной группе II и IV типы отмечались в 22 % и 36 % случаев, в то время как в контрольной группе – в 9 % и 14 % наблюдений соответственно.
Таблица/Table
Распределение типов конфлюенса в сравниваемых группах Confluence types distribution in study group and control group
|
Тип конфлюенса/ Confluence type |
Опухоль Клацкина/ Klatskin tumor |
Контрольная группа/ Control group |
|
Неопределимый/Indefinable |
10,3 % |
- |
|
I |
27,6 % |
75,0 % |
|
II |
22,2 % |
9,3 % |
|
III |
1,5 % |
0,5 % |
|
IV |
36,0 % |
14,2 % |
|
V |
2,4 % |
1,0 % |
|
Всего/Total |
100,0 % |
100,0 % |
|
Достоверность различий между группами/ Significance of differences between the groups |
p<0,001 |
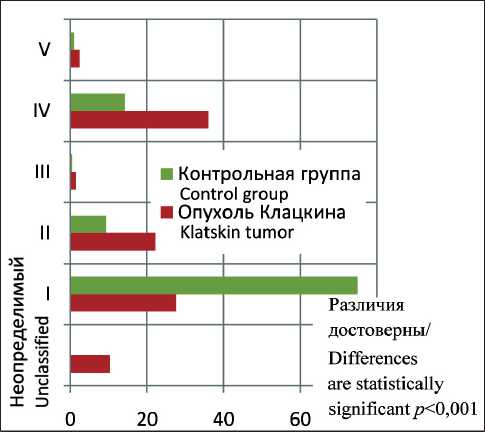
Рис. 2. Распределение типов конфлюенса в изучаемой и контрольной группах: по оси ординат показаны типы конфлю-енса, по оси абсцисс – процент исследуемых с данным типом при 1 – опухоли Клацкина (обозначено красным), 2 – в контрольной группе (обозначено зеленым). Различия в количестве представленных 1, 2 и 4 типов конфлюенса достоверны (p<0,0001) с учетом неопределимых типов
Fig. 2. Confluence type distribution in study group and control group: y axis shows confluence types, x axis shows type percentages in 1 – Klatskin tumor patients (red), 2 – control group (green). Differences are statistically significant (p<0.0001) taking into account unclassified cases
При анализе при помощи критериев χ2 и точного критерия Фишера было установлено, что у больных гилюсной холангиокарциномой распределение типов конфлюенса достоверно (p<0,0001) отличается от такового у пациентов без билиарной патологии (таблица, рис. 2). Значимых различий между группами в количестве III и V типов не выявлено. Тем не менее в статистической тенденции III и V типы тоже преобладали у больных, страдающих опухолью Клацкина, по сравнению с контрольной группой: III тип в основной группе выявлен в 1,5 %, в контрольной – в 0,5 %, V тип – в 2,4 % и 1,0 % соответственно. Достоверного влияния на результат включение и исключение больных с неопределимым типом конфлюенса вследствие ранее перечисленных причин не оказало.
Обсуждение
Проводя исследование типов конфлюенса желчных протоков, мы сфокусировали свое внимание на правых секторальных протоках, что было обусловлено рядом факторов. Во-первых, даже в общепопуляционной выборке вариабельность протоков правой доли в значительной степени превышает таковую для левой: правый долевой проток не сформирован в 34–43 %, в то время как левый – менее чем в 1 % наблюдений [3]. По нашим данным, правый долевой проток отсутствовал у 69,2 % больных в основной и у 25 % в контрольной группе, а левый присутствовал у всех пациентов обеих групп. Во-вторых, при правосторонней гемигепатэктомии риски развития послеоперационной печеночной недостаточности значимо выше, чем при левосторонней, в связи с чем последняя предпочтительнее при билатеральном распространении; в такой ситуации вариант слияния правых секторальных протоков имеет важное практическое значение для формирования гепатикоеюноанастомоза [14]. Выбор классификации конфлюенсов по Накамура из большого числа предложенных типологических схем был обусловлен ее базированием на анатомии протоков правой доли печени, а также простотой и клинической значимостью.
Хирурги-гепатологи давно высказывали соображения, что количество опухолей Клацкина типов Бисмут IIIa и IV завышается из-за вариантной протоковой анатомии, однако не представляли себе, насколько часто это происходит [15–17]. Такая ситуация сложилась исторически, в связи с ограничениями технологий визуализации гилюс-ной холангиокарциномы, применявшихся длительное время [18, 19]. Первым методом лучевой диагностики этого заболевания стала чрескожная чреспеченочная холангиография (ЧЧХГ) [20], основанная на получении рентгеновских изображений желчных протоков, заполненных рентген-контрастным веществом через установленный в желчные протоки катетер. Размеры и локализация дефектов наполнения протоков при контрастировании и легли в основу классификации Бисмута и Корлетта, предложенной в 1975 г. и используемой по сей день [1] (рис. 3):
-
– тип I: опухоль общего печеночного протока без инфильтрации конфлюенса правого и левого печеночных протоков;
-
– тип II: опухолевая обструкция конфлюенса правого и левого печеночных протоков;
-
– тип IIIa: инвазия конфлюенса и правого печеночного протока;
-
– тип IIIb: инвазия конфлюенса и левого печеночного протока;
-
– тип IV: опухолевое поражение обоих печеночных протоков.
Появившаяся в 1991 г. МРХПГ, будучи неинвазивной методикой, в значительной степени нивелировала диагностические риски, однако мало повлияла на диагностическую идеологию [21]: как и ЧЧХГ, МРХПГ оценивала контуры желчных протоков. Тем не менее по холангиографическим изображениям зачастую затруднительно бывает оценить тип конфлюенса при опухолях Клацкина; разобщение желчных протоков при стриктурах типов Bismuth IIIa и IV может быть неразличимым с отсутствием правого долевого протока как варианта анатомии [16]. Применение дополнительных типов МРТ-изображений, обладающих высоким тканевым
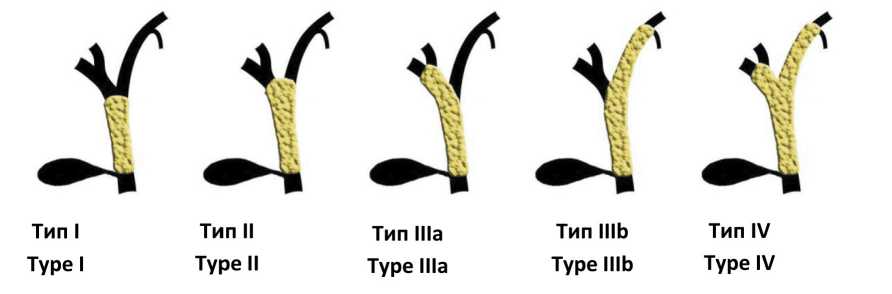
Рис. 3. Классификация Бисмута и Корлетта распространенности опухоли Клацкина. Тип I: опухоль общего печеночного протока без инфильтрации конфлюенса правого и левого печеночных протоков; тип II: опухолевая обструкция конфлюенса правого и левого печеночных протоков; тип IIIa: инвазия конфлюенса и правого печеночного протока; тип IIIb: инвазия конфлюенса и левого печеночного протока; тип IV: опухолевое поражение обоих печеночных протоков
Fig. 3. Bismuth and Corlette Klatskin classification of tumor extension. Type I: common bile duct tumor not involving right and left hepatic ducts confluence; type II: tumor obstruction of the right and left hepatic ducts confluence; type IIIa: tumor invasion of the confluence and the right hepatic duct; type IIIb: tumor invasion of the confluence and the left hepatic duct; type IV: tumor invasion of both hepatic ducts
контрастом [18, 19], в сочетании с МРХПГ предоставляет возможность отследить распространение инфильтративной муфты по ходу протока даже там, где его просвет уже не определяется, и, таким образом, упрощает типирование конфлюенса.
На рис. 4–7 приведены 4 варианта поражения проксимальных внепеченочных желчных протоков, по формальной холангиографической картине укладывающихся в тип IV по классификации Бисмута, однако лишь один из них (рис. 4) действительно характеризуется распространением опухолевой инфильтрации с правого долевого протока на секторальные, прочие же представляют собой нетипичные для общепопуляционной выборки варианты слияния желчных протоков без формирования правого долевого протока.
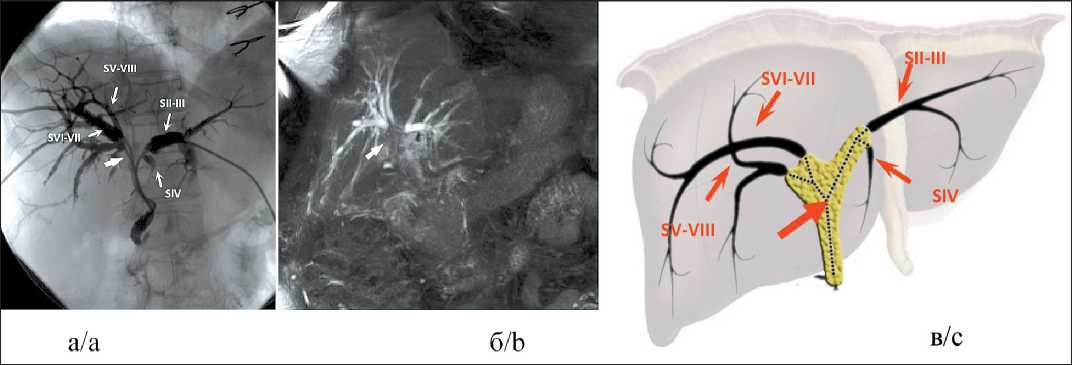
Рис. 4. Распространение опухолевой инфильтрации на секторальные протоки при I типе конфлюенса по Накамура (больная С., 64 лет):
а) рентгенконтрастная холангиограмма в прямой проекции; б) Т2-взвешенное МРТ-изображение с подавлением сигнала от жировой ткани в коронарной проекции, мультипланарная реконструкция; в) схема распространения опухолевой инфильтрации по билиарному дереву.
Секторальные протоки разобщены (отмечены тонкими стрелками и подписаны SII–III, SIV, SV–VIII и SVI–VII), через передний и задний правые, а также задний левый секторальные протоки установлены холангиостомические дренажи. Правый долевой проток анатомически выражен, замещен муфтообразным инфильтратом (толстая стрелка)
Fig. 4. Neoplastic growth extension to sectoral bile ducts in the first Nakamura confluence type (patient S., female 64 y.o.): a) direct cholangiography in frontal projection; b) T2-weighted MR-image fat saturated in coronal projection, multiplanar reconstruction; c) scheme of tumor extension along bile ducts. Sectoral ducts are disjointed (marked by thin arrows and annotated SII–III, SIV, SV–VIII and SVI–VII), drainages are set through anterior and posterior right and posterior left sectoral ducts. Right hepatic duct is present and totally infiltrated by neoplasia (thick arrow)
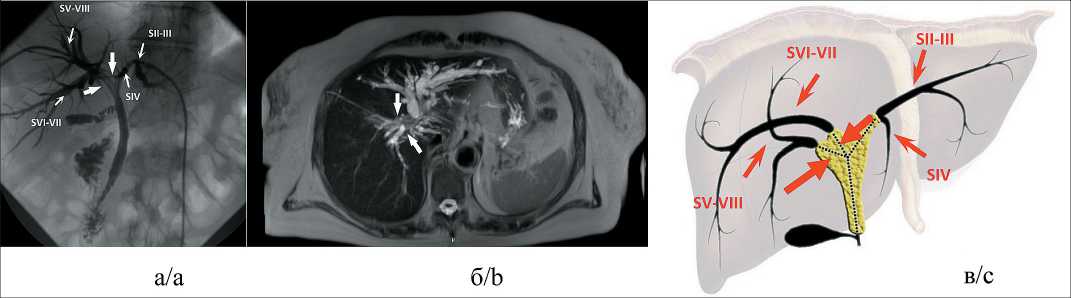
Рис. 5. Распространение опухолевой инфильтрации на секторальные протоки при II типе конфлюенса по Накамура (больная Г., 54 лет):
а) рентгенконтрастная холангиограмма в прямой проекции; б) Т2-взвешенное МРТ-изображение в аксиальной проекции, муль-типланарная реконструкция; в) схема распространения опухолевой инфильтрации по билиарному дереву.
Секторальные протоки разобщены (отмечены тонкими стрелками и подписаны SII–III, SIV, SV–VIII и SVI–VII), через передний и задний правые, а также задний левый секторальные протоки установлены холангиостомические дренажи. Правый долевой проток не выражен, правые секторальные и левый долевой проток сливаются в конфлюенс по типу трифуркации. Разобщение правых секторальных протоков (толстые стрелки) вызвано не столько опухолевой инфильтрацией, сколько анатомическим вариантом желчного дерева
Fig. 5. Neoplastic growth extension to sectoral bile ducts in the second Nakamura confluence type (patient G., female 54 y.o.): a) direct cholangiography in frontal projection; b) T2-weighted MR-image fat saturated in axial projection, multiplanar reconstruction; c) scheme of tumor extension along bile ducts. Sectoral ducts are disjointed (marked by thin arrows and annotated SII–III, SIV, SV–VIII and SVI– VII), drainages are set through anterior and posterior right and posterior left sectoral ducts. Right hepatic duct is absent, right sectoral ducts and left hepatic duct converge to a trifurcation, ducts disjunction (thick arrow) is more due to the anatomical variant of the confluence than tumor infiltration
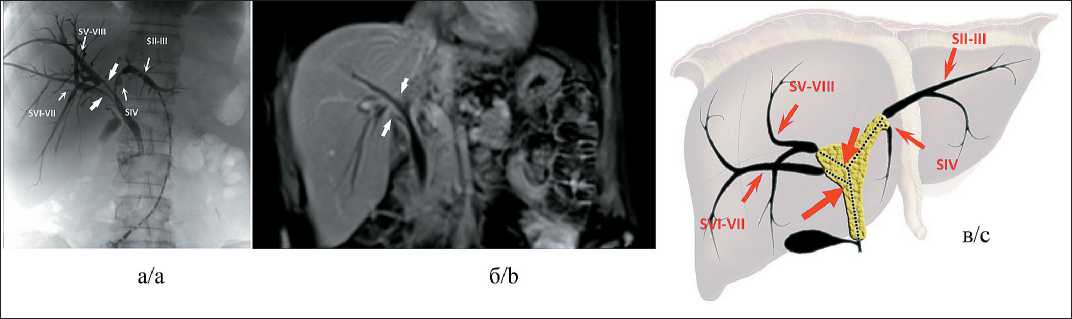
Рис. 6. Распространение опухолевой инфильтрации на секторальные протоки при III типе конфлюенса по Накамура (больной С., 59 лет):
-
а) рентгенконтрастная холангиограмма в прямой проекции; б) Т1-взвешенное МРТ-изображение с подавлением сигнала от жировой ткани после введения МРКС (отсроченная фаза) в коронарной проекции; в) схема распространения опухолевой инфильтрации по билиарному дереву.
Секторальные протоки разобщены (отмечены тонкими стрелками и подписаны SII–III, SIV, SV–VIII и SVI–VII), через передний и задний правые, а также задний левый секторальные протоки установлены холангиостомические дренажи. Правый долевой проток не выражен, правый передний секторальный проток сливается с левым долевым протоком, а правый задний проток впадает в гепатикохоледох ниже, практически над пузырным протоком. Разобщение правых секторальных протоков (толстые стрелки) вызвано не столько опухолевой инфильтрацией, сколько анатомическим вариантом желчного дерева
Fig. 6. Neoplastic growth extension to sectoral bile ducts in the third Nakamura confluence type (patient S., male, 59 y.o.): a) direct cholangiography in frontal projection; b) T1-weighted MR-image fat saturated in coronal projection after MRCA injection (delayed phase);
-
c) scheme of tumor extension along bile ducts. Sectoral ducts are disjointed (marked by thin arrows and annotated SII–III, SIV, SV–VIII and SVI–VII), drainages are set through anterior and posterior right and posterior left sectoral ducts. Right hepatic duct is absent, right anterior sectoral duct and left hepatic duct converge, lower right posterior hepatic duct converges with common hepatic duct right above cystic duct, ducts disjunction (thick arrow) is more due to the anatomical variant of the confluence than tumor infiltration
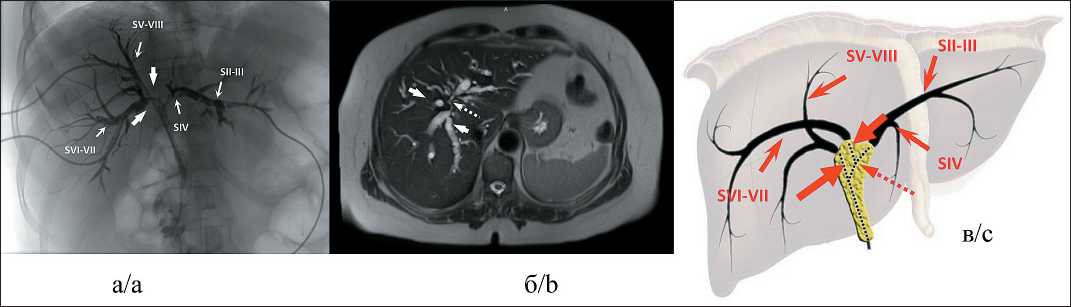
Рис. 7. Распространение опухолевой инфильтрации на секторальные протоки при IV типе конфлюенса по Накамура (больная У., 54 лет):
-
а) рентгенконтрастная холангиограмма в правой косой проекции; б) Т2-взвешенное МРТ-изображение в аксиальной проекции; в) схема распространения опухолевой инфильтрации по билиарному дереву.
Секторальные протоки разобщены (отмечены тонкими стрелками и подписаны SII–III, SIV, SV–VIII и SVI–VII), через передний и задний правые, а также задний левый секторальные протоки установлены холангиостомические дренажи. Правый долевой проток не выражен, правый передний секторальный проток продолжается непосредственно в гепатиколедох, правый задний секторальный проток сливается с левым долевым протоком (пунктирная стрелка), а затем впадают гепатикохоледох. Разобщение правых секторальных протоков (толстые стрелки) вызвано не столько опухолевой инфильтрацией, сколько анатомическим вариантом желчного дерева
Fig. 7. Neoplastic growth extension to sectoral bile ducts in the fourth Nakamura confluence type (patient U., female, 54 y.o.): a) direct cholangiography in right oblique projection; b) T2-weighted MR-image fat saturated in axial projection; c) scheme of tumor extension along bile ducts. Sectoral ducts are disjointed (marked by thin arrows and annotated SII–III, SIV, SV–VIII and SVI–VII), drainages are set through anterior and posterior right and posterior left sectoral ducts. Right hepatic duct is absent, right anterior sectoral duct spills over to common hepatic duct, right posterior hepatic duct and left hepatic duct converge (dashed arrow), and run into common hepatic duct, ducts disjunction (thick arrow) is more due to the anatomical variant of the confluence than tumor infiltration
Сочетание МРТ, включающей в себя МРХПГ, с прямой холангиографией позволило нам определить тип конфлюенса почти у 90 % больных гилюс-ной холангиокарциномой. Нам удалось доказать, что рентгенохирургические впечатления о более высокой частоте встречаемости нетипичных кон-флюенсов при опухоли Клацкина имеют под собой объективные основания. В контрольной группе, представленной преимущественно больными метастатическим поражением печени, распределение типов конфлюенса в целом соответствовало общепопуляционному, известному по опубликованным результатам исследований практически здоровых людей – потенциальных родственных доноров печени [3, 5, 7–9, 22]. В то же время у больных опухолью Клацкина достоверно реже (в 27,6 % наблюдений) встречается наиболее распространенный (75 %) в контрольной группе I тип конфлюенса по Накамура (p<0,0001).
Изначально МРТ с МРХПГ у наших больных выполнялось с сугубо практической целью – для планирования хирургических и интервенционных вмешательств. Сравнительная оценка процентного соотношения типов конфлюенса была осуществлена для проверки гипотезы о высокой распространённости нетипичных форм ветвлений желчного дерева у больных гилюсной холангиокарциномой. Ее подтверждение заставило нас задуматься о причинах, по которым тип конфлюенса может стать предрасполагающим фактором развития заболевания.
Холангиокарцинома возникает из эпителия желчных протоков. Предположим, что удельная (на единицу площади протоковой стенки) вероятность возникновения рака у больного p уд. Тогда вероятность p его возникновения в протоке длиной l и диаметром d в соответствии с формулой площади боковой поверхности цилиндра равна:
р = руд х ivdl
В соответствии с (1) вероятность возникновения рака в области конфлюенса желчных протоков будет расти с увеличением общей площади i протоков, сливающихся в этой области:
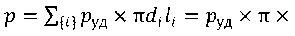
X I X (с/пд + с/лд+с/оп), (2) где d пд – диаметр правого долевого протока, d лд – диаметр левого долевого протока, d оп – диаметр общего печеночного протока; все указанные протоки в настоящей работе рассматриваются на одинаковом расстоянии l , равноудаленном от точки слияния протоков.
Закон Мюррея [23] для ветвлений трубчатых структур в биологических системах формулируется как d3= Wt
где d – диаметр материнской трубки, di – дочерних.
Мюррей, исходя из принципа минимизации энергии, теоретически рассчитал соотношение диаметров материнских и дочерних трубок, однако впоследствии принцип был подтвержден при изучении препаратов реальных биологических систем (прежде всего, сосудов и бронхов человека и животных [24, 25]). В соответствии с (3)
d3 = d 1*011 Ct
3 НД
+ d3
1 ЛД 9
где dоп – диаметр общего печеночного протока, dпд – диаметр правого долевого протока, dлд – диа- метр левого долевого протока, в соответствии с литературными данными [26]
d пд≈ d лд= d д
из чего закономерно вытекает:
c/on = 1,25 x с/д,
подставив в (2), получаем для I типа конфлюенса по Накамура
Pz = руд x л x / x (2 x с/д + 1,25 x d^) =
= 3,25 xp^xnx I .
Аналогично (3–7):
с/д — rfv—VIII + ^vi-vn> (8) где d д – диаметр долевого протока, d VVIII – диаметр правого переднего секторального протока (V–VIII), d VIVII – диаметрправого заднего секторального протока (VI–VII).
Для упрощения принимая d VVIII= d VIVII, имеем:
d3 = 7d3
и,д ^u,ceKT,
где d д – диаметр долевого протока, d сект – диаметр секторального протока, откуда:
Id =^(10)
^сект З/75-)\
^сект 0,8 X d^.(11)
Таким образом, при II типе конфлюенса (2) будет переписано как ри = рУд x n x Z x (dft + 0,8 x 2 x cZa +
+ 1,25 x d^) = 3,85 x da x руд x л.
Таким образом, при трифуркации вероятность возникновения рака увеличивается за счет увеличения числа клеток в области конфлюенса желчных протоков. Еще большее значение получается при III и IV типах. За счет другой точки прикрепления длина одного из секторальных протоков увеличивается на величину a , тогда (2) после подстановки будет иметь вид:
Pin,IV = Рп + 0,8 x dg x руд x я x a . (13)
Результаты вычислений в виде формул (12), (13) в целом соотносятся с полученными соотношениями типов конфлюенса у пациентов, хотя в данном исследовании не удалось достоверно показать увеличение частоты встречаемости опухоли Клацкина при III типе конфлюенса по Накамура, но и оно прослеживается в статистической тенденции.
Отметим, что pi? * °'84 , т.е. разница площадей ответственна примерно за 16 % разницы частот возникновения опухоли при I и II типах конфлюенсов, что представляется хоть и немаловажным, но не достаточным для полного объяснения существенного преобладания II и IV типов, полученного экспериментально: у больных, страдающих опухолью Клацкина, – 22,2 % и 36,0 %, по сравнению с 9,3 % и 14,2 % в контрольной группе соответственно.
Возможно, существует дополнительный фактор патогенеза, действующий в областях разделения протоков. В работах на лабораторных животных показано, что повышение давления в протоках является фактором, существенно увеличивающим вероятность возникновения опухоли при воздействии канцерогенных веществ [27].
Рассмотрим гидродинамическую модель течения желчи по протокам печени и влияние типа ветвления конфлюенса на давление в системе. Воспользуемся допущением: предположим, что по количеству продуцируемой желчи и, стало быть, объемной скорости ее течения печени не отличаются при различных типах конфлюенса, а различаются только трубки, по которым происходит течение желчи. Неньютоновские свойства желчь проявляет при резком изменении давления, например опорожнении желчного пузыря, что может приводить к образованию желчных камней [28]. Во внутрипеченочных желчных протоках резких перепадов обычно не наблюдается, поэтому мы упрощенно будем считать желчь в них ламинарно текущей ньютоновской жидкостью.
Как мы уже знаем из (10),
^сект 3^2 ^,8 ^ ^д, кроме того [29]:
й =^’ (14)
где Q – объемная скорость тока жидкости, Δ P – разность давлений на концах трубки, R – сопротивление трубки. Мы будем рассматривать участок от начала правого долевого протока до впадения в конфлюенс для I типа и два секторальных протока на том же расстоянии от конфлюенса до впадения в него для II типа. Таким образом:
△ ^ ^терм ^конфлюенс? (15)
где P терм – давление в терминальной части долевого протока или в секторальных протоках на том же расстоянии от конфлюенса, P конфлюенс – давление в конфлюенсе. Исходя из (15) с учетом допущений, чем меньше Δ P , тем больше давление в конфлюенсе:
я-^ (16)
где d – диаметр трубки.
Общее сопротивление при параллельном соединении трубок:
где R i – сопротивление i-ой трубки.
Из (10), (16) и (17) имеем
/?и = 1,25 x Ry, (18)
где R I – сопротивление при I типе по Накамура, R II – при II типе.
Выражая Δ P и подставляя в (14), при условии равного Q получаем
/XPy = 1,25 x ДРП, (15)
где Δ P I – разность давлений при I типе по Накамура, Δ P II – при II типе.
Больший перепад давления в печени при I типе по Накамура означает, что в соответствии с (15) давление в области конфлюенса при этом типе впадения желчных протоков по сравнению с типом II меньше. Иными словами, при II типе отмечается увеличение общего сопротивления протоков и последующее уменьшение перепада давления между периферическими протоками и конфлюенсом с увеличением давления в последнем. Это явление может быть дополнительным патогенетическим фактором при возникновении опухолей Клацкина. Для III и IV типа соотношение давлений будет таким же, если принять во внимание, что
a<
Нами были проанализированы лежащие на поверхности причины более частого поражения нетипичных конфлюенсов печеночных протоков, а именно – большая площадь стенок и повышенное внутрипротоковое давление, однако мы не можем исключить существования неочевидных факторов, определяющих склонность к неопластическим процессам и сцепленно наследующихся с отсутствием правого долевого протока. Редкие варианты билиарной анатомии – конечный результат вытеснения неблагоприятного признака в популяции за счет отрицательного давления естественного отбора; вероятнее всего, поэтому мы видим их в большем количестве у пациентов с тяжелой протоковой патологией.
По всей вероятности, наша находка имеет не только академический интерес, но и практи- ческое значение. Группой корейских хирургов-гепатологов недавно было показано, что у больных гилюсной холангиокациномой с формальной визуализационной картиной стадии Bismuth IV при нестандартных конфлюенсах достоверно чаще можно выполнить радикальную резекцию желчных протоков, чем при стандартном типе, – у 39 % пациентов против 14 % (p<0,001) [15]. Поскольку стадия по Bismuth все еще является одним из основных критериев резектабельности, переосмысление ее анатомической обоснованности приведет к изменению тактики лечения у ряда пациентов. В будущем полученные данные, как мы надеемся, можно будет использовать для оценки рисков развития протоковой патологии или каких-либо диагностических целей.
Список литературы Тип конфлюенса желчных протоков: неочевидный предрасполагающий фактор развития гилюсной холангиокарциномы?
- Bismuth H., Corlette M.B. Intrahepatic cholangioenteric anastomosis in carcinoma of the hilus of the liver. Surg Gynecol Obstet. 1975; 140(2): 170-178.
- Klatskin G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis. An unusual tumor with distinctive clinical and pathological features. Am J Med. 1965; 38: 241-256. DOI: 10.1016/0002-9343(65)90178-6
- Deka P., Islam M., Jindal D., Kumar N., Arora A., Negi S.S. Analysis of biliary anatomy according to different classification systems. Indian J Gastroenterol. 2014; 33(1): 23-30. DOI: 10.1007/s12664-013-0371-9
- Hekimoglu K., Ustundag Y., Dusak A., Erdem Z., Karademir B., Aydemir S., Gundogdu S. MRCP vs ERCP in the evaluation of biliary pathologies: Review of current literature. J Dig Dis. 2008; 9(3): 162-169. DOI: 10.1111/j.1751-2980.2008.00339.x
- Huang T.L., Cheng Y.F., Chen C.L., Chen T.Y., Lee T.Y. Variants of the bile ducts: clinical application in the potential donor of living-related hepatic transplantation. Transplant Proc. 1996; 28(3): 1669-1670.


