Токсическое влияние детергентов на мезенхимальные стромальные клетки человека при заселении графтов
Автор: Сергеевичев Давид Сергеевич, Сергеевичева Вера Васильевна, Субботовская Анна Игоревна, Подхватилина Наталья Анатольевна, Васильев Вячеслав Юрьевич, Русакова Янина Леонидовна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Новые научные разработки и технологии
Статья в выпуске: 2 т.17, 2013 года.
Бесплатный доступ
Детергенты - это эффективные агенты для децеллюляризации тканей с целью получения бесклеточных каркасов. Однако при последующем заселении бесклеточного матрикса культурой специализированных клеток токсичность остаточных количеств детергентов препятствует адгезии клеток к матриксу и реализации их функций. Проведена оценка степени влияния остаточных количеств детергентов на мезенхимальные стромальные клетки (МСК) после серии отмывок. Клапаны легочной артерии человека были обработаны тремя способами: 1% раствором додецилсульфата натрия, 1% раствором дезоксихолата натрия и комбинацией этих растворов с редукцией концентрации до 0,5%. После каждой из 8 отмывок были собраны образцы промывного буфера. Были исследованы цитотоксичность и влияние на метаболическую активность МСК остаточных количеств детергентов. Гистологический анализ показал достаточную децеллюляризацию тканей во всех группах. Матриксы отмывали от детергентов путем последовательных инкубаций с 200 мл фосфатного буфера. Концентрации детергентов во всех образцах промывочных растворов переставали быть токсичными только к 4-му циклу отмывки и не влияли на метаболизм и жизнеспособность МСК. Децеллюляризованные фрагменты легочного ствола после 4-8-го цикла отмывки были успешно заселены МСК. Таким образом, немногочисленные последовательные отмывки тканей клапана легочной артерии после децеллюляризации позволяют снизить остаточные количества детергентов до безопасного уровня и провести успешную репопуляцию бесклеточных матриксов с помощью МСК.
Тканевая инженерия, гомографт, децеллюляризация, клеточные технологии, мезенхимальные стромальные клетки
Короткий адрес: https://sciup.org/142140543
IDR: 142140543 | УДК: 616.126.3:611.018
Текст научной статьи Токсическое влияние детергентов на мезенхимальные стромальные клетки человека при заселении графтов
Создание новых технологий и модернизация существующих методов, используемых для создания биосовместимых с организмом человека тканей, является необходимым условием развития современной тканевой инженерии и ее внедрения в клиническую практику [1]. В настоящее время применение детергентов для очистки клапанов сердца от клеточных антигенов донора эффективно и перспективно. Однако известно, что детергенты обладают крайней токсичностью на живые клетки. Наиболее часто для децеллюляризации используют ионные детергенты, додецилсульфат натрия и дезоксихолат натрия, которые приводят к разрушению клеточных и ядерных мембран [2].
Максимальная совместимость биотрансплантата с организмом реципиента может быть достигнута при сочетании процедур децеллюляризации с последующим заселением полученного соединительнотканного каркаса клетками реципиента. Использование для заселения децел-люляризированного каркаса нормальных резидентных клеток реципиента (фибробластов, миофибробластов и зрелых эндотелиальных клеток) позволяет предотвратить развитие донор-специфического иммуновоспалительного ответа. В то же время существует мнение, что использование для этих целей МСК более предпочтительно, так как, помимо собственных регенеративных свойств и полипотентности, они обладают конститутивной иммуносупрессорной активностью [3, 4]. Таким образом, для успешного заселения клапанов необходимо исключить влияние остаточных количеств детергентов на МСК. В настоящей публикации представлены результаты исследований влияния остаточных количеств детергентов на метаболическую активность МСК в культуре и при заселении децеллюляризированного соединительнотканного каркаса клапанов сердца.
Материал и методы
Легочные клапаны сердца (ЛС) (5 образцов) были выделены из трупного мате-
риала с помощью метода прецизионной микродиссекции. Каждый клапан был разделен по ходу кровотока на 3 части, каждая из которых содержала фиброзное кольцо, створку и стенку легочной артерии. Так были сформированы три экспериментальные группы по 5 образцов в каждой. Масса образца составляла 5,6±0,4 г. Децеллюляри-зацию проводили в течение 8 ч следующими растворами: 1% додецилсульфат натрия (SDS; Sigma, США) (группа 1), 1% дезоксихолат натрия (SDC; Sigma, США) (группа 2) и комбинация 0,5% SDS + 0,5% SDC (группа 3) при постоянном перемешивании в объеме 200 мл. После децел-люляризации образцы 8 раз отмывали в 200 мл фосфатного буфера Дюльбекко (ФБД) (Биолот, Россия) сменами по 12 ч при 37 °С и постоянном перемешивании. После каждой отмывки для дальнейшего исследования цитотоксичности и метаболической активности сохраняли образец промывочного раствора (ПБ 1–8). Тензометрические испытания проводили по методике, предложенной М.Б. Васильевой и др. [5]. Гистологические исследования нативных, децеллюляризованных и заселенных образов ЛС проводили с помощью стандартного окрашивания гематоксилином-эозином (Биовитрум, Россия) после фиксации в 10% забуференном формалине.
Мезенхимальные стромальные клетки получали из костного мозга (КМ) здорового донора-волонтера после подписания информированного согласия. Мононукле-арную фракцию клеток КМ получали методом центрифугирования на градиенте плотности с использованием реагента LymphoLyte (Cedarlane, Канада), затем проводили двукратную отмывку клеточной суспензии раствором ФБД. Подсчет количества МНК осуществляли в камере Горяева. Для оценки жизнеспособности полученные клетки окрашивали акридиновым оранжевым и пропидий йодидом с регистрацией результатов на микроскопе Axioskop FL40 (Carl Zeiss, Германия). Жизнеспособность составляла более 95%. Затем клетки высаживали в культуральные флаконы Т-25 в 10 мл среды Mesencult XF (StemCell, Канада) с концентрацией 105 клеток/мл. На третьи сутки культивирования в СО2-инку-баторе в атмосфере 5% углекислоты в культуральных флаконах полностью заменяли среду Mesencult XF.
В дальнейшем каждые 3–4 дня заменяли только половину объема среды. При достижении 80% конфлюэнт-ности производили пассаж клеток, для чего использовали MesenCult-ACF Dissociation Kit (StemCell, Канада). После 2-го пассажа клетки пересаживали во флаконы Т-175, в 40 мл питательной среды DMEM (Sigma, США), содержащей 10% фетальной телячьей сыворотки (StemCell, Канада), 2 мМ L-глутамина и 60 мкг гентамицина (ПС). После 5-го пассажа проводили иммунофенотипирование клеток с помощью проточного цитофлюориметра Navios (Beckman Coulter, США). Исследовали мембранную экспрессию маркеров CD73 (Becton Dickinson, США) и CD14, CD29, CD34, CD44, CD45, CD90, CD105, HLA-DR (Beckman Coulter, США). Пробоподготовку и анализ клеточного материала проводили согласно рекомендациям производителей.
Для цитотоксических исследований и анализа метаболической активности в 24-луночный планшет (Orange Scientific, Бельгия) рассевали по 2 х 10 5 МСК в 500 мкл ПС и инкубировали до достижения 80% конфлюэнт-ности. После этого добавляли 500 мкл ПБ и инкубировали еще 24 ч. В качестве позитивного контроля к питательной среде добавляли ФБД, содержащий 2% Triton X-100, в то время как негативным контролем служил чистый ФБД. Активность лактатдегидрогеназы в супернатанте как маркере клеточной токсичности измеряли с помощью набора реагентов LDH-P (Analyticon Biotechnologies, Германия) на автоматическом биохимическом анализаторе Konelab 60 Prime (Thermo Scientific, США) согласно рекомендациям производителя.
Метаболическую активность МСК определяли с помощью набора реагентов CellTiter 96AQueusOne Solution Cell Proliferation Assay (Promega, Германия). После удаления супернатанта для цитотоксического исследования лунки планшета заполняли 500 мкл свежей ПС и 100 мкл реагента Оуэна. Через 3 ч инкубации колориметрически измеряли продукцию формазана на длине волны 490 нм. Все исследования проводили в триплетах, для обработки данных использовали условные единицы. Децеллюляризованные фрагменты ЛС каждой группы заселяли МСК в концентрации 105 клеток/см2 с добавлением ПС. Культивирование проводили в СО2-инкубаторе в статических условиях в течение 7 суток.
Результаты исследований обрабатывали с помощью программного обеспечения SPSS версии 17.0 (IBM, США). Нормальность распределения выборки проверяли критерием Шапиро – Вилка. В случае подтверждения нормального распределения выборки, описательные статистики представляли в виде среднего ± стандартное отклонение, при непараметрическом распределении – в виде медианы и 25-го и 75-го квартилей. Достоверность различий между группами проверяли критерием Стьюдента для нормальных выборок и критериями Крус-калла – Уоллиса и Манна – Уитни для непараметрических.
Результаты
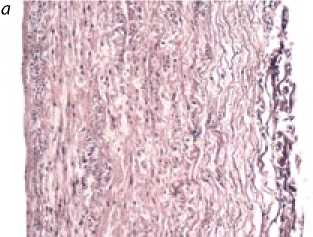
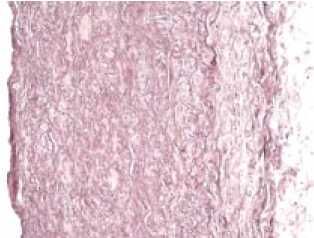
Децеллюляризация. Гистологическая оценка фрагментов ЛС, децеллюляризованных по различным методикам, показала отсутствие любых клеточных элементов во всех группах. Внутренняя эластическая мембрана четко визуализировалась и сохраняла свое строение на всем протяжении. Эластический каркас стенки ЛС сохранял свое строение, в единичных срезах встречалось нарушение его пространственного строения, взаимоориентации волокон. Адвентициальная оболочка местами сохраняла свое типичное строение, местами определялись фрагменты с выраженным разволокнением соединительнотканных структур (рис. 1).
Тензометрические испытания. Данные физико-механического исследования не показали значимых различий
Рис. 1.
Поперечный срез стенки легочного ствола до (а) и после (б) децеллюля-ризации. Окраска гема-токсилином-эозином.
Увеличение х 200.
б
7AAD / SS INT
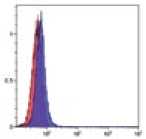
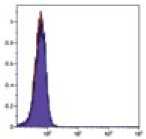
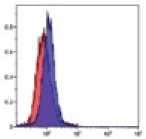
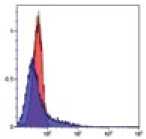
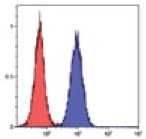
Рис. 2.
Результат иммуно-фенотипирования культивированных МСК после пятого пассажа.

7FAAD
CD14-PC7
CD34-APC
CD45-PB
HLA-DR-PC7
СD29-FITC
11 Ц 11 li
CD44-FITC CD90-FITC CD73-PE CD105-PE механической прочности между нативными и децеллюля-ризованными фрагментами ЛС. Наибольшую прочность сохранили ЛС группы 3, где значения разрушающего напряжения для нативных и децеллюляризованных фрагментов ЛС составили 1,14±0,16 и 0,93±0,11 МПа (р = 0,09).
Получение МСК и иммунофенотипирование. МСК в культуре достигали 80% конфлюэнтности на 3-и – 5-е сутки. Клетки имели характерную веретенообразную, иногда звездчатую форму с большим зернистым ядром. На первых двух пассажах клетки при разрастании на 2-е – 3-и сутки формировали многослойные кластеры, что являлось маркером необходимости пассирования. В дальнейшем клетки достигали монослоя на 4-е сутки.
Анализ культивированных клеток с помощью проточной цитофлюориметрии показал высокий уровень экспрессии характерных [6] «мезенхимальных» маркеров CD29, CD44, CD73, СD90 и CD105 (более 95%). В то время как маркеры гемопоэтических и зрелых клеток крови, CD14, CD34, CD45 и HLA-DR, были негативны или экспрессировались на очень низком уровне (рис. 2).
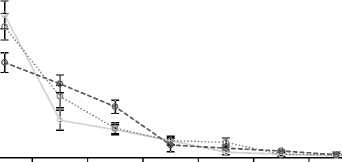
Цитотоксичность и метаболическая активность. Расчет индекса цитотоксического действия различных ПБ на культивированные МСК проводили согласно [7]. Метаболическую активность клеток измеряли в условных единицах. Результаты цитотоксического теста и теста метаболической активности приведены на рис. 3.
Максимальные значения цитотоксичности получены после инкубации клеток с первым ПБ во всех группах. Только после четвертого ПБ значения цитотоксичность во всех группах снизилась менее 10% и в дальнейшем находилась в допустимых значениях после инкубаций с ПБ 5–8 (менее 5%). Следует отметить исходно низкую цитотоксичность ПБ в группе 3.
Метаболическая активность МСК во всех группах после инкубации с первым ПБ была ингибирована. Далее в группе 3 наблюдалось резкое повышение метаболической активности уже во втором ПБ, которое достигало контрольных значений к четвертому ПБ и затем постепенно снижалась. В остальных группах увеличение метаболической активности наблюдалось лишь к четвертому ПБ, после чего различия между группами нивелировались.
Заселение графтов. Фрагменты ЛС из каждой группы после 4-й и 8-й стадий отмывки «заселяли» МСК. После 7 дней культивирования в статических условиях на поверхности всех фрагментов ЛС наблюдали клетки, имевшие тенденцию к формированию монослоя (данные не приведены).
Рис. 3.
Результаты тестов цитотоксичности (а) и метаболической активности МСК (б) после культивирования с ПБ.
а
5 о
01 у 60
К s
Я У 40
S
б
^------1......^____
/1 .......1.............$..........
X

Циклы отмывки
Группа 1 ......О...... Группа 2 —е— Группа 3
Обсуждение
Залогом эффективного и безопасного применения клеточных и биоинженерных технологий в медицине служит стандартизация их выполнения, основанная на научно доказанных и воспроизводимых методах. Целью нашего эксперимента была разработка оптимального протокола децеллюляризации гомографтов, позволяющего получить бесклеточный соединительнотканный клапанный каркас с минимальным остаточным влиянием используемых детергентов на жизнеспособность и метаболическую активность МСК.
Для создания децеллюляризованных тканеинженерных протезов клапанов сердца были использованы SDS, SDC и комбинация этих детергентов, поскольку они известны как эффективные агенты для децеллюляриза-ции тканей сердечно-сосудистой системы [1, 2]. Однако результат биологического воздействия их концентраций и синергичного подавления жизнеспособности и культуральных свойств МСК пока не изучены. Биотехнологические и биоэтические сложности получения достаточного терапевтического количества МСК костного мозга человека диктуют принципы бережного отношения к клеточному материалу, его сохранению и максимальному исключению потерь при процессинге.
Очевидно, что количество отмывок пропорционально снижает степень токсичности остатков детергентов на МСК, однако длительное нахождение клапанного матрикса вне консервирующего раствора снижает его прочностные свойства [8]. Поэтому неоправданно большое число, длительность и объем отмывок способны привести к потере биомеханических свойств и снижению качества графта, что недопустимо.
Нами использован достаточно простой в исполнении и воспроизводимый метод оценки цитотоксичности и метаболической активности клеток, предложенный S. Cebotari и его коллегами [7]. В ходе эксперимента нами показано, что наиболее эффективным методом децеллюляриза-ции является инкубация клапана с комбинацией растворов 0,5% SDS и 0,5% SDC. Инкубация с супернатантами ПБ 1–4 отмывок оказывала токсическое влияние на культуру МСК и негативно влияла на их культуральные свойства. Таким образом, был определен оптимальный протокол, включающий 4 смены ПБ, позволивший, с одной стороны, сократить период нахождения графта вне консервирующей среды, а, с другой, исключить остаточное токсическое воздействие детергентов на клетки, потенциально способные «заселить» и восстановить гомеостаз соединительнотканного каркаса графта. Отсутствие токсичности биологического матрикса было подтверждено его успешным заселением с помощью МСК.
Интересно, что, по данным Е. Rieder с сотрудниками [9], биомактриксы, децеллюляризованные с помощью SDS, оказывали токсическое действие на миофибробласты и эндотелий, использованные для заселения.
Возможно, это связано с неоптимальным протоколом отмывки биологических тканей после детергентного удаления клеточного материала. Тем не менее доказано, что SDS является эффективным агентом для удаления ксеноматериала из тканей перикарда [10]. Нами показано, что только после соблюдения оптимального протокола отмывки полученные бесклеточные биоматриксы пригодны для заселения с помощью МСК.
В то же время следует принимать во внимание, что при заселении бесклеточного клапанного каркаса полипотен- тными клетками существует риск образования нецелевых тканевых структур, таких как хрящ, жир или костные элементы, вероятность которого повышается с увеличением длительности жизни МСК в организме. Последние исследования свидетельствуют о том, что чаще после введения МСК проявляются краткосрочные эффекты, препятствующие деградации клапана и его структур в послеоперационном периоде. В основу нашего исследования также была положена идея, что заселение бесклеточного клапанного каркаса МСК реципиента может способствовать снижению интенсивности периоперационной иммуновоспалительной реакции и формированию иммунологической толерантности к чужеродным тканям. В дальнейшем планируется изучить иммунологическую целесообразность и эффективность подобного метода предимплантационной подготовки клапанов.
Таким образом, нами показано, что наиболее эффективна для децеллюляризации комбинация двух ионных детергентов (0,5% SDS + 0,5% SDC), которая позволяет сохранить биомеханические свойства бесклеточного соединительнотканного клапанного каркаса без потери качества последнего. Оптимальным протоколом удаления детергентов является четырехкратная отмывка графта в 200 мл фосфатного буфера. При меньшем количестве отмывок сохраняется недопустимая цитотоксичность, а при неоправданном увеличении (более 5 раз) снижается метаболическая активность МСК и подавляются культуральные свойства, в частности способность адгезии к биоматериалу при заселении. Стандартизация метода децеллюляризации/ отмывки позволяет достичь эффективного заселения матрикса необходимым клеточным материалом. Определение уровня лактатдегидрогеназы и продукции формазана в MTS-тесте – воспроизводимый метод оценки влияния других токсических агентов на клетки человека и животных, и он может быть использован для контроля качества при создании тканеинженерных биоконструкций.


