Токсичность йессотоксина в эксперименте in vivo
Автор: Багрянцева О.В., Гмошинский И.В., Евстратова А.Д., Трушина Э.Н., Мустафина О.К., Сото Х.С., Шипелин В.А., Шумакова А.А., Панова А.Д., Хотимченко С.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования для оценки риска в гигиене и эпидемиологии
Статья в выпуске: 3 (23), 2018 года.
Бесплатный доступ
Йессотоксин (YTX) является полиэфиром. Известно более 90 производных йессотоксина. YTX исключен из группы диарейных токсинов, потому что, в отличие от окадаиковой кислоты, не вызывает диарею. Химическая структура YTX аналогична таковой бреветоксинов и сигаутоксинов, которые оказывают действие на работу кальций-натриевого насоса и трансмембранных ионных каналов. Следовательно, YTX способен оказывать влияние на работу всех органов и систем организма. Известно, что YTX является промотором апоптоза в ткани головного мозга. Среднелетальная доза ЛД50YTX и его аналогов в различных экспериментах, проведенных на мышах, составила от 100 до 500-750 мкг/кг. Безопасный уровень острого воздействия YTX (ARfD) составляет 25 μM/кг массы тела. В настоящее время установлены показатели токсичности для YTX и некоторых его аналогов, определены основные механизмы его действия, роль в качестве промотора апоптоза. Несмотря на растущее число данных о биологических эффектах, оказываемых YTX на теплокровный организм, точный механизм его действия в настоящее время неизвестен...
Йессотоксин, механизмы действия, биомаркеры, токсичность, оценка риска, допустимый уровень
Короткий адрес: https://sciup.org/142215894
IDR: 142215894 | УДК: 616-092.9: | DOI: 10.21668/health.risk/2018.3.12
Текст научной статьи Токсичность йессотоксина в эксперименте in vivo
Йессотоксин (YTX) является полиэфиром, состоящим из 11 смежных эфирных колец, ненасыщенной боковой цепи и двух эфиров сульфата. Известно более 90 производных йессотоксина. Впервые выделен в 1986 г. в Японии из гребешков Patinopecten yessoensis . YTX продуцируется водорослями – динофлагеллятами Protoceratium reticu-latum и Gonyaulax spinifera . YTX исключен из группы диарейных токсинов (окадаиковая кислота и ее аналоги – DSP-токсины), потому что, в отличие от окадаиковой кислоты, не вызывает диареи. Однако YTX и его аналоги часто экстрагируются вместе с диарейными токсинами и дают положительные результаты в биологических тестах, проводимых на наличие диарейного яда моллюсков [1].
Химическая структура YTX аналогична таковой структуре бреветоксинов и сигаутоксинов, которые оказывают действие на работу кальций-натриевого насоса и трансмембранных ионных каналов. Механизм, приводящий к активации фософодиэстеразы с помощью йессотоксина, включает начальное увеличение кальция в цитозоле клетки, доступного для каль-цийзависимой фосфодиэстеразы I типа, с последующим снижением внутриклеточной концентрации циклического аденозинмонофосфата [2, 3].
YTX способствует активности каспаз 3 и 7 в HeLa-клетках. Он снижает порог проницаемости митохондриальных мембран в печени крыс; вызывает нарушение цитоскелета культуры клеток нейронов мозжечка и далее их апоптоз; способствует нарушению межклеточной адгезии, что, в свою очередь, может стать одной из возможных причин развития болезни Альцгеймера [4–7]; влияет на иммунную систему, способствуя повышению количества цитокинов, за счет повышения экспрессии кодирующих их генов [8]. YTX индуцирует митотическую катастрофу и генетические изменения, которые могут представлять интерес для контроля прогрессирования опухолевого процесса [9].
Среднелетальная доза ЛД50 YTX и его аналогов в различных экспериментах, проведенных на мышах, составила от 100 до 500–750 мкг/кг [6]. На наш взгляд, разница значений токсичности для различных видов йессотоксинов зависит от особенностей их химической структуры. Безопасный уровень острого воздействия YTX (ARfD) составляет 25 μM/кг массы тела. Данные о токсичности YTX для других видов животных практически отсутствуют [3, 6, 10]. Постановлением Европейского союза № 853/2004 в 2004 г. был установлен регламент безопасного содержания йессотоксинов в моллю- сках – 1 мг/кг [11]. Вместе с тем результаты проводимых анализов содержания йессотоксинов в мясе моллюсков показали, что ни в одном из исследованных образцов содержание йессотоксинов не превысило 3,75 мг эквивалентов йессотоксинов/кг мяса моллюсков [6]. На этом основании был установлен новый максимально допустимый уровень содержания йессотоксинов в моллюсках – 3,75 мг/кг [12].
Таким образом, в настоящее время установлены показатели токсичности для YTX и некоторых его аналогов, определены основные молекулы-мишени его действия, его роль в качестве промотора апоптоза, выявлен максимально допустимый уровень йессо-токсинов в моллюсках. Однако, несмотря на растущее число данных о биологических эффектах, оказываемых YTX на теплокровный организм, точный механизм его действия до сих пор неизвестен.
Целью настоящей работы явилось исследование токсичности YTX в экспериментах in vivo в дозировках ниже установленного безопасного уровня острого воздействия.
Материалы и методы. Эксперимент проведен на 72 крысах-самцах линии Wistar с исходной массой тела 100 ± 10 г. Крысы получены из питомника филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий» ФМБА России. Животные получали сухой сбалансированный корм производства фирмы ООО «Лабораторкорм» (Россия) в режиме неограниченного доступа. Крыс размещали по 2–3 особи в клетках из поликарбоната при 12/12-часовом режиме освещенности и температуре 21 ± 1 ° С. Все крысы были разделены методом случайной выборки на 12 групп численностью по 6 особей; исходная масса тела в группах не различалась ( p >0,1 ANOVA). Работу с животным проводили в соответствии с российскими требованиями к надлежащей лабораторной практике1.
В работе использовали препарат YTX производства фирмы National Research Council Canada (Канада) в виде метанольного раствора (содержание YTX 4,3 ц моль). Непосредственно перед проведением исследований метанол удаляли из препарата методом вакуумного выпаривания при температуре не выше +20 ° С в течение не более 4 часов. Сухой остаток перерастворяли в 96 % растворе этилового спирта по ГОСТ 5962–20132. Для получения рабочих разведений токсина аликвоты спиртового раствора YTX разбавляли стерильным апирогенным раствором 0,15 М NaCl с получением растворов концентрацией 2 μM/кг (группы № 2, 6, 10), 8 μM/кг (группы № 3, 7, 11) и 12 μM/кг (группы № 4, 8, 12),
1 моль YTX = 1187,32 г. Все испытуемые дозы – ниже установленного значения безопасного уровня острого воздействия YTX (ARfD) – 25 μM/кг массы тела.
Растворы, содержащие YTX, вводили крысам указанных групп однократно в дозах 1 мл/кг массы тела внутрибрюшинно. Животным контрольных групп (№ 1, 5, 9) вводили в том же количестве физиологический раствор.
Выведение животных из эксперимента осуществляли через 6 (группы № 1–4), 24 (группы № 5–8) и 168 (группы № 9–12) часов после введения препаратов окадаиковой кислоты путем декапитации под эфирной анестезией. Собирали кровь с антикоагулянтом (трикалиевая соль ЭДТА), отбирали образцы ткани мозга для определения апоптоза и содержания малонового диальдегида, глутатиона в печени крыс. Массу внутренних органов (печень, почки, селезенка, легкие, сердце, тимус, надпочечники, гонады, мозг) определяли на электронных весах с погрешностью ± 0,01 г.
Биохимические показатели сыворотки выявляли на биохимическом анализаторе Konelab 20i (Финляндия). Уровень содержания малонового диальдегида в мозге определяли оптическим методом с 2-тиобарбитуровой кислотой и измерением уровня хромогена с максимумом поглощения в красной области видимого спектра при длине волны 532 нм [13]. Содержание восстановленного глутатиона в печени крыс определяли спектрофотометрическим методом согласно [14].
Гематологические показатели определяли в цельной крови стандартными методами на гематологическом анализаторе Coulter AC TTM 5 diff OV (Beckman Coulter, США) с набором реагентов (Beckman Coulter, Франция). Апоптоз клеток мозга изучали на проточном цитофлуориметре FC 500 (Beckman Coulter International S.A., Австрия) с использованием технологии окрашивания нейронов головного мозга в суспензии флуоресцентными реагентами FITC-аннексином V и 7-аминоактиномици-ном (7-AAD) [15].
Статистическую обработку результатов проводили путем определения выборочного среднего, стандартной ошибки, вероятности принятия нуль-гипотезы о совпадении распределений сравниваемых выборок согласно критерию Стьюдента, Манна–Уитни и ANOVA. Различия признавали достоверными при уровне значимости р <0,05.
Результаты и их обсуждение. Введение YTX во всех указанных дозировках не вызвало признаков заболеваемости животных во всех опытных группах. Достоверного изменения массы тела животных, гонад, надпочечников, мозга не наблюдалось. Выявлено достоверное ( p <0,05) снижение массы селезенки, легких, тимуса (в % от массы тела) на протяжении всего времени проведения эксперимента. Наблюдалась тенденция к снижению массы сердца, почек и печени (рис. 1).
Определение гематологических показателей после введения YTX через 168 часов выявило снижение содержания лимфоцитов ( p <0,05) и тенденцию увеличения количества нейтрофилов в сыворотке крови подопытных животных. Выявлено, что введение токсина во всех испытываемых дозировках вызывало повышение содержания лейкоцитов на протяжении всего времени проведения эксперимента, что доказывается различием в полученных значениях для большинства экспериментальных групп с группой контроля ( р <0,05) (табл. 1).
Несмотря на то что изменения параметров состава крови не носили выраженного дозозависимого характера, полученные данные свидетельствуют о возможном негативном воздействии YET при его внутрибрюшинном введении в количествах, которые, согласно имеющимся сообщениям, не оказывают токсического воздействия на подопытных животных.
Уровень содержания мочевины в сыворотке крови при введении всех исследуемых доз снижался немонотонно, по сравнению с контрольными группами, на протяжении всего времени эксперимента. После 6 часов введения токсина наблюдалось повышение содержание креатинина, а после 168 часов – снижение этого показателя. Выявлена тенденция к снижению содержания общего белка во всех экспериментальных группах и аланинаминотрансферазы (АЛТ) в плазме крови у крыс после 6 и 24 часов введения токсина. Полученные данные указывают на влияние YET на обмен белков, преобладание катаболических процессов в организме теплокровных животных, индуцируемых токсином (табл. 2).
Через 6 и 24 часа часов после введения YTX наблюдалась тенденция к снижению содержания триглицеридов и достоверное повышение холестерина в сыворотке крови (табл. 2). Такая динамика свидетельствует о влиянии YTX на обмен липидов и возможную индукцию воспалительного процесса под воздействием токсина, что подтверждает имеющиеся данные о механизме действия YTX [5, 6].
Впервые выявлено достоверное ( p <0,05) дозозависимое увеличение содержания малонового диальдегида (МДА) в ткани мозга через 168 часов после введения YTX (рис. 2) и тенденция к увеличению содержания восстановленного глутатиона в тканях печени (рис. 3). Кроме того, показано достоверное ( p <0,1) дозозависимое увеличение количества нейронов головного мозга с ранним аппоптозом (с 2,3 % при введении 2 µ М/кг до 3,02 % клеток при введении 12 µ М/кг; контроль – 1,78 % от общего количества клеток) и снижение активности позднего апоптоза (с 0,367 % при введении 2 µ М/кг до 0,180 % клеток при введении 12 µ М/кг; контроль – 0,45 % от общего количества клеток), фиксируемое в течение всего периода наблюдений за животными (рис. 4).
Полученные сведения дополняют имеющиеся данные литературы, свидетельствующие о том, что YTX является индуктором процессов катаболизма,
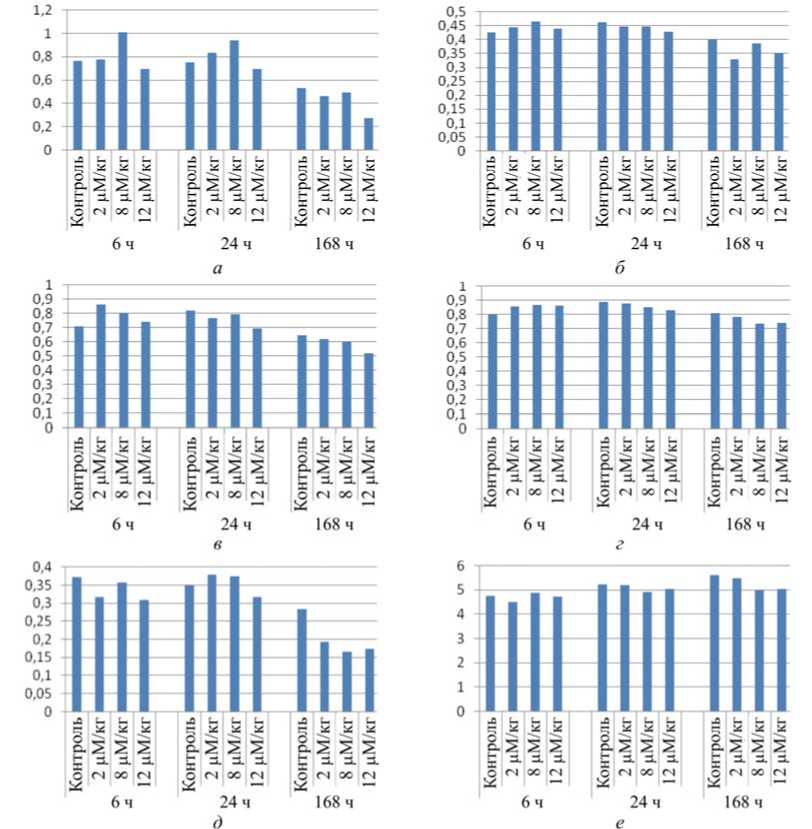
Рис. 1. Динамика изменения массы внутренних органов (в % от массы тела крыс). Ось абсцисс – доза и время введения YTX; ось ординат – вес органа в % от массы тела крыс. Число животных в каждой группе – 6: а – селезенка; б – сердце; в – легкие; г – почки; д – тимус; е – печень
Таблица 1
Гематологические показатели (эритроциты, лейкоциты), М ± m, крыс через 6, 24 и 148 ч после введения YTX (по 6 животных в каждой группе)
|
Группа |
Доза YTX, мкг/кг ( µ М/кг) |
Время после введения токсина, ч |
Среднее содержание Hb в эритроците, пг |
Средняя концентрация Hb в эритроците, г/л |
Лейкоциты, 10 9 /л |
Нейтрофилы, % |
Лимфоциты, % |
Моноциты, % |
|
1 |
Контроль |
6 |
20,2 ± 0,4 |
326,5 ± 1,3 |
8,9 ± 1,0 |
24,1 ± 2,3 |
61,8 ± 2,8 |
12,6 ± 1,6 |
|
2 |
2 |
20,4 ± 1,3 |
326,3 ± 1,8 |
14,0 ± 3,2 |
25,8 ± 3 |
63,7 ± 3,0 |
9,2 ± 0,8 |
|
|
3 |
8 |
21,0 ± 0,5 |
322,0 ± 3,4 |
10,0 ± 2,6 |
19,9 ± 2,8 |
65,8 ± 3,4 |
11,9 ± 0,6 |
|
|
4 |
12 |
19,5 ± 0,4* |
321,6 ± 2,8 |
10,7 ± 1,5* |
25,2 ± 1,8 |
62,6 ± 2,5 |
10,9 ± 0,8* |
|
|
5 |
Контроль |
24 |
19,7 ± 0,3 |
325,3 ± 2,4 |
11,2 ± 1,5 |
23,5 ± 3,0 |
60,8 ± 2,6 |
12,6 ± 1,3 |
|
6 |
2 |
20,7 ± 0,3 |
324,2 ± 3,6 |
13,9 ± 3,6* |
26,8 ± 4,6 |
60,4 ± 6,1 |
11,7 ± 1,7 |
|
|
7 |
8 |
20,8 ± 0,7 |
323,8 ± 3,1 |
13,3 ± 2,7* |
26,3 ± 4,6 |
61,6 ± 4,5 |
11,6 ± 0,7 |
|
|
8 |
12 |
20,3 ± 0,3 |
326,0 ± 3,7 |
10,5 ± 1,1 |
23,9 ± 3,0 |
62,6 ± 3,2 |
12,0 ± 1,3 |
|
|
9 |
Контроль |
168 |
19,5 ± 0,2 |
330,5 ± 3,6 |
8,4 ± 0,8 |
27,2 ± 2,3 |
57,6 ± 2,3** |
13,0 ± 1,9 |
|
10 |
2 |
19,7 ± 0,3 |
331,8 ± 2,0 |
10,3 ± 1,3* |
35,6 ± 2,6* |
50,7 ± 2,4** |
11,9 ± 1,2 |
|
|
11 |
8 |
20,1 ± 0,3 |
328,8 ± 2,7 |
13,7 ± 1,9* |
29,3 ± 4,7 |
59,2 ± 4,9** |
10,0 ± 1,4 |
|
|
12 |
12 |
19,4 ± 0,3 |
329,8 ± 2,2 |
6,4 ± 0,8 |
29,4 ± 2,1 |
54,8 ± 1,0** |
13,8 ± 1,9 |
П р и м е ч а н и е : * – различие с группой контроля для данного времени достоверно, p <0,05, Т -тест Стьюдента и/или критерий Манна–Уитни;
** – различие между группами (6 и 168 ч после введения YET) для данного критерия достоверно, p <0,05, Т- тест Стьюдента и/или критерий Манна–Уитни.
Таблица 2
Биохимические показатели плазмы крови крыс, М ± m , через 6, 24 и 168 ч после введения YTX (по 6 животных в каждой группе)
|
Группа |
Доза YTX, мкг/кг ( µ М/кг) |
Время после введения токсина, ч |
Холестерин, ммоль/л |
Триглицериды, ммоль/л |
АЛТ, ед/мл |
АСТ, ед/мл |
Белок общ, г/л |
Креатинин, мкмоль/л |
Мочевина ммоль/л |
Мочевая к-та, мкмоль/л |
|
1 |
Контроль |
6 |
1,29 ± 0,20 |
1,01 ± 0,21 |
103,26 ± 11,25 |
184,94 ± 19,49 |
62,59 ± 2,93 |
36,15 ± 0,85 |
9,93 ± 0,87 |
213,05 ± 13,48 |
|
2 |
2 |
2,29 ± 0,07* |
1,08 ± 0,10 |
146,42 ± 14,96* |
113,64 ± 41,35 |
58,58 ± 0,99 |
44,91 ± 1,24* |
6,28 ± 0,16* |
222,70 ± 21,37 |
|
|
3 |
8 |
2,22 ± 0,08* |
0,87 ± 0,10 |
153,35 ± 15,92* |
152,75 ± 59,19 |
56,87 ± 1,32* |
43,20 ± 3,55* |
5,66 ± 0,75* |
243,48 ± 24,27 |
|
|
4 |
12 |
1,96 ± 0,25* |
0,74 ± 0,11* |
140,95 ± 7,39* |
160,16 ± 42,13 |
59,54 ± 1,48 |
40,25 ± 0,75* |
5,95 ± 0,49* |
215,21 ± 29,85 |
|
|
5 |
Контроль |
24 |
1,41 + 0,16 |
1,01 ± 0,25 |
101,29 ± 9,04 |
182,80 ± 36,41 |
62,25 ± 3,78 |
37,66 ± 0,95 |
10,10 ± 1,25 |
195,11 ± 27,61 |
|
6 |
2 |
2,08 ± 0,15* |
0,76 ± 0,08* |
137,97 ± 16,01* |
300,23 ± 30,72 |
57,53 ± 1,20* |
36,36 ± 0,60 |
5,82 ± 0,17* |
108,47 ± 11,51 |
|
|
7 |
8 |
1,99 ± 0,11* |
0,89 ± 0,08 |
104,11 ± 7,05 |
240,16 ± 36,03 |
54,97 ± 1,54* |
37,76 ± 0,26 |
7,73 ± 0,30* |
171,84 ± 22,86 |
|
|
8 |
12 |
2,00 ± 0,17* |
0,81 ± 0,07 |
146,54 ± 19,2* |
203,70 ± 44,27 |
58,91 ± 1,16 |
40,65 ± 1,44* |
7,79 ± 0,31* |
191,54 ± 35,40 |
|
|
9 |
Контроль |
168 |
1,94 ± 0,19 |
0,79 ± 0,13 |
106,56 ± 12,33 |
280,39 ± 16,19 |
63,72 ± 3,92 |
42,35 ± 1,72 |
9,66 ± 0,51 |
183,68 ± 9,71 |
|
10 |
2 |
1,83 ± 0,09 |
0,71 ± 0,05 |
91,49 ± 8,58 |
206,67 ± 23,28 |
55,38 ± 0,97* |
34,40 ± 1,39* |
7,69 ± 0,59* |
174,08 ± 27,71 |
|
|
11 |
8 |
2,30 ± 0,14* |
0,82 ± 0,04 |
116,87 ± 14,46 |
187,33 ± 48,06 |
59,25 ± 3,04 |
35,32 ± 2,05* |
7,26 ± 0,55* |
167,79 ± 53,90 |
|
|
12 |
12 |
1,21 ± 0,04 |
1,24 ± 0,04 |
110,77 ± 8,21 |
86,57 ± 29,44 |
59,76 ± 1,79 |
36,76 ± 0,71* |
9,81 ± 0,62 |
198,33 ± 24,56 |
П р и м е ч а н и е : * – различие с группой контроля для данного времени достоверно, p <0,05, Т -тест Стьюдента и/или критерий Манна–Уитни.
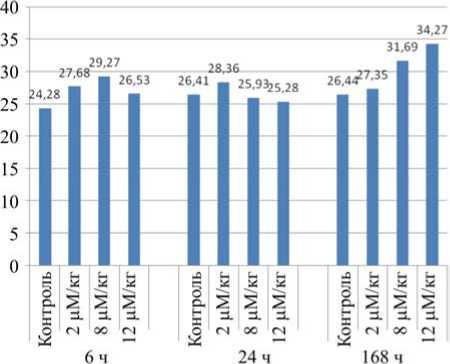
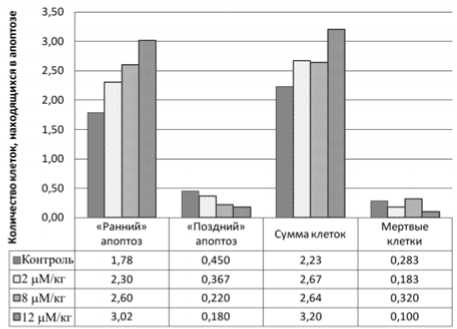
Рис. 4. Показатели апоптоза в ткани мозга (в % от общего количества нейронов в поле зрения) при введении YTX. Полученные значения количества клеток при «раннем» и «позднем» апоптозе достоверны и имеют разнонаправленный дозозависимый характер ( p <0,1)
Рис. 2. Содержание МДА в ткани мозга. Ось абсцисс – доза YTX; ось ординат – концентрация МДА в мозге, нмоль/г ткани. Число животных в каждой группе – 6
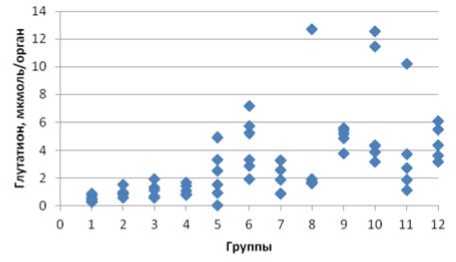
Рис. 3. Содержание восстановленного
глутатиона в печени крыс
выражающихся в активации свободнорадикального окисления и апотоза клеток головного мозга [3, 6, 10]. Впервые показано, что дозы YTX 2; 8 и 12 μM/кг могут оказывать токсическое воздействие на теплокровный организм.
Все испытуемые дозы ниже установленного значения безопасного уровня острого воздействия YTX ( ARfD = 25 μM/кг массы тела). Доза 2μM/кг соответствует допустимому уровню содержания токсина в моллюсках – 2,37 мг/кг. Полученные данные, а также данные, опубликованные в научной литературе о возможном токсическом действии YTX в дозах ниже ARfD , свидетельствуют о необоснованности увеличения максимально допустимого уровня содержания йессотоксинов в моллюсках с 1,0 до 3,75 мг/кг.
Выводы. Проведенные исследования показали наличие токсических эффектов йессотоксина при его внутрибрюшинном введении на протяжении всего времени проведения эксперимента при всех дозах – 2; 8 и 12 μM/кг. Все испытуемые дозы ниже установленного значения безопасного уровня
острого воздействия YTX (ARfD), равного 25 μM/кг массы тела. Данное действие проявлялось:
– в достоверном снижение массы селезенки, легких, тимуса (в % от массы тела) на протяжении всего времени проведения эксперимента, тенденции к снижению массы сердца, почек и печени;
– в усилении процессов катаболизма белков (снижение содержания белка, повышение количества креатинина, мочевой кислоты и АЛТ в плазме крови) и липидов (тенденция к снижению содержания триглицеридов и достоверное повышение холестерина в плазме крови) во всех экспериментальных группах;
– в усилении свободнорадикального окисления в головном мозге, выражающееся в дозозависимом росте показателей содержания малоново-
го диальдегида через 168 часов после введения токсина;
– в усилении процессов раннего апоптоза и снижении показателей позднего апоптоза в тканях головного мозга.
Полученные данные свидетельствуют о необходимости проведения дополнительных оценок рисков увеличения максимально допустимого уровня содержания йессотоксинов в моллюсках с 1,0 до 3,75 мг/кг.
Финансирование. Работа проведена за счет средств субсидии на выполнение государственного задания в рамках программы фундаментальных научных исследований (тема ФАНО России № 0529-2014-0044).
Список литературы Токсичность йессотоксина в эксперименте in vivo
- Yessotoxins, a Group of Marine Polyether Toxins: an Overview/В. Paz, А.Н. Daranas, М. Norte, P. Riobó, J.M. Franco, J.J. Fernández//Mar. Drugs. -2008. -Vol. 6. -P. 73-102 DOI: 10.3390/md20080005
- Yessotoxin, a novel phycotoxin, activates phosphodiesterase activity. Effect of yessotoxin on cAMP levels in human lymphocytes/A. Alfonso, L. de la Rosa, M.R. Vieytes, T. Yasumoto, L.M. Botana//Biochem. Pharmacol. -2003. -Vol. 65, № 2. -P. 193-208.
- Report of the Joint FAO/IOC/WHO ad hoc Expert Consultation on Biotoxins in Bivalve Molluscs. Oslo, Norway, 26-30 September 2004. Short Summary . -UNESCO, 2005. -8 p. -URL: http://unesdoc.unesco.org/images/0013/001394/139421e.pdf (дата обращения: 16.04.2018).
- Malagoli D., Ottaviani E. Yessotoxin affects fMLP-induced cell shape changes in Mytilus galloprovincialis immunocytes//Cell. Biol. Int. -2004. -Vol. 28, № 1. -P. 57-61.
- Alfonso A., Vieytes M.R., Botana L.M. Yessotoxin, a Promising Therapeutic Tool//Mar. Drugs. -2016. -Vol. 14. -P. 30 DOI: 10.3390/md14020030
- Marine biotoxins in shellfish -Yessotoxin group. Scientific Opinion of the Panel on Contaminants in the Food chain (Question No EFSA-Q-2006-065D) //The EFSA Journal. -2008. -Vol. 907. -P. 1-62. -URL: http://www.efsa.europa.eu/sites/default/files/scientific_output/files/main_documents/907.pdf (дата обращения: 16.04.2018).
- Franchini A., Malagoli D., Ottaviani E. Targets and Effects of Yessotoxin, Okadaic Acid and Palytoxin: A Differential Review//Mar. Drugs. -2010. -Vol. 8. -P. 658-677 DOI: 10.3390/md8030658
- Korsnes M.S Apoptotic events by yessotoxin in myoblast cell lines from rat and mouse//Toxicol. in vitro. -2006. -Vol. 20. -P. 1077-1087.
- Korsnes M.S., Korsnes R. Mitotic Catastrophe in BC3H1 Cells following Yessotoxin Exposure//Front. Cell. Dev. Biol. -2017. -Vol. 5, № 30. -18 p DOI: 10.3389/fcell.2017.00030
- Marine biotoxins. Food and Nutrition Paper (80). -Rome: Food and agriculture organization of the united nations, 2004. -287 p.
- Regulation (EC) No 853/2004 of the European Parliament and of the Council of 29 April 2004 //Official Journal of the European Union. -2004. -URL: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ: L: 2004: 139: 0055: 0205: EN: PDF (дата обращения: 16.04.2018).
- Commission Regulation (EU) No 786/2013 of 16 August 2013 amending Annex III to Regulation (EC) No 853/2004 of the European Parliament and of the Council as regards the permitted limits of yessotoxins in live bivalve mollusks //Official Journal of the European Union. -2013. -URL: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ: L: 2013: 220: 0014: 0014: EN: PDF (дата обращения: 16.04.2018).
- Ohkawa H., Ohishi N., Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction//Anal. Biochem. -1979. -Vol. 95, № 2. -P. 351-358.
- Разыграев А.В. Метод определения глутатионпероксидазной активности с использованием пероксида водорода и 5,5'-дитиобис (2-нитробензойной кислоты)//Клинико-лабораторный консилиум. -2004. -№ 4. -С. 19-22.
- Биодоступность наночастиц оксида железа при использовании их в питании. Результаты экспериментов на крысах/Р.В. Распопов, Э.Н. Трушина, И.В. Гмошинский, С.А. Хотимченко//Вопросы питания. -2011. -Т. 80, № 3.-С. 25-30.


