Токсиколого-гигиеническая оценка безопасности водной суспензии нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования
Автор: Зайцева Н.В., Землянова М.А., Звездин В.Н., Саенко Е.В.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования
Статья в выпуске: 1 (1), 2013 года.
Бесплатный доступ
В результате экспериментального исследования водной суспензии нанодисперсного диоксида кремния, синтезированного методом темплатирования, при однократном внутрижелудочном зондовом введении установлен 3-й класс опасности тестируемого продукта по критерию ЛД 50. Выявлен комплекс морфологических изменений в наименьшей исследованной дозе 500 мг/кг в виде выраженных изменений системы кровообращения, проявляющихся значительным расширением и полнокровием крупных венозных сосудов печени, почек, тимуса. Обнаружены активация пролиферативных процессов в лимфоидной и макрофагальной системах, развитие дегенеративных изменений в печени, почках, красной пульпе селезёнки, легких. При введении микродисперсного аналога таким же способом гибели экспериментальных животных не установлено (4-й класс опасности). В дозе 500 мг/кг выявлен комплекс морфологических изменений в виде умеренных сосудистых модификаций в почках, сердце, головном мозге, в печени; незначительных пролиферативных изменений в печени, пролиферативная реакция лимфоидной ткани, лимфоидная инфильтрация в ткани пищевода, желудка, печени, почках, в толстой кишке.
Водная суспензия нанодисперсного диоксида кремния, потенциальная опасность, токсиколого-гигиеническая оценка, здоровье населения
Короткий адрес: https://sciup.org/14238029
IDR: 14238029 | УДК: 615.9,
Текст научной статьи Токсиколого-гигиеническая оценка безопасности водной суспензии нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования
В соответствии с мировыми тенденциями развития рынка высоких технологий формирование национальной наноиндустрии, обозначенное Программой развития наноиндустрии в Российской Федерации до 2015 г., как важнейшее приоритетное стратегическое направление определяет новые подходы к преобразованию оте- чественной промышленности. Рынок нанопродукции в России к 2016 г. должен вырасти более чем в 10 раз по сравнению с 2011 г. – до 900 млрд рублей, что повысит конкурентоспособность отечественной продукции [1].
Интенсивное формирование нанокластеров за рубежом и в Российской Федера-
ции, развитие сегментов мирового рынка нанопродуктов в разрезе группы «Наноматериалы», рост коммерческих применений в ключевых отраслях – в медицине, биотехнологиях, энергетике, электронике и информационных технологиях, обрабатывающей промышленности, в потребительском секторе [2] – диктуют необходимость системного развития работ по изучению потенциальных угроз в сфере жизнедеятельности человека, связанных с широкомасштабным развитием и распространением нанотехнологий и нанобиотехнологий.
На сегодняшний день для научного мирового сообщества проблемы нанотоксикологии и биобезопасности используемых наноматериалов выходят на одно из первых мест по значимости и, соответственно, по числу работ в этой области. В рамках исследования взаимодействия наноструктур с биологическими системами особое внимание уделяется выявлению связи между физическими и химическими свойствами наноматериалов (такими как размер, форма, структура поверхности, состав и степень агрегации, растворимость) с индукцией токсического ответа в биологических структурах [3–6]. Данное направление развивается в ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения», в рамках которого выполняется токсиколого-гигиеническая оценка безопасности синтезируемых наноматериалов [7].
В перечень синтезируемых наноматериалов входят аморфные мезопористые нанодисперсные частицы диоксида кремния. В перспективе высока вероятность их использования в качестве активной субстанции, осуществляющей адресную доставку в организме человека лекарственных препаратов нового поколения [8]. Ожидаемые объемы получения и использования данного продукта могут составлять до 1000 т в год, что оценивается как массово выпускаемый продукт [9]. При этом возможно прямое экспонирование персонала, участвующего в процессе производства (ингаляционное поступление), и населения, являю- щегося потребителями данной продукции (пероральное применение лекарственных форм). Также возможно использование мезо-пористых нанодисперсных частиц диоксида кремния в качестве биосенсоров, контрастирующих агентов для магнитно-резонансной томографии в медицине [10]. Ожидаемый объем получения и использования в этих целях данного продукта может составлять до 1 т в год, экспонируемая категория населения – персонал в лабораторных масштабах.
Предварительная оценка потенциальной опасности нанодисперсного диоксида кремния для здоровья человека, выполненная на основании аналитического обобщения комплекса физико-химических, молекулярно-биологических, биохимических, цитологических, экологических характеристик по результатам собственных исследований и данных аннотируемой литературы, свидетельствует о средней степени опасности по критерию «частной» опасности ( D ). Значение D составило 1,75, что соответствует диапазону 1,111–1,779, оцениваемому как «средняя степень потенциальной опасности» [9], и требует дальнейших токсиколого-гигиенических исследований.
Цель настоящей работы – экспериментальное исследование и оценка токсичности и морфологических особенностей тканей внутренних органов и систем при воздействии нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования.
Материалы и методы. В экспериментальных исследованиях изучена водная суспензия нанодисперсного диоксида кремния (SiO2 x 0,14H2O), полученная стандартным способом синтеза наноструктур – методом жидкокристаллического темплатирования с использованием в качестве структурообразующего агента (темплата) поверхностноактивного вещества (ПАВ) – цетилтриметиламмония бромида (C16H33(CH3)3NBr, ЦТАБ) [11, 12]. Синтез осуществлен в лаборатории многофазных дисперсных систем Института технической химии Уральского отделения РАН. Использование мицелл поверхностноактивного вещества предотвращало рост частиц и позволило синтезировать стабилизированные частицы определенных размеров, коррелирующих с размерами мицелл [13]. ЦТАБ удаляли многократной экстракцией этанолом в подкисленной среде (с помощью соляной кислоты), степень экстракции составила не менее 98 %. Остаточную концентрацию ЦТАБ в нанодисперсном растворе диоксида кремния определяли на жидкокристаллическом хроматографе с тандемным масс-спектрометрическим детектором Agilent 6460 (США). Для сравнительного анализа параметров токсичности и морфологических особенностей тканей внутренних органов и систем в остром эксперименте синтезирован водный микродисперсный раствор диоксида кремния (SiO2 х 0,08H2O) по методу Штобера [14].
Оценку размера и формы нано- и мик-родисперсных частиц вещества в водной суспензии выполняли методом динамического светорассеяния на анализаторе Horiba LB-550 (Horiba, Япония) и на лазерном анализаторе Microtrac S3500 (Microtrac, США). Удельную площадь поверхности ( S BET ) частиц определяли методом Брунауэра, Эммета и Тейлора [15], текстурные параметры – сорбцией азота при температуре –196 °С на анализаторе ASAP 2020 (Micromeritics, США). Распределение пор по размерам осуществляли по изотермам десорбции по методу Баррета, Джойнера и Халенды [16]. Концентрацию кремния в водной суспензии определяли методом атомно-адсорбционной спектрометрии с ацетилено-воздушным пламенем на анализаторе Perkin Elmer 3110 (Perkin Elmer Inc., США).
Оценку токсичности и морфологических особенностей тканей внутренних органов и систем в остром эксперименте при введении тестируемых веществ проводили на материале половозрелых мышей линии С57BL/6J, самцов массой 27,0±2,0 г. Экспериментальные животные были разделены на 10 групп по 10 мышей в каждой. Водную суспензию нанодисперсного диоксида кремния в концентрации 41 мг/см3 вводили животным 1, 2, 3-й опытных групп однократно зондово внутрижелудочно в дозе 500, 1000,
1500 мг/кг в объеме 0,3, 0,6, 0,9 мл соответственно. Животным 1, 2, 3-й групп сравнения вводили микродисперсный водный раствор вещества в концентрации 15,8 мг/см3 в аналогичных дозах и тем же способом в объеме 0,8, 1,6, 2,4 мл. Животным 4, 5, 6-й групп сравнения аналогичным способом вводили водный раствор, содержащий ЦТАВ в концентрации 0,96 мг/см3, что в 10 раз превышает остаточную концентрацию вещества в водной суспензии нанодисперсного диоксида кремния, в объеме 0,3, 0,6, 0,9 мл (в дозах 1,15, 2,30, 3,46 мг/кг). Контрольной группе вводили дистиллированную воду в объеме, эквивалентном объему введенной суспензии экспериментальным животным опытных групп. Критериями токсического действия соединений служили: летальный эффект, среднее время гибели животных, клиническая картина развития интоксикации. Срок наблюдения составил 14 дней.
Животные на протяжении всего эксперимента содержались в условиях лабораторного вивария (по 5 особей в полипропиленовых клетках стандартного размера Т/3) на полусинтетическом рационе согласно методическим указаниям «Токсиколого-гигиеническая оценка безопасности наноматериалов» (МУ 1.2.2520-09). Доступ к корму и питью не ограничивали. Температура в помещениях в период наблюдения составляла 23,0±2,0 °C, влажность воздуха – 60,0±5,0 %. Экспериментальные манипуляции производили в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных». Выживших животных выводили из эксперимента методом декапитации.
У животных, погибших во время эксперимента и выведенных из опыта после его завершения, забирали последовательно печень, селезёнку, почки, сердце, пищевод, тонкий и толстый кишечник, легкие, семенники, тимус, паховые лимфоузлы, полушария головного мозга, мозжечок. Органы фиксировали в 10%-ном растворе нейтрального формалина, затем заливали в парафин. Для подготовки микропрепаратов серийные срезы окрашивали гематоксилином
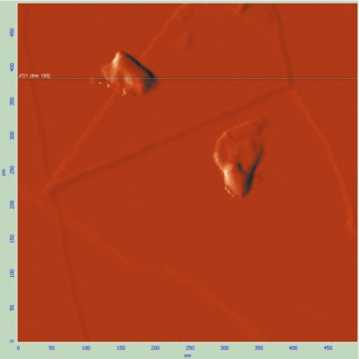
Рис. 1. Изображение синтезированных частиц нанодисперсного диоксида кремния с помощью атомно-силовой микроскопии
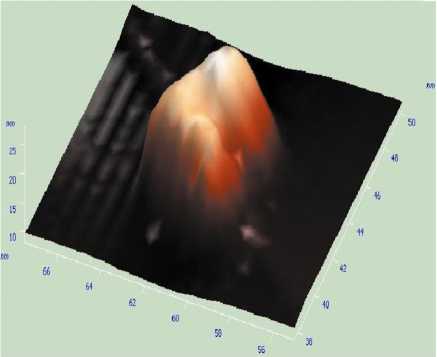
Рис. 2. 3D-конфигурация поверхности синтезированных частиц нанодисперсного диоксида кремния
и эозином, метиловым зелёным и пиронином по Браше с контрольной обработкой РНКазой, шифф-йодной кислотой с контролем амилазой на гликоген и нейтральные гликозаминогликаны (ГАГ), альциановым синим для выявления кислых ГАГ. Визуализацию микропрепаратов осуществляли на световом микроскопе Micros (Micros, Австрия) при увеличении 100–1000 х .
Результаты и их обсуждение. 67 % диспергированных частиц водной суспензии, исследованной в эксперименте, имели эллипсовидную форму с размером меньшей осей 25–35 нм, 33 % частиц имели сферическую форму диаметром 25 нм (рис. 1, 2). Микрочастицы диоксида кремния являлись частицами «традиционной» дисперсности (1 мкм и более), в меньшей из осей имели размер 3,9 мкм.
Удельная площадь поверхности наночастиц составила 96,96 м2/г, что соответствует удельной площади поверхности частиц наноразмерного диапазона (от 50 до 380 м2 на 1 г вещества) и превышает в 7,6 раза удельную площадь поверхности микрораз-мерного аналога (12,54 м2/г).
Острая токсичность (ЛД50) наноразмер-ного диоксида кремния в дисперсном растворе при однократном пероральном зондовом введении составила 4638 мг/кг, что соответствует 3-му классу опасности. Клиническая картина эффектов острой интоксикации характеризовалась в первые 20 мин эксперимента снижением двигательной активности, слабой реакцией на звуковые раздражители. На 2–3-и сутки отмечалось значительное вздутие брюшной полости, поверхностное дыхание, ограничение подвижности. Преимущественная гибель экспериментальных животных зафиксирована на 2–4-е сутки (таблица). Гибели животных с исследованным диапазоном доз для водной суспензии микродисперсного диоксида кремния и раствора ЦТАБ за период наблюдения не установлено (4-й класс опасности).
Установлено, что наночастицы водной суспензии диоксида кремния в дозах 1000 и 1500 мг/кг обладают токсическим действием на форменные элементы крови экспериментальных животных, характеризующимся наличием полихроматофильных эритроцитов (до 25 % от общего числа эритроцитов крови), патологических телец Жоли в эритроцитах крови (до 10 % от общего числа эритроцитов крови), выраженной агрегации тромбоцитов в крови. При введении микродисперсного диоксида кремния в аналогичных дозах негативных эффектов в отношении форменных элементов крови не установлено.
Установлено, что наночастицы водной суспензии диоксида кремния в дозах 1000 и 1500 мг/кг обладают токсическим действием на форменные элементы крови экспериментальных животных, характеризующимся наличием полихроматофильных эритроцитов
Динамика гибели экспериментальных животных после однократного зондового внутрижелудочного введения нано- и микродисперсной водной суспензии диоксида кремния и раствора ЦТАБ
|
№ п/п |
Экспериментальная группа |
Доза, мг/кг |
Число животных в группе |
Сроки наблюдения, сут |
Число погибших животных |
% гибели |
||||
|
1-е |
2-е |
3-е |
4-е |
14-е |
||||||
|
1 |
Опытная |
500,0 |
10 |
0/10 |
0/10 |
0/10 |
1/10 |
0/10 |
1 |
10 |
|
2 |
Опытная |
1000,0 |
10 |
0/10 |
0/10 |
0/10 |
4/10 |
0/10 |
4 |
40 |
|
3 |
Опытная |
1500,0 |
10 |
0/10 |
0/10 |
2/10 |
2/10 |
2/10 |
2 |
20 |
|
4 |
Сравнения |
500,0 |
10 |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
0 |
0 |
|
5 |
Сравнения |
1000,0 |
10 |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
0 |
0 |
|
6 |
Сравнения |
1500,0 |
10 |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
0 |
0 |
|
7 |
Сравнения |
1,15 |
10 |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
0 |
0 |
|
8 |
Сравнения |
2,30 |
10 |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
0 |
0 |
|
9 |
Сравнения |
3,46 |
10 |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
0 |
0 |
|
10 |
Контрольная |
– |
10 |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
0 |
0 |
(до 25 % от общего числа эритроцитов крови), патологических телец Жоли в эритроцитах крови (до 10 % от общего числа эритроцитов крови), выраженной агрегации тромбоцитов в крови. При введении микродис-персного диоксида кремния в аналогичных дозах негативных эффектов в отношении форменных элементов крови не установлено.
Установлены активные пролиферативные процессы в лимфоидной и макрофагальной системах, характеризующиеся множественной мелкоочаговой, реже среднеочаговой лимфогистиоцитарной инфильтрацией в печени с перипортальными среднеочаговыми инфильтратами; немногочисленными мелкими диффузными межканальцевыми инфильтратами в почках, выраженной реакцией мезангиальных клеток и умеренным расширением просветов капсул Шумлянско-го–Боумена почечных телец; заполнением
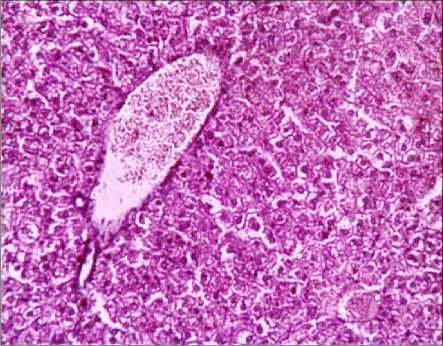
а
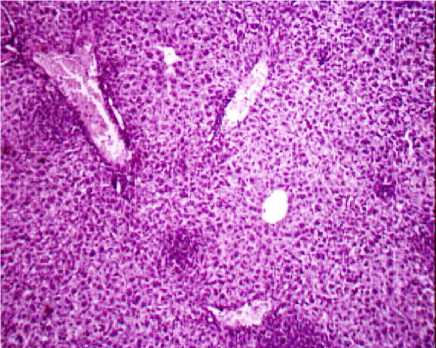
б
Рис. 3. Печень выжившей мыши при однократном зондовом внутрижелудочном введении водной суспензии: а – нанодисперсного диоксида кремния в дозе 500 мг/кг (ув. х 200); б - микродис-персного диоксида кремния в дозе 500 мг/кг (ув. х 200)
а
б
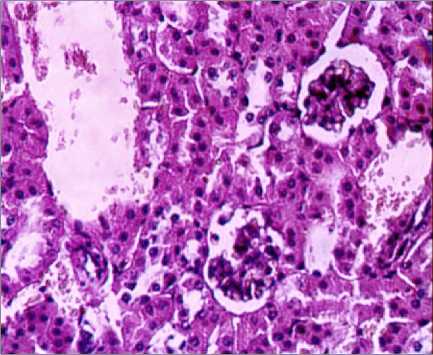
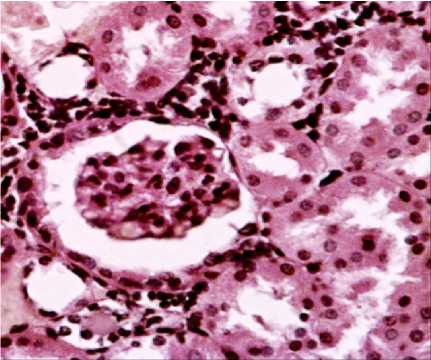
Рис. 4. Почка выжившей мыши (ув. х 400) при однократном зондовом внутрижелудочном введении водной суспензии нанодисперсного диоксида кремния в дозе 500 мг/кг ( а ) и микродисперсного диоксида кремния в дозе 500 мг/кг ( б )
лимфоидными клетками красной пульпы селезёнки, сливным характером лимфатических узелков белой пульпы селезенки; практическим отсутствием мозгового вещества в дольках тимуса, которые в результате этого выглядят гомогенными.
Засвидетельствовано развитие дегенеративных изменений в печени по выраженному полиморфизму ядер гепатоцитов, в почках – по резкому цветовому контрасту между проксимальными и дистальными канальцами, в селезёнке – по увеличению количества апоптотических клеток и клеточного детрита, в легких – по утолщению межальвеолярных перегородок за счёт разрастания интерстициальной ткани.
Выводы. Водная суспензия нанодис-персного диоксида кремния, синтезированного методом темплатирования, при однократном внутрижелудочном зондовом введении по критерию ЛД50 относится к 3-му классу опасности (ЛД 50 – 4638 мг/кг). Мик-родисперсный аналог относится к 4-му классу опасности. Гистологические изменения тканей внутренних органов и систем экспериментальных животных при однократном внутрижелудочном введении водной суспензии нанодисперсного диоксида кремния в дозе 500 мг/кг характеризуются выраженными модификациями системы кровообращения, проявляющимися значительным расширением и полнокровием крупных венозных сосудов печени, почек, тимуса, не обнаруженными при введении микродисперсного аналога. Установлена активация пролиферативных процессов в лимфоидной и макрофагальной системах, печени, почках, красной пульпе селезёнки, в то время как при введении микродис-персного аналога установлены лишь незначительные пролиферативные изменения в печени. Засвидетельствовано развитие дегенеративных изменений в печени по выраженному полиморфизму ядер гепатоцитов, в почках – по резкому цветовому контрасту между проксимальными и дистальными канальцами, в селезёнке – по увеличению количества апоптотических клеток и клеточного детрита, не установленных при введении микродисперсного аналога.
При внедрении нанодисперсного диоксида кремния, синтезированного методом темплатирования, имеющего мезопористое строение, в практическое использование для направленной доставки лекарств необходимо уточнение параметров хронической токсичности при пероральном поступлении. Для обеспечения безопасности персонала, который будет привлечен к процессу производства продукции, целесообразно уточнение параметров острой и хронической токсичности при ингаляционном поступлении.
Список литературы Токсиколого-гигиеническая оценка безопасности водной суспензии нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования
- Товкайло М. Нано в массы [Электронный ресурс]//Ведомости. -2011. -№ 40. -URL: http://www.vedomosti.ru (дата обращения: 18.01.2013).
- Маркетинговый анализ рынков нанопродуктов. -М.: Техносфера, 2008. -349 с.
- Хамидулина Х.Х., Давыдова Ю.О. Международные подходы к оценке токсичности и опасности наночастиц и наноматериалов//Токсикологический вестник. -2011. -№ 6. -С. 53-57.
- Donaldson K., Stone V. Current hypotheses on the mechanisms of toxicity of ultrafine particles//Ann Ist. Super Sanita. -2003. -№ 39 (3). -Р. 405-410.
- Elder A.C.P. The toxicology of nanomaterials. -Rochester, 2007. -37 p.
- Morgan D.L. NTP Toxicity Study Report on the atmospheric characterization, particle size, chemical composition, and workplace exposure assessment of cellulose insulation (CELLULOSEINS)//Toxic Rep Ser. -2006. -Vol. 74. -P. 1-62.
- Токсиколого-гигеническая оценка безопасности нано-и микродисперсного оксида марганца (III, IY)/Н.В. Зайцева, М.А. Землянова, В.Н. Звездин, Е.В. Саенко, А.В. Тарантин, Р.Р. Махмудов, О.В. Лебединская, С.В. Мелехин, Т.И. Акафьева//Вопросы питания. -2012. -Т. 81, № 5. -С. 13-19.
- Meynen P., Cool E., Vansant F. Verified syntheses of mesoporous materials//Microporous and mesoporous materials. -2009. -№ 125. -P. 170-223
- МР 1.2.2522-09. Методические рекомендации по выявлению наноматериалов, представляющих потенциальную опасность для здоровья человека [Электронный ресурс]. -URL: http://www.epidemiolog.ru/law/san/?ELEMENT_ID=3240021 (дата обращения: 17.01.2013).
- Magnetic hollow spheres of periodic mesoporous organosilica and Fe3O4 nanocrystals: fabrication and structure control/L. Zhang, S.Z. Qiao, Y.G. Jin, Z.G. Chen [et al.]//Advanced Materials. -2008. -Vol. 20, is. 4. -Р. 805-809.
- Vallet-Regi M., Balas F., Arcos D. Mesoporous materials for drug delivery//Angew. Chem. Int. Ed. -2007. -№ 46. -P. 7548-7558.
- Нанонаука и нанотехнологии. Энциклопедия систем жизнеобеспечения/под ред. О. Авалелькарим, Чуньли Бай, С.П. Капица. -М.: МАГИСТР-ПРЕСС; ЮНЕСКО; EOLSS, 2009. -1040 с.
- Третьяков Ю.Д., Лукашин А.В., Елисеев А.А. Синтез функциональных нанокомпозитов на основе твердофазных нанореакторов//Успехи химии. -2004. -Т. 73, № 9. -С. 974-998.
- Stöber W., Fink A., Bohn E. Controlled growth of monodispersed spheres in the micron size range//J. Colloid and Interface Sci. -1968. -Vol. 26. -P. 62-69.
- The determination of pore volume and area distributions in porous substances. I. Computations from nitrogen isotherms/E.P. Barrett [et al.]//J. Am. Chem. Soc. -1951. -Vol. 73. -P. 373-380.


