Трансформация акрилонитрила нитрилазой, иммобилизованной на активированном и неактивированном хитозане
Автор: Максимова Ю.Г., Мавлютова Т.А., Максимов А.Ю., Овечкина Г.В., Демаков В.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2013 года.
Бесплатный доступ
Выделенный из штамма Pseudomonas fluorescens С2 ферментный препарат, содержащий нитри-лазу, был иммобилизован на немодифицированном и активированном бензохиноном хитозане. Изучена нитрилазная активность, операционная стабильность и зависимость активности иммобилизованного ферментного препарата от температуры реакции. Показано, что ковалентная сшивка с носителем приводит к возрастанию операционной стабильности и сохранению более высокой активности при температуре 70-80°С.
Нитрилаза, иммобилизация ферментов, хитозан
Короткий адрес: https://sciup.org/147204636
IDR: 147204636 | УДК: 577.152.35
Текст научной статьи Трансформация акрилонитрила нитрилазой, иммобилизованной на активированном и неактивированном хитозане
Нитрилазы (КФ 3.5.5.1) - гидролазы, субъединичная структура которых представлена высокомолекулярными гомоолигомерами, формирующими спиральные структуры. Эти ферменты осуществляют одностадийный гидролиз нитрилов до соответствующих карбоновых кислот. В настоящее время нитрилазы интенсивно изучаются как альтернатива химическим катализаторам. Но их техническое использование затруднено из-за чувствительности к кислороду, связанной с окислением остатков цистеина в активном центре, низкой активности и стабильности [Mateo et al., 2006; Martincova, Кгёи, 2010]. Стабильность нитрилаз может быть увеличена путем иммобилизации на носителях.
Важным этапом приготовления гетерогенного биокатализатора является выбор носителя для иммобилизации фермента. Показано, что нет универсального носителя для всех ферментов, но существует ряд особенностей, которыми должен обладать любой материал, используемый для иммобилизации. Эго высокая аффинность к белкам, гидрофильность, доступность функциональных групп для прямых реакций с ферментами и химических модификаций, механическая стабильность, а также возможность приготовления в различных геометрических конфигурациях, которые обеспечивают проницаемость и подходящую площадь поверхности для выбранной биотрансформации.
Такие характеристики сочетают в себе полиаминосахариды - хитин и хитозан [Krajewska, 2004]. Природные источники хитина практически безграничны, он содержится в ракообразных, насекомых, моллюсках, грибах, дрожжах, кораллах, зоопланктоне. Промышленным способом его получают главным образом выделением из производственных отходов переработки ракообразных [Хитин и хитозан..., 2010]. При деацетилировании хитина получают хитозан - сополимер D-глюкозамина и N-a-цетил-П-глюкозамина. За счет большого количества водородных связей, которые способен образовывать хитозан, он является универсальным сорбентом, связывающим огромное количество различных веществ органической и неорганической природы [Ковалева и др., 2010]. Большое количество свободных аминогрупп в молекуле определяет его способность взаимодействовать с бифункциональными реагентами, образующими химические связи как с молекулой хитозана, так и с молекулой белка, что делает возможным ковалентную сшивку фермента с хитозаном [Максимова и др., 2012].
Известны успешные случаи ковалентного связывания ферментов с активированным хитозаном. Так, при использовании различных активаторов были иммобилизованы липаза [Yi, Noh, Lee, 2009], каталаза [Cetinus, Oztop, Saraydin, 2007], аллиназа [Zhou, Wang, 2009], нитрилгидратаза [Максимова и др., 2012]. В то же время, иммобилизация фермента на немодифицированном хитозане может происхо-
дить путем адсорбции [Ковалева и др., 2010]. Цель настоящей работы - получение иммобилизованных препаратов нитрилазы методом ковалентного присоединения фермента к активированному хитозану и адсорбцией на немодифицированных хитозановых гранулах, сравнение активности и стабильности препаратов в реакции гидролиза акрилонитрила и определение влияния температуры на скорость реакции, катализируемой иммобилизованным и свободным ферментом.
Материалы и методы исследования
Клетки штамма Pseudomonas fluorescens С2, обладающего нитрилазной активностью, выращивали на минеральной солевой среде N следующего состава (г/л): КН2РО4 - 1.0; К2НРО4хЗН2О - 1.6; NaCl -0.5; MgSO4x7H2O - 0.5; СаС12- 0.005; FeSO4x7H2O - 0.01; СоС12х6Н2О - 0.01, в конических колбах объемом 1 л при температуре 30°С и постоянном перемешивании со скоростью вращения 90 об/мин. В качестве источника углерода использовали глюкозу (0.1%), источника азота - ацетонитрил (0.5%).
Клеточную суспензию центрифугировали 20 мин., со скоростью вращения 8500 об/мин., клеточный осадок отмывали фосфатным буфером, содержащим 44 мМ бутират натрия. Осадок клеток ре-суспендировали в 10 мл фосфатного буфера, содержащего бутират натрия в указанной концентрации.
Разрушение клеток проводили на ультразвуковом дезинтеграторе при 22 кГц 7 раз по 20 сек. с охлаждением осадка. Суспензию, содержащую разрушенные клетки, центрифугировали 20 мин. при скорости вращения 8500 об/мин. с охлаждением (4°С).
Высаливание фермента проводили сульфатом аммония до 35% от насыщающей концентрации и центрифугировали 20 мин. при 8500 об/мин. с охлаждением. Осадок ресуспендировали в фосфатном буфере с бутиратом натрия, концентрацию белка определяли по методике Бредфорд. Ферментный препарат хранили при температуре -18 °C.
Раствор хитозана 2% (вес/об.) в 2% (об./об.) уксусной кислоте накапывали через иглу шприца в 1М раствор КОН и оставляли на 40 мин. для затвердения, промывали фосфатным буфером до нейтральной реакции промывных вод. Часть гранул активировали 0.1% раствором бензохинона в течение 15 мин. и промывали 3 раза фосфатным буфером, пятикратно превышающим по объему раствор бензохинона.
Иммобилизацию ферментного препарата на хитозановых гранулах проводили в течение 40 мин. при 22°С, затем гранулы промывали фосфатным буфером до исчезновения белка в промывных водах. Количество связанного белка определяли по разности концентрации белка в растворе до и после контакта с гранулами по методике Бредфорд.
Активность иммобилизованной и свободной нитрилазы (Е) определяли по концентрации продукта - акриловой кислоты (АК) при проведении трансформации 0.07-1.3 М раствора акрилонитрила (НАК) в фосфатном буфере (pH 7.2) при 22°С в течение 40 мин.. Операционную стабильность определяли по сохранению активности при проведении последовательных циклов реакций продолжительностью 24 ч. каждый с 0.58 М раствором акрилонитрила в качестве субстрата, после каждого цикла биокатализатор отмывали фосфатным буфером и хранили при температуре +4...+10°С. Влияние температуры на активность биокатализатора определяли при проведении реакции с 0.58 М раствором акрилонитрила в фосфатном буфере (pH 7.2) в течение 60 мин. в диапазоне температур от 10 до 80 °C с предварительным нагревом в течение 10 мин.
Концентрацию акриловой кислоты определяли методом ВЭЖХ на хроматографе LC-10 «Shimadzu» (Япония) с диодно-матричным УФ- и флуоресцентным детектором и колонкой Synergi 4u Hydro-RP 80А (250г 4.6 мм). В качестве подвижной фазы использовали раствор 25 мМ NaH2PO4, скорость потока составляла 0.5 мл/мин. при температуре 25°С. Удельную ферментативную активность определяли как количество акриловой кислоты в ммоль, образуемое 1 г белка в 1 ч.
Результаты и их обсуждение
Определено количество бежа, связанного не-модифицированным и активированным хитозаном. Показано, что при возрастании концентрации белка в пробе до 18.5 мг/мл связывание белка достигает 55-60% от исходного количества. Установлено, что активация хитозана не приводила к возрастанию количества связанного бежа (рис. 1).
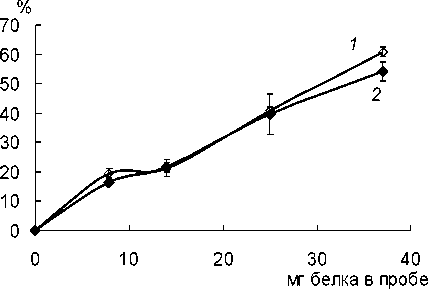
Рис. 1. Связывание ферментного препарата на неактивированном (7) и активированном (2) хитозане; % - концентрация белка в пробе
По-видимому, при связывании бежа с неактивированным хитозаном возникает адсорбция, столь же эффективная, как и ковалентная сшивка с активирующим веществом, когда многочисленные аминогруппы хитозана образуют водородные связи с карбоксильными группами белков.
Изучена активность иммобилизованного и неиммо-билизованного препарата нитрилазы в реакции трансформации акрилонитрила. Показано, что при иммобилизации на хитозановых гранулах, как активированных, так и немодифицированных, наблюдается снижение нитрилазной активности (таблица). Возможно, это связано с деформациями активного центра, происходящими при иммобилизации фермента. Кроме того, хитозановые гранулы адсорбируют продукт реакции - акриловую кислоту. В среднем активированные гранулы адсорбируют 50-70, неактивированные - 40-65% акриловой кислоты. В результате того, что активность фермента оценивается по конечному продукту, истинная активность будет выше измеренной.
Нитрилазная активность иммобилизованных ферментных препаратов и фермента в растворе
|
Концентрация НАК, М |
Активность нитрилазы, ммоль/г/ч |
||
|
На активированном хитозане |
На немодифицированном хитозане |
В растворе |
|
|
0.07 |
21.0 |
5.6 |
13.0 |
|
0.15 |
13.7 |
6.8 |
22.0 |
|
0.29 |
24.0 |
9.4 |
42.5 |
Оценивали операционную стабильность биокатализатора на основе иммобилизованной нитрилазы. Показано, что нитрилаза, ковалентно связанная с активированным хитозаном, более стабильна, чем адсорбированная на немодифицированном носителе (рис. 2).
мг АК
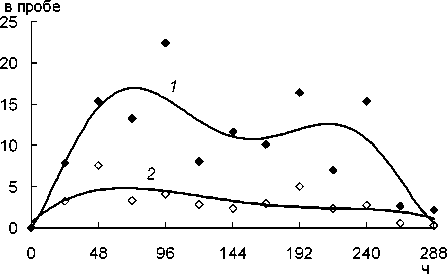
Рис. 2. Операционная стабильность нитрилазы, иммобилизованной на активированном (7) и неактивированном (2) хитозане
В целом, за 312 ч. работы биокатализатора, 2 мг ферментного препарата, иммобилизованного на активированном и неактивированном хитозане, при многоцикловой конверсии НАК образуют 136.5 и 37.5 мг акриловой кислоты соответственно. К 13-му циклу реакции активность иммобилизованной нитрилазы падает.
Изучено влияние температуры на активность нитрилазы, связанной с хитозаном, и фермента в растворе. Показано, что как иммобилизованная нитрилаза, так и фермент в растворе имеет макси мум активности при 60°С (рис. 3). При температуре 70°С наблюдается снижение активности, у неиммо-билизованного фермента на 73%, у связанного с ак тивированным и неактивированным хитозаном - на 36 и 60% соответственно.
Е,
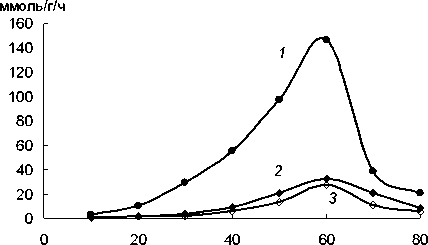
Температура, °C
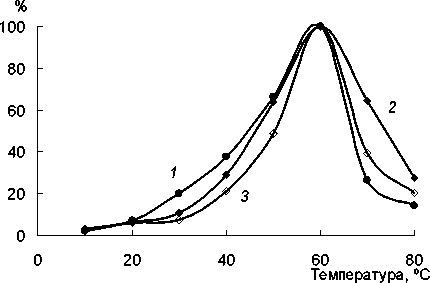
Рис. 3. Влияние температуры на активность нитрилазы в растворе (7) и фермента, иммобилизованного на активированном (2) и неактивированном (3) хитозане; 100% — максимальная активность для каждого биокатализатора
Таким образом, ковалентное присоединение нитрилазы к активированному хитозану приводит к увеличению термостабильности, как по сравнению с адсорбции-ей на неактивированном хитазане, так и с ферментом в растворе.
Следовательно, ковалентное присоединение ферментного препарата, содержащего нитрилазу, к активированному хитозану позволяет получить гетерогенный биокатализатор гидролиза нитрилов, обладающий повышенной операционной стабильностью и устойчивостью к высоким температурам.
Список литературы Трансформация акрилонитрила нитрилазой, иммобилизованной на активированном и неактивированном хитозане
- Ковалева Т.А. и др. Хитозан как перспективный носитель для иммобилизации липазы//Биотехнология. 2010. №4. С. 59-64
- Максимова Ю.Г. и др. Каталитические свойства нитрилгидратазы, иммобилизованной на активированном хитозане//Прикл. биохим. и микробиол. 2012. Т. 48, № 5. С. 484-489
- Хитин и хитозан: природа, получение и применение/под ред. M.Sc.A.P. de Abram. Б.м.: Издано Рос. Хитин. О-вом, 2010. 292 с
- Cetinus S., Oztop К, Saraydin D. Immobilization of catalase onto chitosan and cibacron blue F3GA attached chitosan beads//Enzyme and Microbial Technology. 2007. Vol. 41. P. 447-454
- Krajewska B. Application of chitinand chitosan-based materials for enzyme immobilizations: a review//Enzyme and microbial technology. 2004. Vol. 35. P. 126-139
- Martincova L., Кгёп V. Biotransformations with nitrilases//Current opinion in chemical biology. 2010. Vol. 14. P. 1-8
- Mateo C. et al. Stabilisation of oxygen-labile nitrilases via co-aggregation with poly(ethyleneimine)//J. Molecular Catalysis B: Enzymatic. 2006. Vol. 38. P. 154-157
- Yi S.S., Noh J.-M., Lee Y.-S. Amino acid modified chitosan beads: Improved polymer supports for immobilization of lipase from Candida rugosa II J. Molecular Catalysis B: Enzymatic. 2009. Vol. 57. P. 123-129
- Zhou J.Q., Wang J. W. Immobilization of alliinase with a water soluble-insoluble reversible N-succinyl-chitosan for allicin production//Enzyme and Microbial Technology. 2009. Vol. 45. P. 299-304


